26.6: Correlaciones de Estructura con Reactividad de Compuestos Aromáticos
- Page ID
- 73697
Esta sección se refiere a la correlación cuantitativa de las velocidades de reacción y los equilibrios de las reacciones orgánicas con la estructura de los reactivos. Restringiremos la discusión a los derivados del benceno. El foco está en un tratamiento notablemente sencillo desarrollado por L. P. Hammett en 1935, que ha sido tremendamente influyente. La correlación de Hammett abarca la reactividad química, espectroscopia y otras propiedades físicas, e incluso la actividad biológica de los fármacos. Prácticamente todos los tratamientos cuantitativos de reactividad de compuestos orgánicos en solución comienzan con los tipos de correlaciones que se discuten en esta sección.
La ecuación de Hammett
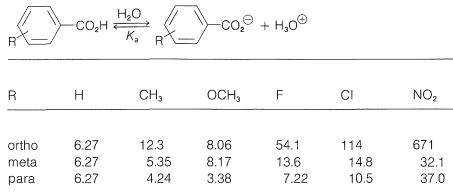
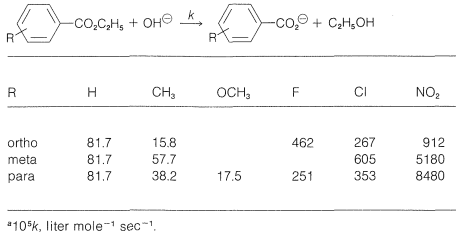
Si comparamos las fuerzas ácidas\(\left( K_a \right)\) de una serie de ácidos benzoicos sustituidos con la fuerza del propio ácido benzoico (Cuadro 26-4), vemos que existen variaciones considerables con la naturaleza del sustituyente y su posición del anillo, orto, meta o para. Así, los tres ácidos nitrobenzoicos son apreciablemente más fuertes que el ácido benzoico en el orden orto\(\gg\) para\(>\) meta. Un sustituyente metoxi en la posición orto o meta tiene un menor efecto de fortalecimiento de ácido, y en la posición para disminuye la fuerza ácida en relación con el ácido benzoico. Los efectos de velocidad también son producidos por diferentes sustituyentes, como es evidente a partir de los datos del Cuadro 26-5 para la hidrólisis básica de algunos benzoatos de etilo sustituidos. Un sustituyente nitro aumenta la velocidad, mientras que los sustituyentes metilo y metoxi disminuyen la velocidad relativa a la del éster no sustituido.
Cuadro 26-4: Constantes\(\left( 10^{-5} \times K_a \right)\) de disociación de algunos ácidos benzoicos sustituidos en agua a\(25^\text{o}\)
Cuadro 26-5: Constantes de velocidad específicas\(^a\) para hidrólisis alcalina de algunos benzoatos de etilo sustituidos en solución\(85\%\) etanol-agua a\(30^\text{o}\)
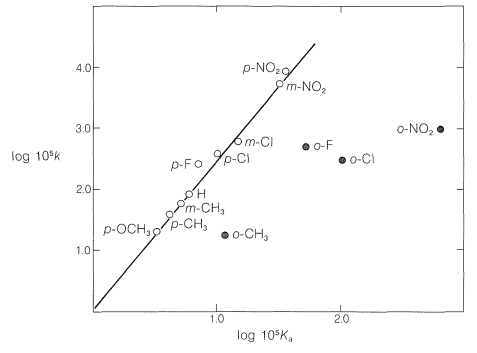
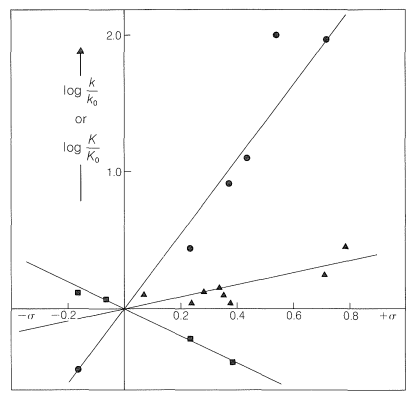
La línea recta en la Figura 26-3 se puede expresar convenientemente mediante la Ecuación 26-3, en la que las dos variables son log\(k\) y log\(K\), la pendiente de la línea es\(\rho\), y la intercepción es\(C\):
\[\text{log} \: k = \rho \: \text{log} \: K + C \tag{26-3}\]
Para el caso particular para el que el sustituyente del anillo es hidrógeno\(\left( \ce{R=H} \right)\), la Ecuación 26-3 se convierte en
\[\text{log} \: k_0 = \rho \: \text{log} \: K_0 + C \tag{26-4}\]
en la que\(K_0\) se encuentra la constante de disociación del ácido benzoico y\(k_0\) es la velocidad de hidrólisis del benzoato de etilo. Restando la Ecuación 26-4 de la Ecuación 26-3 obtenemos
\[\text{log} \: \frac{k}{k_0} = \rho \: \text{log} \: \frac{K}{K_0} \tag{26-5}\]
Esta ecuación podría probarse en las proporciones de cualquier tasa o constante de equilibrio, pero es conveniente reservar log\(\left( K/K_0 \right)\) para la disociación de ácidos benzoicos en agua a\(25^\text{o}\) (Cuadro 26-4) y correlacionar las constantes de velocidad o equilibrio para todos los demás procesos con log\(\left( K/K_0 \right)\). El procedimiento común es reescribir la Ecuación 26-5 como Ecuación 26-6:
\[\text{log} \: \frac{k}{k_0} = \rho \sigma \tag{26-6}\]
en el que\(\sigma\) se define como:
\[\sigma = \text{log} \: \frac{K}{K_0} \tag{26-7}\]
La ecuación 26-6 es conocida como la ecuación de Hammett, pero antes de discutir sus aplicaciones generales, será útil decir más sobre el\(\sigma\) término en la Ecuación 26-7.
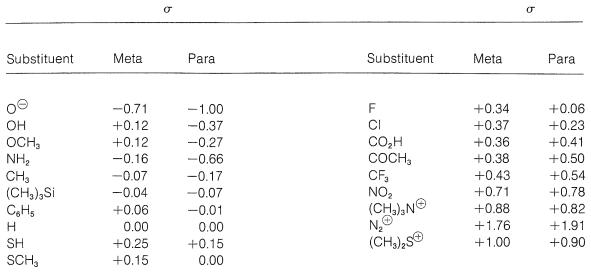
La fuerza relativa de un ácido benzoico sustituido y por lo tanto el valor de\(\sigma\) depende de la naturaleza y posición del sustituyente en el anillo. Por esta razón,\(\sigma\) se llama la constante sustituyente. La Tabla 26-6 enumera varias constantes de sustituyentes y se verá que éstas corresponden al carácter polar de los respectivos sustituyentes. Así, cuanto más atrayente de electrones es un sustituyente, ya sea por resonancia o inducción, más fortalecimiento ácido es, y más positivo es su\(\sigma\) valor (relativo a\(\ce{H}\) como 0.000). Por el contrario, cuanto más fuertemente un sustituyente dona electrones por resonancia o inducción, más negativo es su\(\sigma\) valor. Esperamos que entre los sustituyentes más atrayentes de electrones y donadores de electrones estén aquellos con cargas eléctricas, positivas y negativas respectivamente. En efecto, un grupo diazonio\(\left( \ce{-N_2^+} \right)\) en la posición para tiene un\(\sigma\) valor muy grande de +1.91, mientras que un\(\ce{-O}^\ominus\) grupo para tiene un\(\sigma\) valor de -1.00. En general, las\(\sigma\) metaconstantes corresponden al efecto inductivo del sustituyente mientras que las\(\sigma\) constantes para representan la influencia neta de los efectos inductivos y de resonancia. Si hay un efecto de resonancia sustancial, y éste y el efecto inductivo operan en la misma dirección,\(\sigma_\text{para}\) tendrá una magnitud considerablemente mayor que\(\sigma_\text{meta}\). Lo contrario será cierto si la resonancia y los efectos inductivos operan en direcciones opuestas.
Tabla 26-6: Constantes de sustituyentes Hammett
\ (\ izquierda (\ ce {RC_6H_4} -\ derecha)\) </em lt-chem-22376">

Por lo general,\(\rho\) para una reacción dada se ve influenciada por condiciones como la temperatura y composición del disolvente. Sin embargo, los cambios normalmente no son grandes a menos que ocurra un cambio real en el mecanismo con un cambio en las condiciones de reacción.
Alcance de la ecuación de Hammett
El tratamiento de Hammett proporciona una correlación de muchos datos experimentales. Las Tablas 26-6 y 26-7 contienen 38 constantes de sustituyentes y 16 constantes de reacción. Esto significa que podemos calcular relativos\(k\) o\(K\) valores para 608 reacciones individuales. Para ilustrar, supongamos que necesitamos estimar las velocidades relativas de la Reacción 16 de la Tabla 2-7 para los para-sustituyentes\(\ce{R} = \ce{OCH_3}\) y\(\ce{R} = \ce{CF_3}\). De acuerdo con el\(\rho\) valor de 4.92 para esta reacción y los\(\sigma\) valores de p -\(\ce{OCH_3}\) y p -\(\ce{CF_3}\) en la Tabla 26-6, podemos escribir
\[\text{log} \: \frac{k_{\text{p-OCH}_3}}{k_0} = 4.92 \times \left( -0.27 \right) \text{, and} \: \text{log} \: \frac{k_{\text{p-CF}_3}}{k_0} = 4.92 \times \left( 0.54 \right)\]
Al restar estas dos ecuaciones se obtiene el resultado:
Esto entonces es una relación de tasa de 1/10,000. Si tenemos una tabla adicional de los dieciséis\(k_0\) o\(K_0\) valores para las reacciones enumeradas en la Tabla 26-7, podemos calcular valores reales\(k\) o\(K\) valores para 608 reacciones diferentes. Debe reconocerse que ni el Cuadro 26-6 ni el Cuadro 26-7 son una lista completa; ya se dispone de al menos 80 constantes de sustituyentes\(^1\) y varios cientos de\(\rho\) constantes.
La relación Hammett formaliza y pone en términos cuantitativos gran parte del razonamiento cualitativo que hemos utilizado para reacciones que involucran compuestos alifáticos, alicíclicos y aromáticos. Se ha hecho un esfuerzo considerable para extender la idea de Hammett a fin de abarcar reacciones distintas a los derivados de benceno meta- y para-sustituidos, pero estas no se discutirán aquí. \(^1\)
Limitaciones de la ecuación de Hammett
Los efectos de los sustituyentes en posiciones orto sobre la reactividad de los derivados de benceno no se correlacionan bien con la ecuación de Hammett, como puede verse en la Figura 26-3. El problema es que los sustituyentes orto están lo suficientemente cerca del sitio de reacción como para ejercer efectos significativos de “proximidad”, los cuales pueden ser de origen polar y estérico. Así, la fuerza ácida mejorada del ácido 2-nitrobenzoico sobre los isómeros 3 y 4 (ver Tabla 26-4) puede deberse a una estabilización polar del anión ácido por el nitrógeno positivo vecino, lo que por supuesto no es posible con los isómeros 3 y 4:
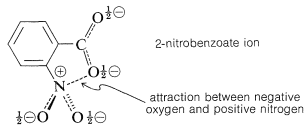
Por el contrario, la velocidad más lenta de hidrólisis alcalina del 2-nitrobenzoato de etilo que de sus isómeros 3 y 4 es más probable debido a un efecto de impedimento estérico del grupo 2-nitro (ver Tabla 26-5):
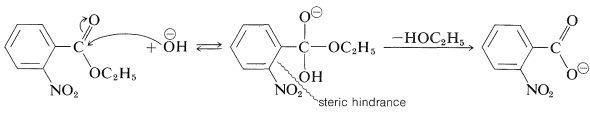
Debido a que no se espera que el efecto del impedimento estérico en diferentes tipos de reacciones sea el mismo, es poco probable que un sustituyente dado ejerza el mismo efecto estérico relativo en una reacción que en otra. En consecuencia, no podemos esperar encontrar una relación muy simple como la ecuación de Hammett que correlacionará la estructura y reactividad de los compuestos orto-sustituidos.
La ecuación de Hammett también falla para los derivados alifáticos de cadena abierta. Por ejemplo, no existe una relación lineal simple entre log\(K\) para una serie de ácidos etanoicos sustituidos\(\left( \ce{RCH_2CO_2H} \right)\) y log\(k\) para las tasas de hidrólisis de etanoatos de etilo sustituidos de manera similar\(\left( \ce{RCH_2CO_2C_2H_5} \right)\). La libertad de movimiento disponible para un compuesto flexible de cadena abierta permite una gama mucho más amplia de variaciones en los efectos estéricos que para compuestos aromáticos meta y para-sustituidos.
La ecuación de Hammett a veces falla para los compuestos aromáticos meta y para-sustituidos. Esta falla puede esperarse siempre que surja la oportunidad de una fuerte deslocalización de electrones entre el sustituyente y el sitio de reacción. Generalmente, las reacciones que están fuertemente asistidas por la donación de electrones al sitio de reacción, como en\(S_\text{N}1\) las reacciones y la sustitución aromática electrófila, serán facilitadas por los efectos de deslocalización de electrones de sustituyentes con pares de electrones no compartidos adyacentes al grupo aromático (por ejemplo\(\ce{-OCH_3}\), \(\ce{-OH}\),\(\ce{-O}^\ominus\)\(\ce{-NH_2}\), y\(\ce{-Cl}\)). Tales reacciones generalmente dan una mala correlación de Hammett. Así, un cloruro de difenilmetilo con un grupo 4-metoxi se solvoliza en etanol\(25^\text{o}\) a una velocidad mucho más rápida que la predicha por la ecuación de Hammett, debido a la estabilización de resonancia proporcionada por el sustituyente al carbocatión intermedio:
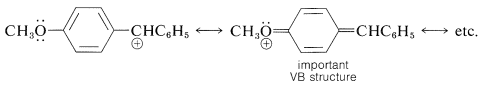
El mismo tipo de estabilización por un grupo 4-metoxi no parece ser importante para influir en la ionización del ácido 4-metoxibenzoico.
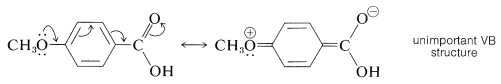
De manera similar, aquellas reacciones que están fuertemente asistidas por la retirada de electrones del sitio de reacción, como la sustitución aromática nucleofílica, dan un mal ajuste a una gráfica de Hammett para los sustituyentes que son capaces de retirar electrones por deslocalización (\(\ce{-NO_2}\),\(\ce{-N_2^+}\), \(\ce{-C \equiv N}\), y así sucesivamente). Un ejemplo es la Reacción 16 en la Tabla 26-7. Para correlacionar los datos de reactividad con estructuras donde operan fuertes efectos de resonancia, se requieren diferentes conjuntos de constantes de sustituyentes. \(^1\)
\(^1\)J. Hine, Efectos estructurales sobre los equilibrios en la química orgánica, Wiley-Interscience, Nueva York, 1975, p. 65. Este libro ofrece una cobertura muy amplia de correlaciones cuantitativas de los efectos de los sustituyentes en procesos tan diversos como la formación de radicales y las tasas de rotación alrededor de\(\ce{C-C}\) enlaces simples.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


