27.8: Espectroscopia de Masas de Ionización Química y Campo
- Page ID
- 73305
Como mencionamos en relación con nuestra discusión sobre la espectroscopia de masas en la Sección 9-11, un problema con la aplicación práctica de los espectros de masas al análisis de estructuras que involucran la producción de iones por impacto electrónico es que el\(\ce{M^+}\) pico puede ser muy débil. En muchas situaciones nos gustaría tener espectros de masas con fragmentación menos intensiva que la obtenible por impacto electrónico. Hay dos formas de lograr la formación de iones sin impartir tanta energía como por impacto de electrones, es decir, ionizaciones “blandas” en lugar de “duras”. La ionización de campo es uno de esos métodos, en el que la ionización resulta del paso de las moléculas a través de un campo eléctrico de\(10^7\) -\(10^8 \: \text{V cm}^{-1}\). Esto puede parecer un campo eléctrico prácticamente inalcanzable. Sin embargo, se puede lograr fácilmente al impresionar un potencial de\(10^4\) voltios a través de un par de electrodos, uno de los cuales tiene un radio de curvatura muy agudo\(\left( \sim 10^{-5} \: \text{cm} \right)\), como se puede lograr con una punta metálica muy fina, alambre muy fino o un borde afilado. La ionización de campo de una molécula difiere de la ionización por impacto de electrones en que el electrón normalmente se expulsa de la molécula en su estado fundamental. Como resultado, el\(\ce{M^+}\) pico de iones progenitores es muy fuerte, incluso para moléculas para las cuales el\(\ce{M^+}\) está prácticamente ausente en el impacto de electrones.
La ionización química es, como cabría esperar de su nombre, más interesante químicamente y está estrechamente vinculada a la resonancia de ciclotrón iónico, que se discutirá en la siguiente sección. El principio de ionización química es simple. La molécula a estudiar se inyecta en la región ionizante del espectrómetro de masas en presencia de\(0.5\) -\(1.5 \: \text{mm} \: \ce{Hg}\) presión de un gas, generalmente metano. El impacto de electrones provoca la ionización del metano, el cual está presente en una concentración relativamente grande. Los productos de ionización del metano reaccionan entonces con el compuesto a analizar y lo convierten en iones. Luego, la mezcla de gases sale a una zona de baja presión\(\left( 10^{-4} \: \text{mm} \right)\) y los iones se analizan de acuerdo a m/e de la manera habitual.
¿Qué pasa\(\ce{CH_4}\) cuando se bombardea con electrones a, digamos,\(1 \: \text{mm}\) presión? La reacción más simple es la formación del\(\ce{M^+}\) ion a partir de\(\ce{CH_4} + \ce{e^-} \rightarrow \ce{CH_4^+} + 2 \ce{e^-}\), pero\(\ce{CH_3^+}\)\(\ce{CH_2^+}\) también son producidos por impacto electrónico. Si es suficiente\(\ce{CH_4}\), se producen una variedad de transformaciones rápidas entre cada uno de los iones producidos por el impacto de electrones y el neutro\(\ce{CH_4}\). Los principales iones formados son
De estos, el catión metonio,\(\ce{CH_5^+}\), se forma en mayores cantidades, el catión etilo,\(\ce{C_2H_5^+}\), es el siguiente, y hay una menor cantidad del\(\ce{C_3H_5^+}\) catión (catión 2-propenilo; Sección 8-7B). Estos iones reaccionan entonces con la sustancia a analizar, convirtiéndola así en iones. Diferentes reacciones son posibles, pero tenemos un compuesto insaturado, llámalo\(\ce{RH}\), entonces
Entonces tenemos un\(\left( \ce{M} - 1 \right)^+\) pico fuerte y más débil\(\left( \ce{M} + 29 \right)^+\) y\(\left( \ce{M} + 41 \right)^+\) picos. Los cationes más grandes probablemente son similares a los formados en la polimerización catiónica (Sección 10-8B), mientras que la formación del\(\left( \ce{M} - 1 \right)^+\) catión corresponde a la reacción de transferencia de hidrógeno discutida en la Sección 10-9.
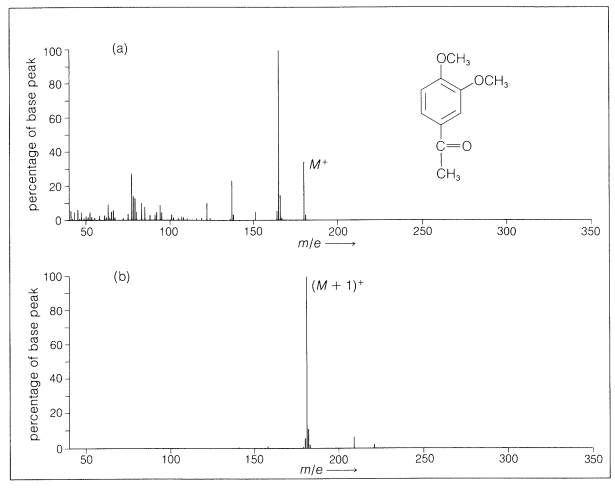
Con muchos compuestos hay poca fragmentación en la ionización química. Un ejemplo de comparación de los espectros resultantes del impacto electrónico y la ionización química se da en la Figura 27-13. La simplicidad de los espectros hace que la espectroscopia de masas de ionización química sea especialmente útil para el análisis continuo del efluente de columnas cromatográficas gas-líquido (Sección 9-2).
Un problema con toda la espectroscopia de masas de moléculas grandes es cómo meterlas en fase vapor para que puedan ionizarse y determinar sus patrones de fragmentación. El simple calentamiento puede provocar una degradación excesiva y la formación de iones que no corresponden a la sustancia deseada. Dos métodos útiles que implican solo un calentamiento local intenso a corto plazo de la muestra parecen ser prometentes en este sentido. Un método utiliza una ráfaga de un potente láser infrarrojo para volatilizar parte de la muestra, y el otro utiliza el bombardeo por partículas pesadas y energéticas de la fisión de núcleos californio-252 para elevar la temperatura local de la muestra a aproximadamente\(10,000^\text{o}\). Esta última técnica volatiliza e ioniza las moléculas de muestra.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


