3.1: Biosíntesis de Ácidos Grasos
- Page ID
- 70149
Los ácidos grasos tienen esqueletos de carbono más grandes que los azúcares, pero son estructuralmente simples. Tienen largas cadenas no ramificadas de átomos de carbono con mucha menos funcionalidad que los azúcares y sin centros de asimetría. Así, son más reducidos (menos oxigenados) que los azúcares. Los animales superiores solo tienen una capacidad limitada de almacenamiento de azúcares como polisacáridos. Por lo tanto, los azúcares se convierten en ácidos grasos que pueden ser almacenados como triésteres de glicerol y utilizados en la biosíntesis de los complejos lípidos polares de membranas y en la biosíntesis de prostaglandinas y tromboxanos, dos grandes grupos de sustancias fisiológicamente activas.
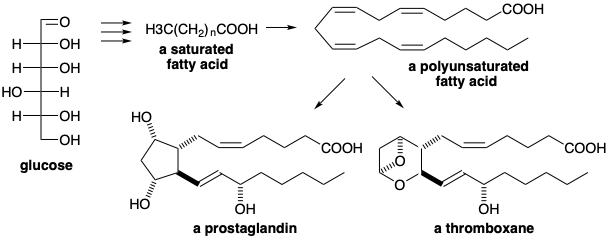
Una estrategia plausible para la biosíntesis del ácido esteárico, que consiste en una cadena de dieciocho carbonos, implica la desoxigenación reductora de un precursor altamente oxigenado 1 que podría ensamblarse por unión polar de tres moléculas de azúcar de seis carbonos (ver abajo). Tal estrategia utilizaría económicamente todos los átomos de carbono en la glucosa para construir el esqueleto de la diana. El grupo carbonilo en fructosa 6-fosfato (F6P) activa la posición 1 hacia la alquilación por carbono 6 en F6P o glucosa 6-fosfato (G6P). La sustitución nucleofílica en la posición 6 desplazaría el oxígeno activador de dos azúcares precursores que suministran el precursor 1 que carece de oxígeno en las posiciones 6 y 12. La eliminación de doce grupos hidroxilo y dos grupos carbonilo restantes y la oxidación del aldehído terminal en el precursor 1 para proporcionar el carboxilo del ácido esteárico requerirían dieciocho equivalentes de hidruro de, por ejemplo, NADPH. El único subproducto de tal síntesis serían dieciocho moléculas de agua. Pero la naturaleza no solo usa la glucosa como fuente de carbono sino que, a excepción de la generación fotosintética del NADPH, también utiliza la glucosa como fuente definitiva de hidruro para toda la biosíntesis orgánica.
La estrategia biosintética real es un proceso ingenioso que co genera todo el agente reductor, NADPH, requerido para la desoxigenación, por oxidación (abstracción de hidruro) a partir de un aldehído intermedio derivado de la glucosa. Los subproductos de la biosíntesis son dieciocho equivalentes de agua así como nueve equivalentes de un subproducto\(\ce{CO2}\). En lugar de tres moléculas de glucosa, que serían necesarias para la primera estrategia, la biosíntesis real consume cuatro moléculas y media de glucosa por cada molécula de ácido esteárico producida. Los carbonos que se incorporan al producto de ácido graso se reducen casi todos mientras que los del\(\ce{CO2}\) subproducto se han oxidado.
Una condición límite que rige la estrategia biosintética para los ácidos grasos es que los reactivos y reacciones deben adaptarse fácilmente a la biosíntesis de una gran selección de ácidos grasos con diferentes longitudes de cadena. Esto sugiere una estrategia repetible de crecimiento en cadena: la adición de un ácido carboxílico (acético) de dos carbonos a la cadena de ácidos grasos en crecimiento mediante una condensación de Claisen. Así, si la estrategia es ser repetible, un carboxilo de cadena más corta servirá como electrófilo y se convertirá en un grupo cetogénico después de la conexión C-C por formación de enlaces polares con un nucleófilo estabilizado con carboxilo de dos carbonos en el carbono α, luego el nivel de funcionalidad del electrófilo (f = 3 para a carboxilo) se convertirá en (f = 2 para una cetona) en el grupo β-ceto resultante derivado del grupo carboxilo en un precursor 2b que incorpora dos carbonos menos.
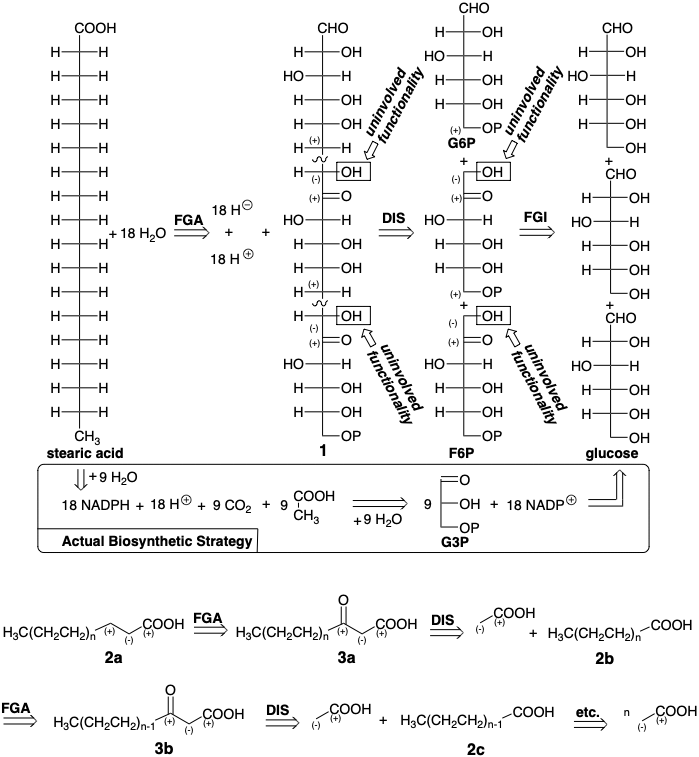
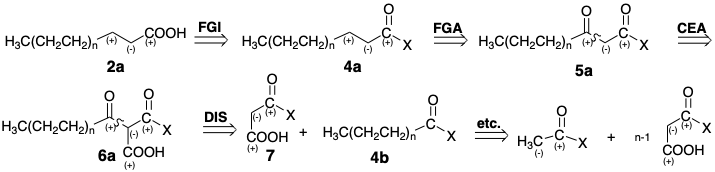
El refinamiento adicional de esta estrategia reconoce la necesidad de un mejor grupo saliente que el hidroxilo, especialmente considerando que la mayor parte del grupo carboxilo estará en forma de carboxilato a pH fisiológico. Esto sugiere la sustitución de la interconversión de grupos funcionales hidroxilo (FGI), en 2a y 3a con un mejor grupo saliente indicado por X en 4a y 5a.
En la biosíntesis, todos los átomos de carbono de un ácido graso se derivan de acetil CoA, que transfiere su grupo acetilo al grupo tiol de una proteína portadora de acilo unida a proteína (ACP). Tanto el acetil-S-ACP como el acetil-S-CoA son tioésteres, los agentes acilantes correspondientes a\(\ce{H3C–COX}\) eso son más electrófilos que sus análogos de oxígeno porque la retrodonación de la densidad de electrones de los electrones no enlazantes de los grandes orbitales de azufre es mucho menos importante que la donación inversa de no unión electrones del oxígeno éster cuyos orbitales se superponen de manera más efectiva con los del enlace π carbonilo.
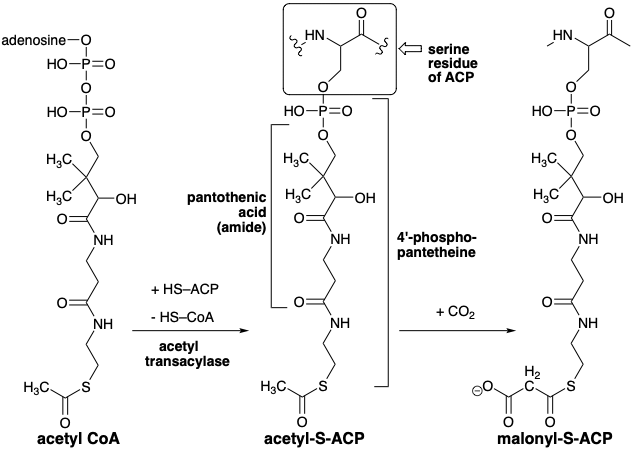
Una característica clave en la biosíntesis de ácidos grasos es el requerimiento de dióxido de carbono como ion bicarbonato, aunque el\(\ce{CO2}\) o no\(\ce{HCO3-}\) se incorpora a los ácidos grasos. Esto sugiere una estrategia en la que\(\ce{CO2}\) se agrega temporalmente a un precursor y luego finalmente se elimina después de que haya cumplido su propósito. De hecho, a excepción de dos átomos de carbono en el extremo alquilo, acetil-CoA no es el precursor inmediato de la cadena carbonada de ácidos grasos. Más bien, se genera una forma activada de acetil CoA, malonil CoA, por carboxilación de acetil CoA. La deficiencia de electrones\(\ce{CO2}\) sugiere que su función podría ser eliminar la densidad electrónica de un intermedio aniónico, por ejemplo, su función podría ser estabilizar un intermedio carbanión como un carbanión en el α-carbono de un grupo acetilo. Así, el nucleófilo que reacciona con acetil-S-ACP podría ser un carbanión derivado del malonato 7. La carboxilación de acetil-S-ACP proporciona malonil-S-ACP.
Para este refinamiento del análisis retrosintético del β-ceto-acilo graso 5a implicaría la adición de un grupo carboxilo activador, adición de elemento control de reactividad (CEA), a un precursor 6a para facilitar la formación de carbaniones (ver página 44). Así, la última etapa sintética de formación de enlaces carbono-carbono es sugerida por una dislocación del precursor 6a que implica la desconexión del enlace carbono-carbono (DIS) sugiriendo un precursor 4b con dos carbonos menos que 5a (tres menores que 6a). La estrategia sintética sugerida por el análisis retrosintético anterior implica la condensación de Claisen de un carbanión malonato derivado de 7 con un precursor 4b con dos carbonos menos que el ácido graso deseado 2a seguido de la descarboxilación de 6a para suministrar 5a y lograr el alargamiento neto de la cadena por dos carbonos.
La carboxilación de acetil-S-CoA es promovida por la acetil CoA carboxilasa e implica la transferencia de un grupo carboxilo de un\(\ce{CO2}\) portador unido a enzima, biotina. El papel de la carboxibiotina en la biosíntesis merece una mayor consideración. \(\ce{CO2}\)Suministra anhidro a un sitio activo que, presumiblemente encapsula los reactivos en un ambiente libre de agua. En un ambiente acuoso,\(\ce{CO2}\) está presente como bicarbonato que es mucho menos electrófilo que anhidro\(\ce{CO2}\). Así, la energía gastada, en forma de hidrólisis de ATP a ADP, da como resultado la conversión de un electrófilo débil en un electrófilo más fuerte. Simultáneamente, se produce una base, el anión biotinilo, que es lo suficientemente fuerte como para abstraer un protón de acetil-S-ACP. Esta abstracción de protones también debe ocurrir en un ambiente aprótico porque de lo contrario el agua protonaría tanto el anión biotinilo como el carbanión acetil-S-ACP.
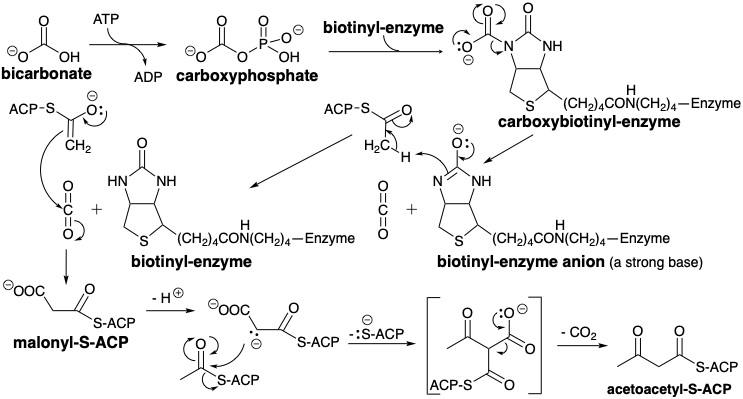
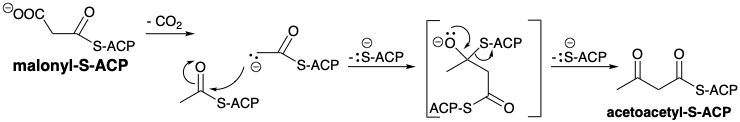
La cadena carbonada de ácidos grasos se ensambla luego mediante una serie de condensaciones de Claisen comenzando con malonilo más acetilo. De hecho, los derivados de CoA de ambos sintones se transforman primero en tioésteres unidos a enzimas de la proteína portadora de acilo (ACP). Los grupos acilo están unidos a la proteína, localizada en el citoplasma, por un éster 4'-fosfopanteteína de un residuo de serina. El grupo acetilo se transfiere luego a un residuo de cisteína específico de otra enzima del complejo de ácido graso sintetasa, β-Cetoacil-ACP sintetasa (HS-Sintetasa). El grupo carboxilo activador en malonil-S-ACP asegura que el metileno de este sintón de acetilo actúa como nucleófilo. Después de la condensación, el grupo activador se pierde para dar acetoacetil-S-ACP.
Existe otra hipótesis razonable para el papel del grupo carboxilo en malonil-S-ACP en la condensación con acetil-S-ACP. En lugar de servir como un grupo activador para facilitar la generación de un carbanión malonilo, puede servir como carbanión latente. Impulsada por la energía liberada tras la formación de un enlace C=O, la descarboxilación puede generar un carbanión acetil-S-ACP en un ambiente anhidro en un sitio activo del complejo de ácido graso sintetasa. Este fuerte nucleófilo sería acilado por acetil-S-ACP para formar acetoacetil-S-ACP directamente. Así, el papel del grupo carboxilato es permitir la generación de un carbanión fuertemente básico sin la necesidad de una base fuerte, y en ausencia de agua que protonaría el carbanión o una base fuerte. Este supuesto papel del grupo carboxilo está relacionado con su papel en la carboxilación de acetil-S-ACP, excepto que en lugar de la descarboxilación generando una base fuerte que abstrae un protón de acetil-S-ACP para producir el carbanión acetil-S-ACP, la descarboxilación de malonil-S-ACP genera el acetil-S-ACP carbanión directamente. En ambos escenarios, la generación de un intermedio fuertemente básico es impulsada por la energía liberada por la formación de un enlace C=O en un ambiente libre de agua requerida para impedir la destrucción del intermedio fuertemente básico.
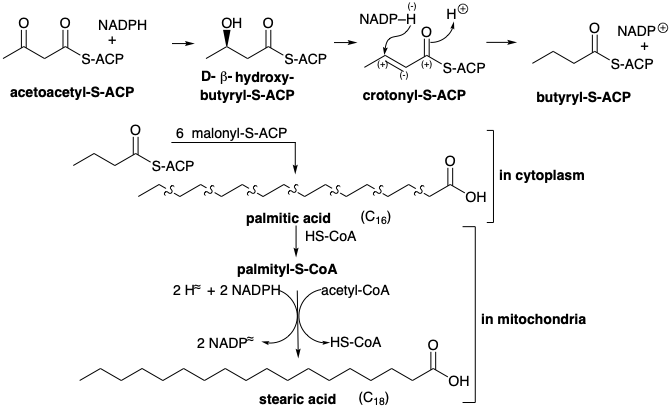
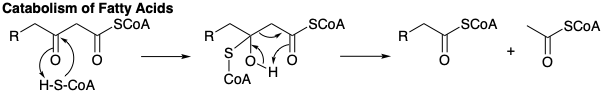
El grupo β-keto se reduce luego a un grupo metileno en una serie de reducciones de hidruro que involucran NADPH. La primera reducción enantioespecíficamente da D-β-hidroxi-butiril-S-ACP bajo catálisis por β-cetoacil-ACP-reductasa. La β-hidroxicetona se deshidrata fácilmente bajo la influencia de la enoil-ACP deshidratasa para dar el tioéster α, β-insaturado, crotonil-S-ACP. La reducción de este último ocurre a través de 1,4-adición de hidruro de NADPH al β-carbono electrófilo de este éster D-2,3-insaturado catalizado por crotonil-ACP reductasa. El butiril-S-ACP resultante luego se condensa con un segundo malonil-S-ACP que conduce finalmente a hexanoil-S-ACP y así sucesivamente hasta que siete moléculas de malonil-S-ACP se han combinado con un acetil-S-ACP. El proceso se detiene en palmitil-S-ACP de donde se libera ácido palmítico por la acción de una desacilasa hidrolítica. El alargamiento adicional de la cadena de carbono ocurre en las mitocondrias mediante la adición de acetil-S-CoA en lugar de malonil-S-CoA. Las mismas enzimas en las mitocondrias catalizan la reacción inversa, el catabolismo (degradación oxidativa) de los ácidos grasos excepto que la reducción de hidruro del éster α, β-insaturado implica NADPH; mientras que, las etapas de deshidrogenación correspondientes en la descomposición de los ácidos grasos a acetil CoA implican una flavoproteína como aceptor de hidrógeno. El catabolismo de los ácidos grasos también difiere mecanísticamente de su anabolismo en que el acetil CoA se produce directamente en la escisión tiolítica de un 3-ceto-acil-CoA graso por CoAh. Es decir, el malonil CoA no está involucrado en el catabolismo de los ácidos grasos.
Existen dos vías diferentes para la biosíntesis de ácidos grasos insaturados. Uno de estos implica la deshidrogenación aeróbica de ácido palmítico o esteárico para dar ácidos palmitoleico u oleico respectivamente. Esta reacción es notable por su regioespecificidad, su estereoespecificidad y porque los átomos de hidrógeno retirados están alejados de cualquier grupo funcional y, por lo tanto, no se activan hacia reacciones químicas. Una característica interesante de la reacción de deshidrogenación es la oxidación concomitante del NADPH. El sistema enzimático es un ejemplo de una clase de oxigenasas que requieren un correductor, como el NADPH, conocido como función mixta de oxigenasas.
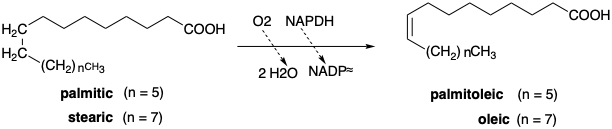
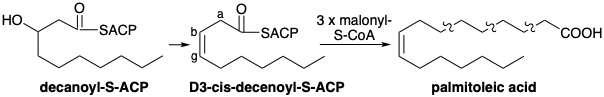
Una vía diferente es operativa en bacterias anaerobias. Así, β-hidroxi-decanoil-ACP es deshidratado por una enzima específica, β -hidroxidecanoil-ACP deshidratasa que produce el cis -β, γ (o Δ 3) -decanoyl ACP en lugar del isómero trans −α, β (o Δ 2) formado en la biosíntesis de ácidos grasos saturados. El alargamiento adicional por malonil-ACP conduce entonces al ácido palmitoleico. Todos los ácidos grasos poliinsaturados biosintetizados en animales surgen del ácido palmitoleico u oleico por elongaciones o deshidrogenaciones de cadena adicionales similares a las descritas anteriormente. Dos de estos ácidos grasos precursores, los ácidos linoleico y linolénico, no pueden sintetizarse en mamíferos y deben obtenerse de fuentes vegetales; por lo tanto, se denominan ácidos grasos esenciales.
La degradación oxidativa (catabolismo) de los ácidos grasos insaturados a acetil-CoA sigue la misma vía que los correspondientes ácidos saturados. Así, las unidades C2 sucesivas se eliminan mediante escisión tiolítica de β-cetotioésteres.
Cuando resulta un tioéster cis-β, γ-insaturado (e.g. 8), es isomerizado bajo catálisis por la enzima enoil-CoA isomerasa al isómero trans-α, β-insaturado (e.g. 9) que es un intermedio en la biosíntesis. Luego, la degradación adicional procede como de costumbre. Dado que la hidratación de un tioéster cis -α, β-insaturado (e.g. 10), promovido por la enoil hidratasa, da una D-3-hidroxiacil-CoA, la epimerización, promovida por 3-hidroxiacil CoA-epimerasa, debe ocurrir antes de que pueda ocurrir una mayor degradación. Es de destacar que solo el enantiómero L se deshidrogena a β-Cetoacil-S-CoA en degradación oxidativa, mientras que solo el enantiómero D se produce en la reducción de un β-Cetoacil-S-ACP durante la biosíntesis de ácidos grasos.


