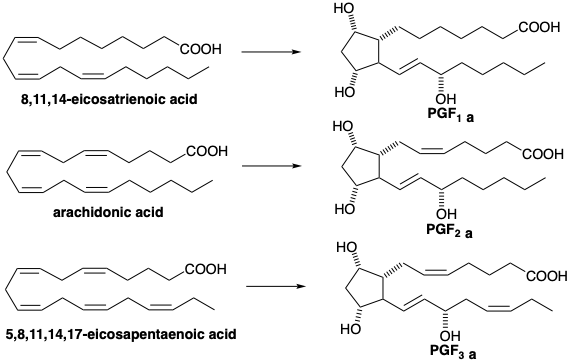
3.2: Biosíntesis de Prostaglandinas
- Page ID
- 70136
Las prostaglandinas son las moléculas esqueléticamente más complejas que hemos considerado. Todas las prostaglandinas son derivados de ciclopentano 1,3-dioxigenados con una cadena lateral de ácido carboxílico de 7 carbonos y una cadena lateral γ-hidroxi-vinilo vecinal de 8 carbonos. Se conocen tres series de prostaglandinas que se ejemplifican por las prostaglandinas F 1α, F 2α y F 3α. Estos se designan PGF 1α, PGF 2α y PGF 3α y respectivamente tienen uno, dos o tres enlaces C=C en las cadenas laterales. Las prostaglandinas son consideradas adecuadamente en este punto ya que su biosíntesis a partir de ácidos grasos tri-, tetra- o pentaenoicos es muy simple, implicando la formación de un solo nuevo enlace C-C. Además, la plétora de síntesis estratégicamente diferentes de prostaglandinas que se han logrado en el laboratorio ofrecen una oportunidad única para apreciar las innumerables soluciones al problema de planear una síntesis molecular compleja.
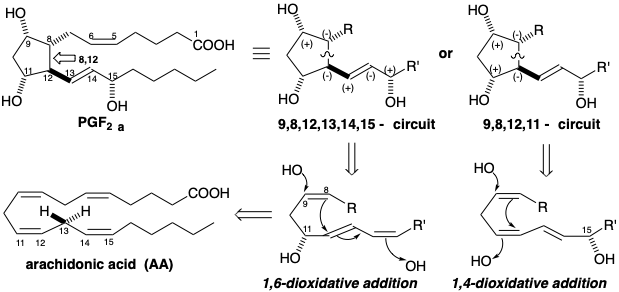
Con la excepción de un puente entre los carbonos 8 y 12, la topología —una cadena no ramificada de veinte carbonos— así como la funcionalidad carboxilo terminal de las prostaglandinas sugieren ácidos grasos como precursores biosintéticos. El análisis de reactividad polar de la prostaglandina F 2α (PGF 2α) revela que el enlace 8,12 se encuentra en un circuito disonante entre los grupos hidroxilo en los carbonos 9 y 11 (el circuito 9,8,12,11-) y un circuito disonante entre los grupos hidroxilo en los carbonos 9 y 15 (el circuito 9,8,12,13,14,15). El enlace 8,12 no se puede formar en una reacción polar que implique activación polar por dos grupos funcionales relacionados con la diana. El patrón de funcionalidad disonante observado podría generarse mediante la adición 1,4-dioxidativa de dos hidroxilos a un precursor de ácido graso 15-hidroxi o mediante la adición 1,6-dioxidativa de dos hidroxilos a un precursor de ácido graso 11-hidroxi. Los precursores de hidroxiácidos grasos necesarios podrían producirse razonablemente por oxidación alílica, por ejemplo de ácido araquicónico (AA), que implica la eliminación de hidrógeno de la posición 13 y la adición de hidroxilo en la posición 11 o 15.
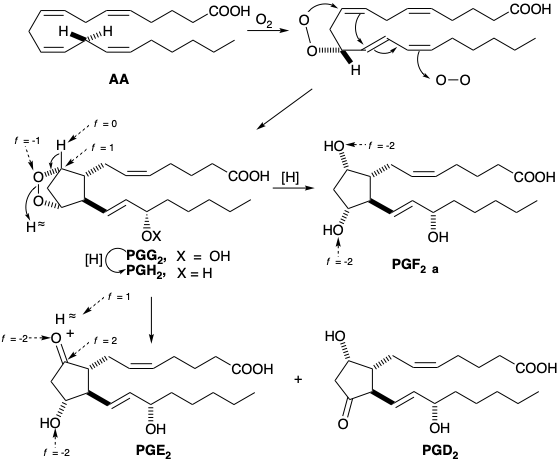
En la naturaleza, las prostaglandinas surgen por una ciclación oxidativa de ácidos grasos poliinsaturados de veinte carbonos, que comienza con la eliminación enantioespecífica del átomo de hidrógeno L del grupo metileno proquiral en C-13 junto con la introducción enantioespecífica de oxígeno en la posición alílica C-15. La posterior ciclación y terminación por adición de una segunda molécula de oxígeno conduce a un peróxido bicíclico 15-hidroperoxi (PGG), que se reduce a un peróxido bicíclico 15-hidroxi (PGH). Estos intermedios, conocidos como endoperóxidos de prostaglandinas, han sido aislados y se ha demostrado que producen prostaglandinas. La reducción del puente peroxi da PGF, mientras que la desproporción da β-hidroxicetonas PGE y PGD. Los carbonos en las prostaglandinas se numeran del uno al veinte comenzando en el carbono carboxilo y siguiendo el sistema de numeración de los ácidos grasos precursores biosintéticos.
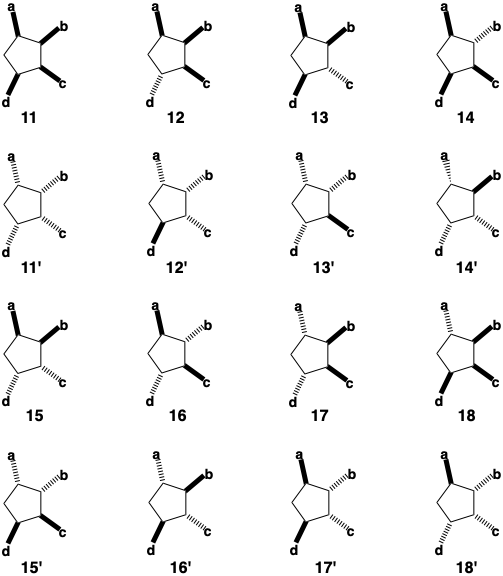
Las características importantes de la biosíntesis de prostaglandinas son su dia-estéreo- y enantioselectividad. Considere las posibles relaciones estereoquímicas entre los cuatro sustituyentes en el anillo ciclopentano de PGF 2α. Hay 2 n diferentes disposiciones posibles para n estereocentros cada uno con dos configuraciones posibles. De las dieciséis posibles disposiciones estereoisoméricas, solo 13' se encuentra en el producto natural. Los isómeros 11 - 18 son diastereómeros. Poseen interrelaciones estereoquímicas únicas de sus cuatro sustituyentes. Así, son estereoisómeros que tienen diferentes configuraciones en uno o más (pero no todos) de sus estereocentros y, por lo tanto, no son imágenes especulares entre sí. Los isómeros restantes 11' - 18' son imágenes especulares o enantiómeros de los otros isómeros. Teniendo en cuenta un quinto estereocentro en la posición 15 de la cadena lateral, hay 32 posibles estereoisómeros de PGF 2α, dos conjuntos enantioméricos de 16 diastereómeros. La biosíntesis es completamente estereoselectiva. Para cualquier síntesis de una molécula compleja, esto es importante porque cuanto menos estereoselectiva sea una síntesis, menor es el rendimiento del producto deseado. Además, la purificación del producto suele ser difícil si está contaminado por estereoisómeros ya que estos a menudo poseen propiedades químicas y físicas que son muy similares a las del isómero deseado. En la biosíntesis de PGF2α, el primer estereocentro, que en la posición 11, se introduce enantioselectivamente por la acción de un reactivo asimétrico (enzima) sobre un precursor proquiral generando solo un intermedio enantiomérico. Tal proceso, conocido como inducción asimétrica, es inherentemente más eficiente que una síntesis que implica la separación de una mezcla racémica de productos enantioméricos (resolución) ya que no se desperdician materiales de partida en la generación de isómeros equivocados. La estrategia biosintética para PGF 2α implica una conexión que une los dos grupos hidroxilo del anillo juntos en un puente temporal. Este último sirve como elemento de estereocontrol asegurando una relación cis entre los hidroxilos en las posiciones 9 y 11, y permite la introducción de ambos átomos de oxígenos de ciclopentano como una sola molécula de oxígeno.
Existen tres categorías estratégicas topológicamente únicas para la síntesis de prostaglandinas: (a) síntesis a partir de precursores acíclicos, (b) síntesis de precursores multicíclicos por escisión de puentes temporales, y (c) síntesis de precursores que contienen un anillo de ciclpentano aislado. Ejemplos de cada tipo estratégico serán considerados en los siguientes tres apartados.


