4.3: Biosíntesis de Sesquiterpenos - Longifoleno
- Page ID
- 70273
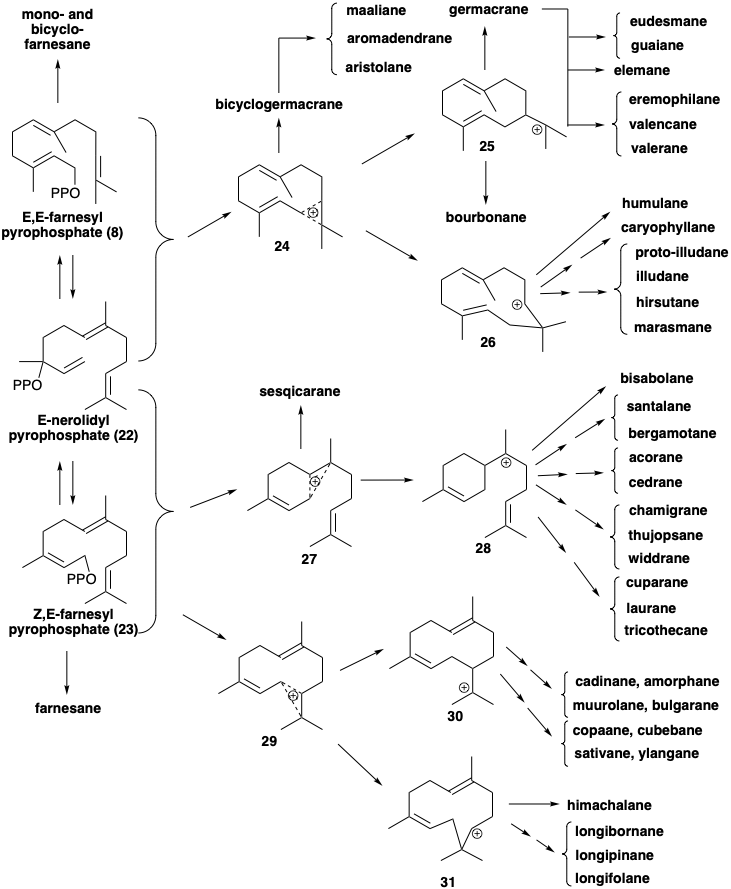
Los sesquiterpenos son compuestos C15 derivados biogenéticamente de E, E-farnesil-PP (8), el isómero alílico nerolidil-PP (22), o el isómero geométrico Z, E-farnesil-PP (23). El ataque nucleofílico por un enlace C=C π sobre el pirofosfato electrófilo genera diversos intermedios catiónicos isoméricos tales como 24-31 que sufren pérdida de protones, captura nucleofílica por nucleófilos externos (especialmente agua) o por otro enlace p C=C para generar una amplia variedad de redes de carbono.
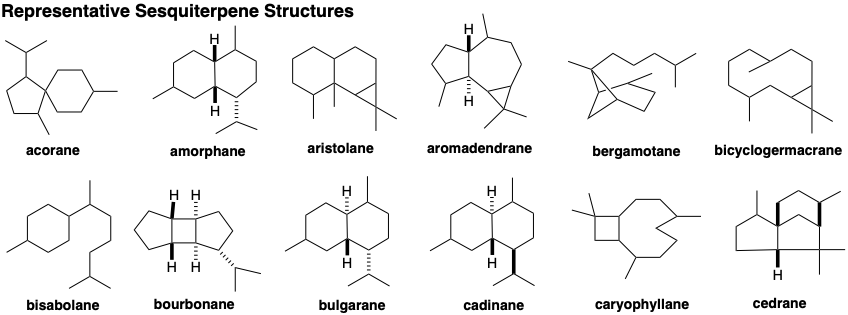
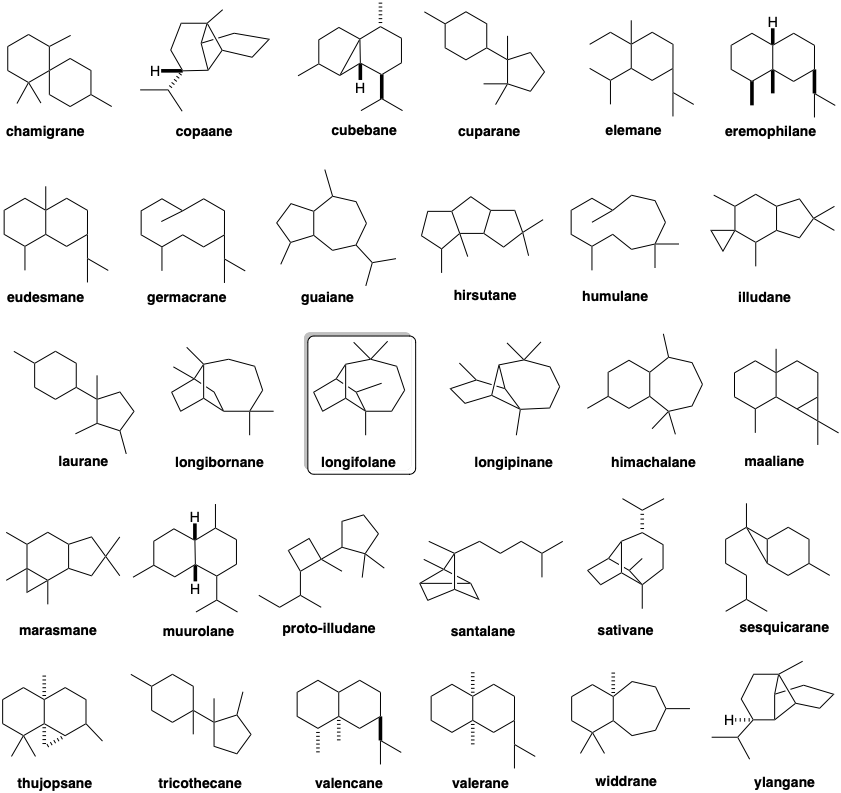
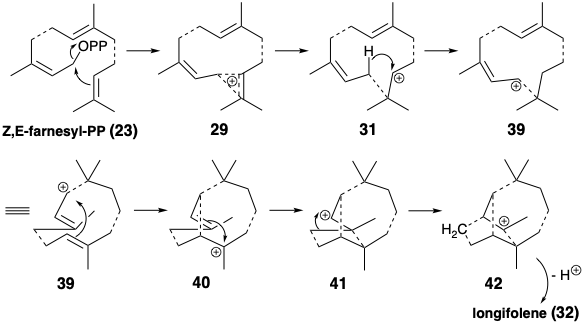
El análisis retrosintético de la biosíntesis del sesquiterpeno longifoleno (32) se canaliza por la condición límite de que el material de partida probablemente sea un trímero cabeza a cola, cabeza a cola de pirofosfatos de isopentenilo. El esqueleto longifoleno es una intrincada red de carbono. El análisis debe simplificar la topología tricíclica mediante desconexiones que generan o conducen a un precursor acíclico como Z, E-farnesil-PP (23). Tres unidades de isopreno son claramente discernibles incrustadas en el esqueleto de longifoleno. El desenmascaramiento del material de partida trimérico acíclico requiere la desconexión de algunos enlaces entre estas unidades de isopreno. Se puede lograr una serie de desconexiones de nucleófilos C=C de electrófilos carbocatiónicos mediante la adición de protones a 32 para dar 33. La ciclación retropoliénica de 33 desconectando un enlace no isoprenoide sugiere el precursor 34. La desconexión similar de este intermedio carbocatiónico sugiere un precursor 35, pero la desconexión adicional de los enlaces no soprenoides no puede proceder de este precursor carbocatiónico. Por lo tanto, la migración de hidruro produciendo un carbocatión isomérico debe seguir la ciclación que genera el esqueleto de carbono de 35. El carbocatión isomérico 36, por otro lado, puede generarse mediante la adición de un electrófilo de carbono a un enlace C=C en 37 que tiene el esqueleto de carbono de un trímero isoprenoide cabeza a cola, cabeza a cola. El intermedio 37 podría generarse a partir de Z, E- farnesil-PP (23) por eliminación de ácido pirofosfórico y posterior adición de un protón a un tetraeno intermedio 38.
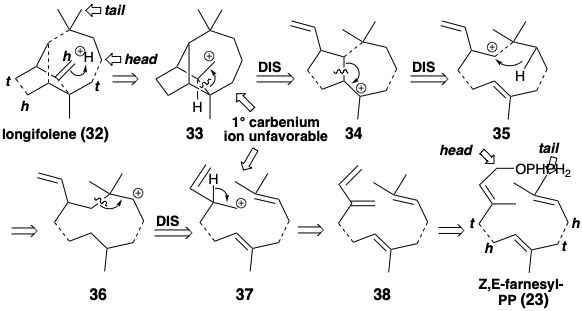
La estrategia biosintética real para el longifoleno (1) es similar a la inferida anteriormente pero evita generar iones de carbenio 1° relativamente inestables como 33 o 37 al explotar una etapa de reordenamiento esquelético. Tales reordenamientos de iones carbenio son una ocurrencia común durante la construcción biológica de redes de carbono, particularmente las de muchos terpenos. La adición del electrófilo alílico a un enlace π-C=C trisustituido nucleofílico en 23 genera 29 o 31 que pueden reorganizarse a un ion carbenio alílico 2° más estable 39 por desplazamiento 1,3-hidruro. La ciclación catiónica de polieno luego entrega un carbocatión bicíclico 3° 40 y luego un carbocatión tricíclico de 2° 41 que sufre [1.2] reordenamiento sigmatropico de carbono, un reordenamiento Wagner-Meerwein, para producir un carbocatión 3° más estable 43 con el longifolano esqueleto. El reordenamiento 41 a 42 es fácilmente reversible (vide infra). La desprotonación de 42 entrega longifoleno.
La biosíntesis de todos los sesquiterpenos multicíclicos implica ciclaciones similares de polienos carbocatiónicos. La canalización de la ciclación a estructuras específicas está indudablemente influenciada por el plegamiento del sustrato de pirofosfato acíclico por diversos catalizadores proteicos (enzimas) que promueven las reacciones y también limitan el acceso del agua a los intermedios carbocatiónicos. De lo contrario, los intermedios carbocatiónicos serían capturados por el agua para producir diversos alcoholes resultantes de la intercepción de los numerosos intermedios. También es posible que el plegamiento provoque yuxtaposiciones de enlaces p que favorecen una formación concertada de varios enlaces sigma sin la generación de numerosos intermedios carbocatiónicos discretos como los mostrados en el esquema anterior para la biosíntesis de longifoleno.