2.3: Reacciones de Carbometalación y Carbociclación
- Page ID
- 73382
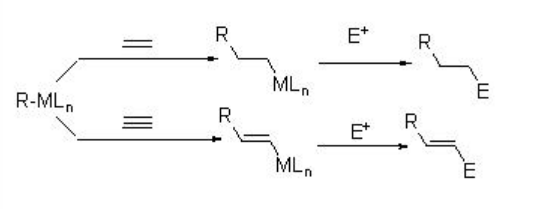
Los compuestos organometálicos agregan a múltiples enlaces carbono-carbono para dar una nueva especie organometálica, que podría modificarse aún más para producir nuevos enlaces carbono-carbono. Estos procesos se denominan como “reacciones de carbometalación”. Se refiere principalmente a la relación entre los reactivos y los productos (Esquema\(\PageIndex{1}\)). Esta sección cubre algunos ejemplos de las reacciones de carbometalación asimétrica utilizando sistemas basados en Rh, Cu y PD.
Reacciones Catalizadas por Rodio
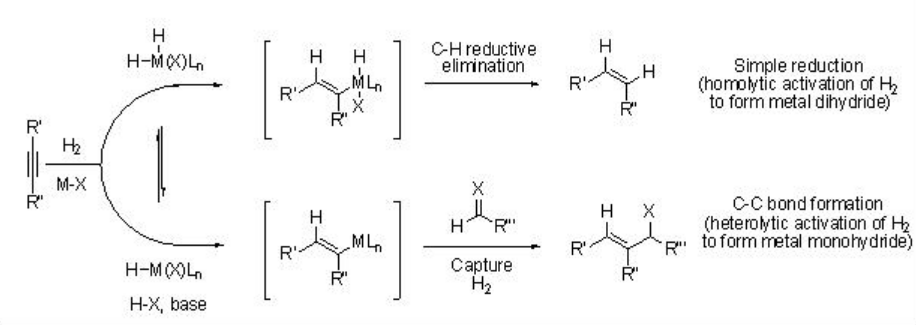
La formación de enlaces carbono-carbono mediada por hidrógeno ha surgido como un poderoso proceso industrial en las industrias químicas. Por ejemplo, las reacciones de hidroformilación y Fischer-Tropsch son bien conocidas para las reacciones de formación de enlaces carbono-carbono mediadas por hidrógeno. Estos procesos requieren la activación heterolítica del hidrógeno molecular para dar especies de monohidruro, donde se desactiva la vía de eliminación reductora C-H. La adición de un hidruro metálico a enlaces múltiplos carbono-carbono (es decir, alqueno y alquino) da especies organometálicas que podrían ser capturadas rápidamente por un electrófilo (es decir, aldehídos e imina) antes de su reacción con hidrógeno molecular mediante adición oxidativa o metátesis de carbono-metal por enlace σ-enlace vínculo. El esquema\(\PageIndex{2}\) ilustra la ruta de dihidruro metálico (que conduce a la hidrogenación) y la ruta de metal-monohidruro (que conduce a la formación de enlaces C-C) con un alquino.
La formación de las especies organometálicas monohidruro depende de la elección del sistema catalítico. Por ejemplo, la activación heterolítica del hidrógeno molecular se observa con complejos catiónicos de rodio en presencia de base. La reacción se realiza a través de la adición de oxidación del hidrógeno molecular con especies metálicas seguido de una eliminación reductora inducida por base de HX (Esquema\(\PageIndex{3}\)).
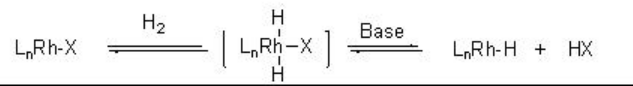
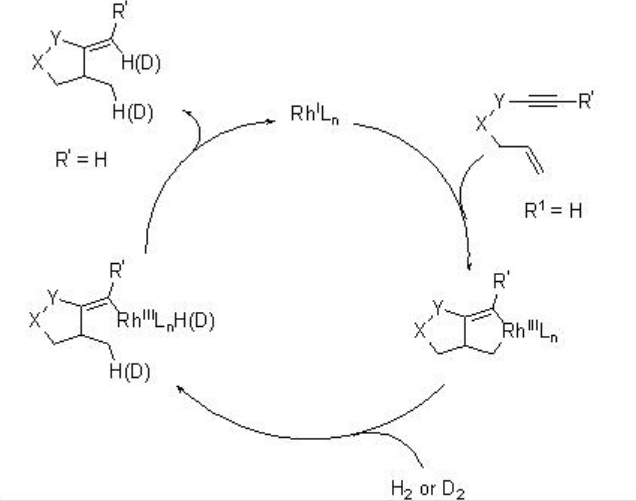
Por ejemplo, Scheme\(\PageIndex{4}\) presenta ciclación reductiva enantioselectiva de 1,6-eninos usando Rh (COD) 2 OTf y (R) -BINAP en presencia de hidrógeno molecular. Esta reacción de carbociclación es compatible con diversos grupos funcionales, sin embargo, el rendimiento y enantioselectividad del producto depende de la estructura de 1,6-eninos y los ligandos.

Se ha propuesto un posible mecanismo para esta reacción basado en experimentos de control de marcaje con deuterio (Esquema\(\PageIndex{5}\)). El ciclo catalítico comienza con la cicloadición de rHl n y 1,6-enino formando rodaciclopenteno. La activación de hidrógeno homolítico a través de la adición oxidativa de hidrógeno molecular o la metátesis de enlace σpuede conducir a la formación de especies vinil-rodio vinílicas que podrían proporcionar un producto de ciclación por eliminación reductora para completar el ciclo catalítico.
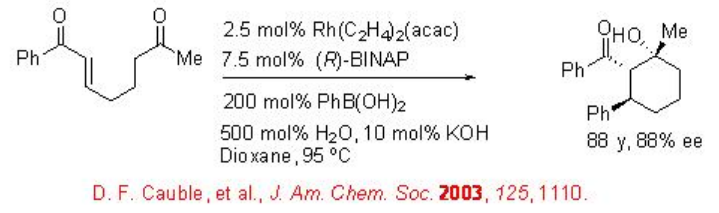
La adición 1,4-conjugada de reactivos organometálicos a compuestos de carbonilo α, β -insaturados proporciona un método efectivo para la formación de enlaces carbono-carbono. Mucho esfuerzo ha sido en el desarrollo de la versión asimétrica de la reacción utilizando una serie de sistemas catalíticos. La primera ciclación aldólica reductiva de ceto-enona con ácido fenilborónico se ha mostrado utilizando Rh [(COD) Cl] 2 y (R) -BINAP con rendimiento y enantioselectividad (Esquema\(\PageIndex{6}\)).
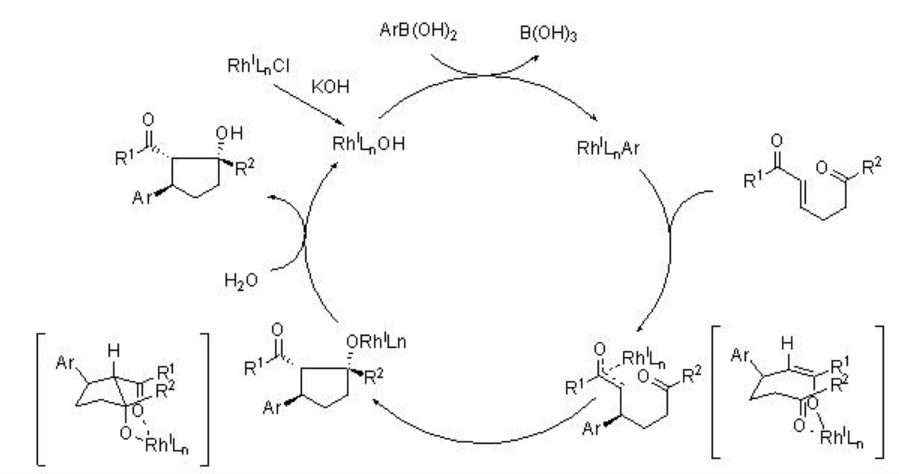
El mecanismo de la reacción se presenta en el Esquema 7. La estereoquímica observada se ha racionalizado asumiendo la formación de Z-enolato.
Reacciones catalizadas por cobre
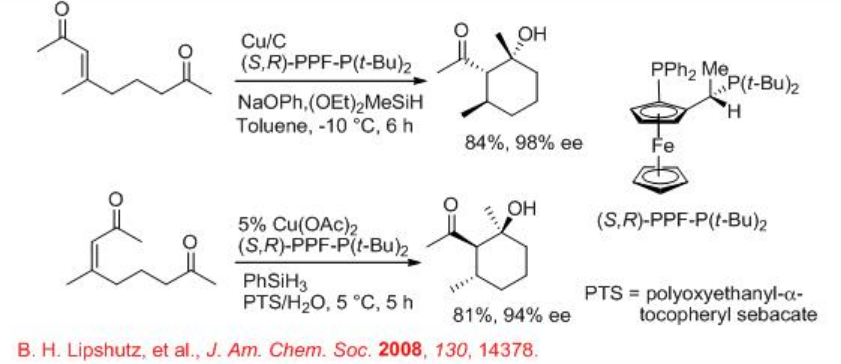
Se encontró que el CuH es un catalizador altamente eficiente para la ciclación aldólica reductiva asimétrica de ceto-enonas para dar el producto objetivo como un diastereoisómero individual con alta enantiopuricia (Esquema\(\PageIndex{8}\)). Estas reacciones utilizan ferrocenilfosfinas, (S, R) -PPE-P (t-Bu) 2, como ligandos quirales efectivos en presencia de silano como fuente de hidruro (Esquema\(\PageIndex{8}\)). Estas reacciones también se pueden llevar a cabo en condiciones heterogéneas así como acuosas con surfactante.
Reacciones Catalizadas por Palladio
Las reacciones de acoplamiento cruzado catalizadas por paladio de haluros de arilo o alquenil con alquenos en presencia de base se encuentran entre las reacciones poderosas en la síntesis orgánica para construir enlaces carbono-carbono. La versión asimétrica de la reacción también está bien explorada. Esquema\(\PageIndex{9}\) -\(\PageIndex{12}\) ilustra algunos ejemplos para las reacciones intramoleculares e intermoleculares de Heck. En 1970 se descubrió la reacción de Heck y, en 1989, apareció el primer ejemplo de reacciones de Heck intramoleculares asimétricas usando Pd (OAc) 2 con (R) -BINAP con enantioselectividad moderada (Esquema\(\PageIndex{9}\)).
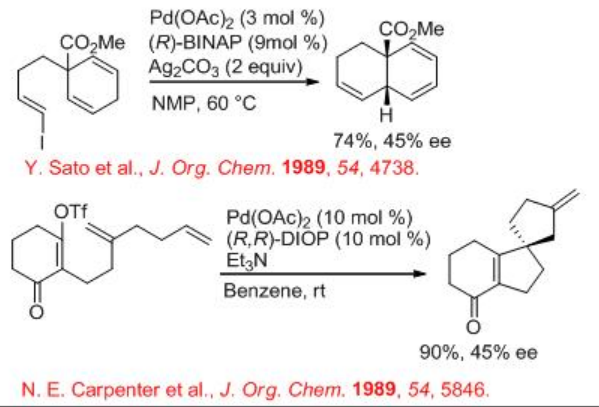
La reacción intramolecular de Heck encuentra amplias aplicaciones en la síntesis orgánica. Entre esas aplicaciones se ha explorado considerablemente la síntesis de oxindoles ópticamente activos que tienen un centro asimétrico cuaternario. Debido a que el grupo oxindol sirve como intermedio sintético útil en la síntesis de numerosos productos naturales. Por ejemplo, (E) - α, β -insaturado-2-yodoanilida se somete a ciclación en presencia de Pd 2 (dba) 3-CHCl 3 y (R) -BINAP para dar oxindoles con configuración (S) o (R) en condiciones catiónicas y neutras, respectivamente. Es de destacar que se ha observado un cambio dramático en la dirección de la inducción asimétrica entre las dos condiciones a pesar de que se emplea el mismo ligando quiral (R) -BIANP. En estas reacciones, Ag 3 PO 4 y PMP actúan como capturadores de HI.
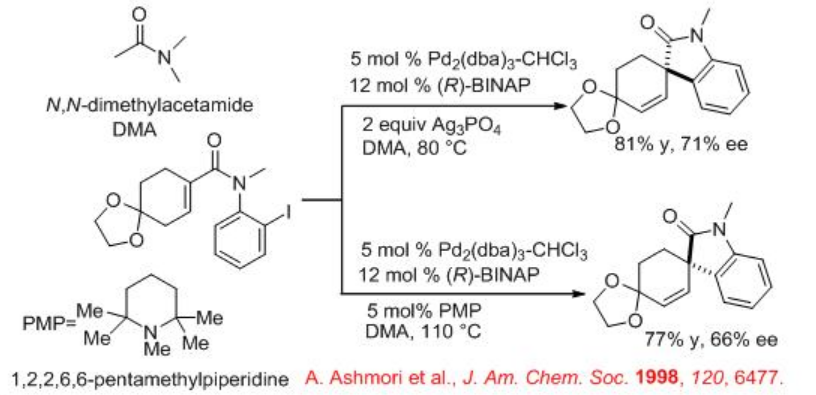
Se ha demostrado el uso de monofosforamida basada en TADOL en lugar de BINAP en la reacción de ciclación intramolecular de derivados de ciclohexadienona (Esquema\(\PageIndex{11}\)). Esta reacción se puede realizar en ausencia de sal de plata.
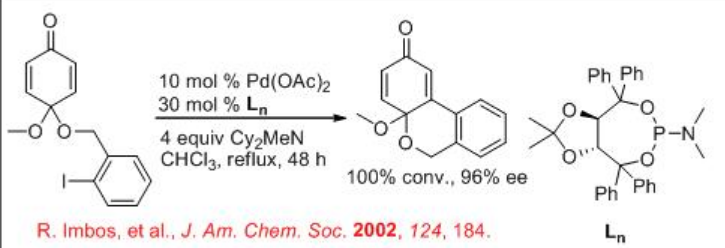
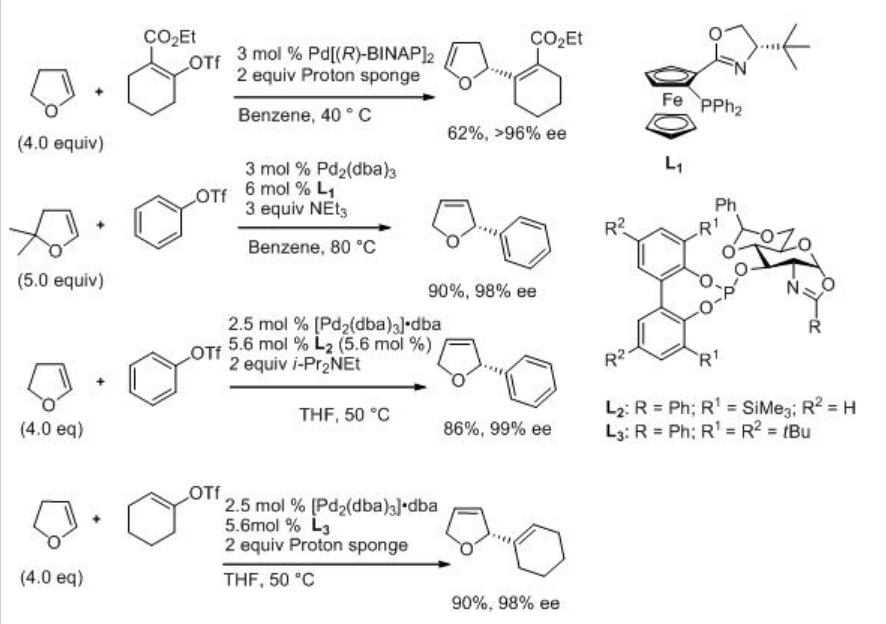
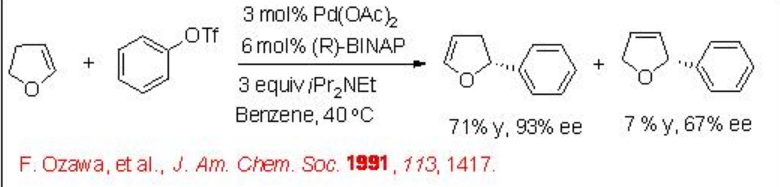
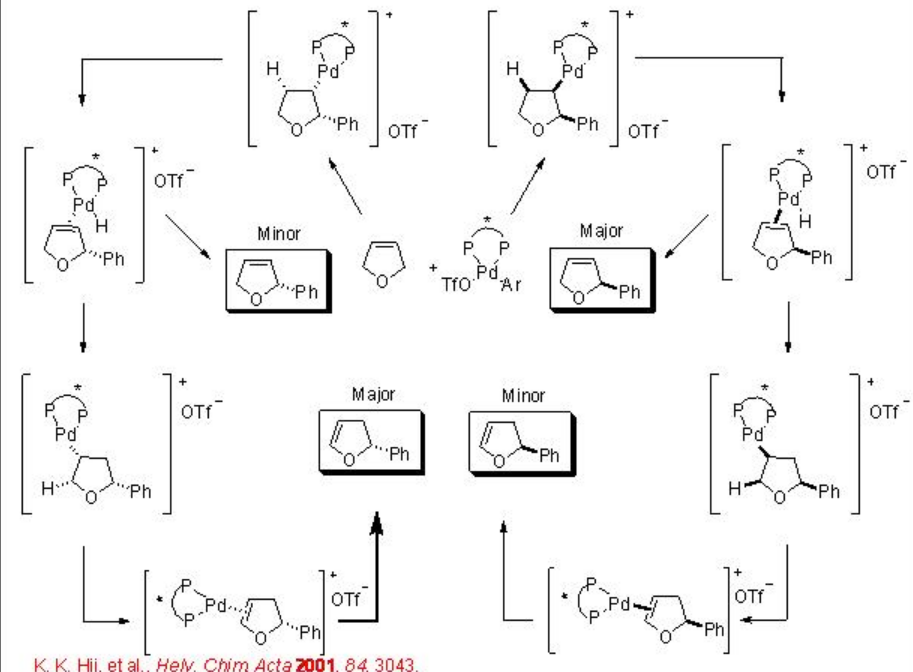
La reacción intermolecular de Heck también está bien estudiada. Por ejemplo, el dihidrofurano reacciona con triflato de fenilo para dar 2-fenil-2,3-dihidrofurano junto con una pequeña cantidad de 2-fenil-2,5-dihidrofurano en presencia de PD-BinAP con excelente enantioselectividad (Esquema\(\PageIndex{12}\)). Se ha propuesto un mecanismo para explicar la alta enantioselectividad del producto principal y la configuración de inversión del producto menor (Esquema\(\PageIndex{13}\)). Implica un proceso de resolución cinética que potencia la enantioselectividad del producto principal.
Esquema\(\PageIndex{14}\) ejemplifica las reacciones de 2,3-dihidrofurano y 2,2-dimetil-2,3-dihidrofurano con triflato de fenilo, triflato de 2-carbetoxi ciclohexenilo y trifato de ciclohexenilo usando complejos de paladio con aminofosfina a base de oxazolina y (D-glucosamina) fosfiteoxazolina como ligandos. Las reacciones son efectivas dando los productos con excelente enantioselectividad.