5.3: Epoxidación de Alquenos No Funcionalizados
- Page ID
- 73098
La epoxidación asimétrica de alquenos no funcionalizados proporciona una estrategia atractiva para la síntesis de compuestos orgánicos ópticamente activos. Esta sección abarca algunos de los desarrollos recientes sobre este protocolo.
5.3.1 Reacciones Catalizadas por Manganeso
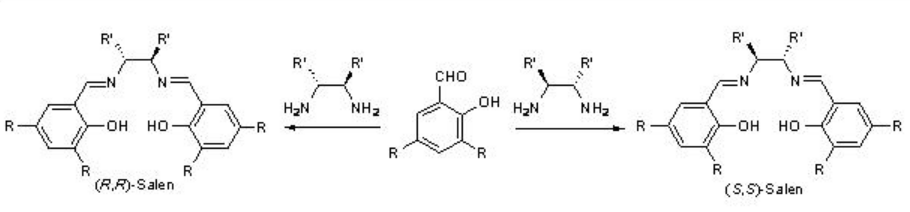
En 1990, los grupos Jacoben y Katsuki reportaron independientemente la epoxidación asimétrica quiral MN-catalziada de alquenos no funcionalizados. Los catalizadores pueden sintetizarse fácilmente mediante la reacción de Mn (OAc) 2 con base de Schiff derivada de 1,2-diaminas quirales y derivados de 2-hidroxibenzaldehído (Esquema\(\PageIndex{1}\)). La reacción con Mn (OAc) 2 en presencia de aire da el complejo Mn (III) que puede aislarse como derivado de cloro después de la adición de cloruro de litio.
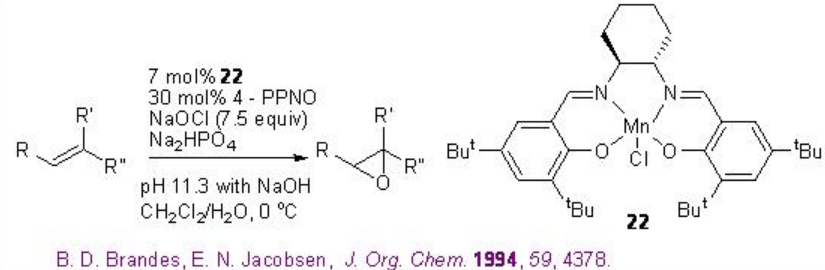
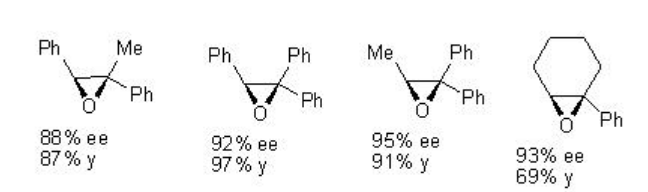
Por ejemplo, Mn-Salen 22 quiral cataliza la epoxidación de alquenos trisustituidos no funcionalizados con 88-95% ee (Esquema\(\PageIndex{2}\)).
Ejemplos:
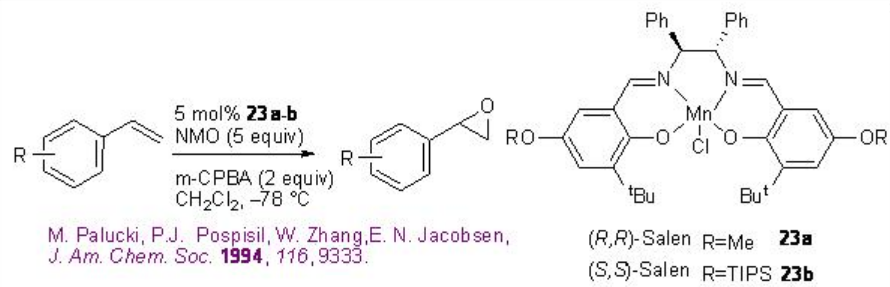
Los derivados de estireno pueden epoxidarse exitosamente usando 23a-b con buena enantioselectividad (Esquema\(\PageIndex{3}\)). La reacción es efectiva usando la combinación de óxido de N-morfolina y ácido m-cloroperbenzoico.
Mecanismo
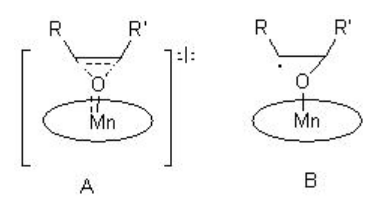
La epoxidación puede proceder a través de una manera concertada (A) o mediada por radicales (B) paso a paso que depende del estado electrónico y de oxidación de la especie oxo (Esquema\(\PageIndex{4}\)).
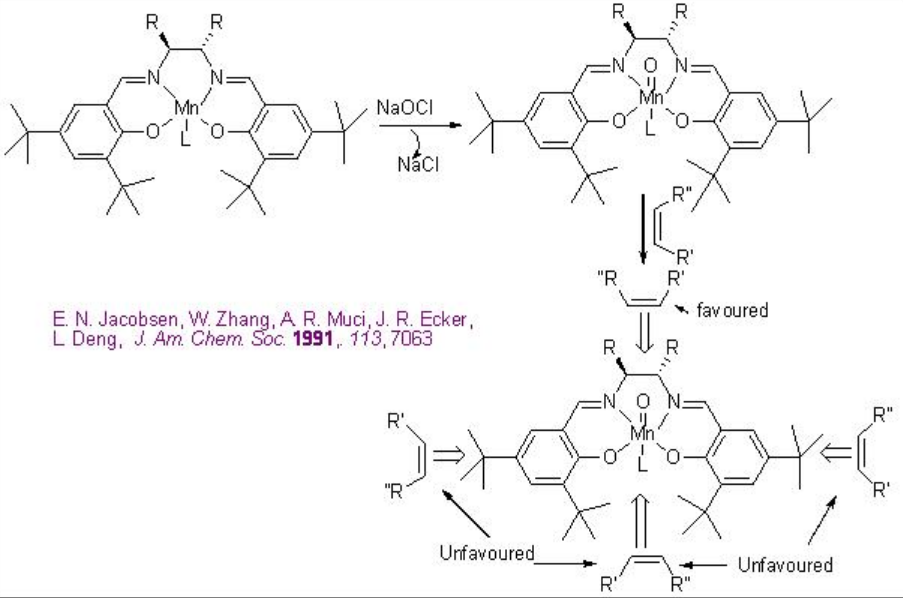
Para dar cuenta del grado y sentido de la enantioselectividad, se ha invocado el enfoque lateral perpendicular del alqueno al intermedio metal-oxo de alta valencia (Esquema\(\PageIndex{5}\)).
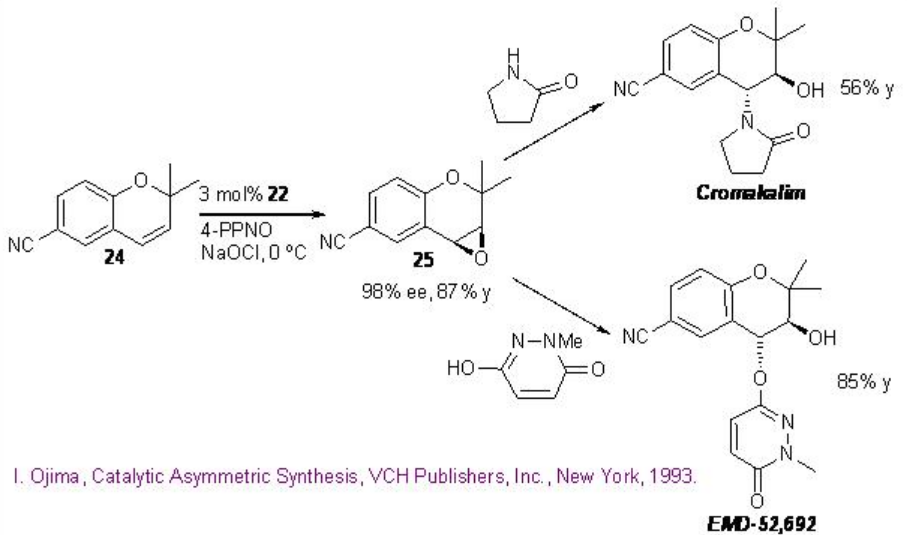
Esquema\(\PageIndex{6}\): Construcción de Agentes Antihipertensivos.
Aplicaciones
La epoxidación de 6-ciano - 2,2-dimetilcormeno 24 con 22 proporciona 25 que pueden convertirse en agentes antihipertensivos cromakalim y EMD-52692 por reacción con nucleófilos nitrogenados apropiados (Esquema\(\PageIndex{6}\)).
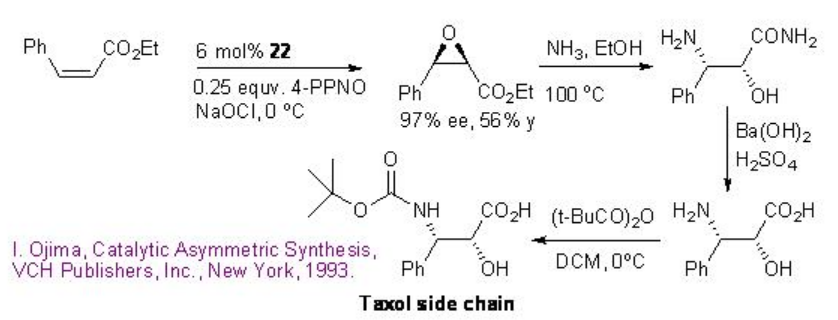
El catalizador 22 se ha utilizado adicionalmente para la epoxidación de éster cis-cinámico en 97% ee y 56% de rendimiento que puede convertirse en cadena lateral de taxol mediante la apertura del epóxido con amoníaco seguido de hidrólisis y protección usando (t-BuCO) 2 O (Esquema\(\PageIndex{7}\)).
5.3.2 Epoxidación aeróbica catalizada por rutenio
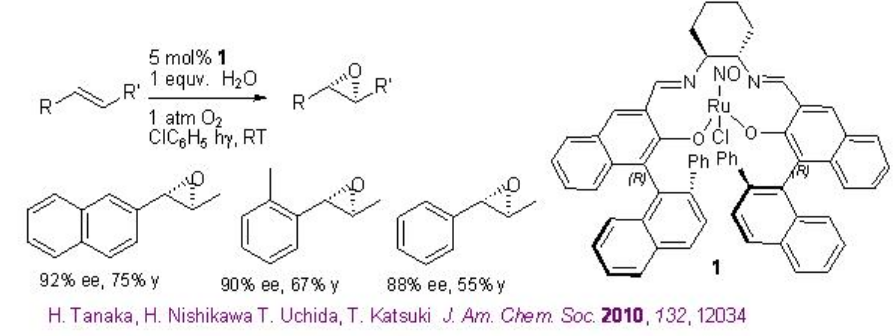
Se ha encontrado que los complejos quirales de Ru (NO) -salen catalizan la epoxidación aeróbica de alquenos en presencia de agua bajo irradiación de luz visible a temperatura ambiente (Esquema\(\PageIndex{8}\)). Este método es atractivo desde el punto de vista ambiental y económico. Los resultados experimentales preliminares observados sugieren que un ligando aqua coordinado con el ion rutenio actúa como agente de transferencia de protones para el proceso de activación de oxígeno.
5.3.3 Epoxidación Catalizada por Titanio con Peróxidos de Hidrógeno
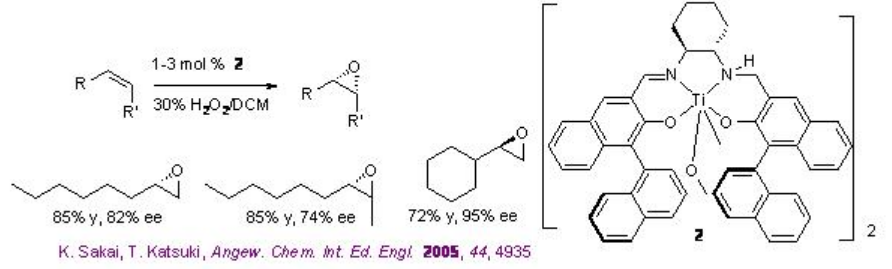
El uso de Ti (salan) para la epoxidación de alquenos se ha demostrado en presencia de H 2 O 2 acuoso. La reacción es estereoespecífica y no se ha observado descomposición de H 2 O 2. La característica más llamativa de este sistema son los alquenos alifáticos que son uno de los sustratos más desafiantes para que la epoxidación asimétrica se pueda oxidar exitosamente con alta enantioselectividad (Esquema\(\PageIndex{9}\)). Además, el complejo de titanio generado in situ derivado de 3 (SALANEL) y Ti (O i Pr) 4 en CH 2 Cl 2 cataliza la epoxidación de alquenos en presencia de tampón fosfato con excelente enantioselectividad (Esquema \(\PageIndex{10}\)).
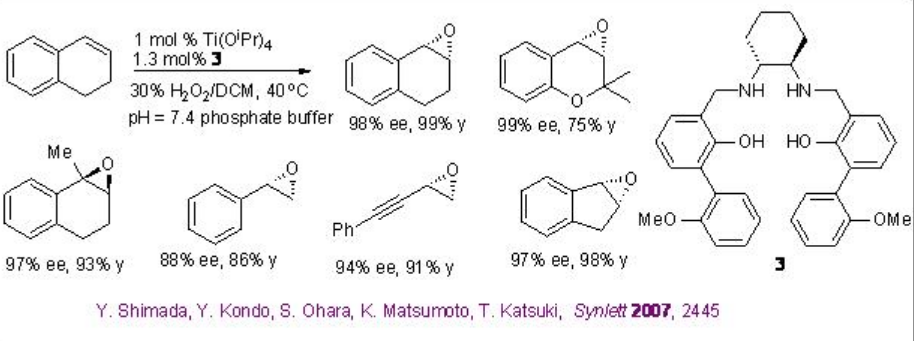
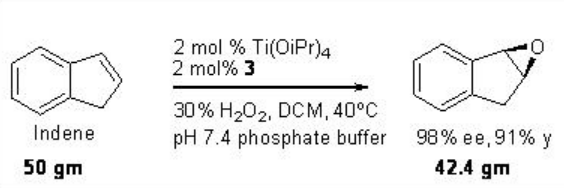
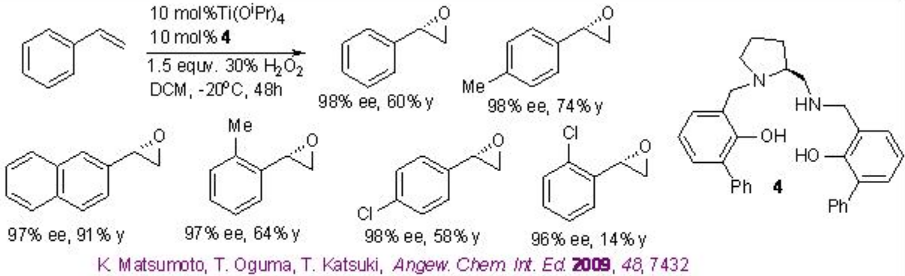
Este protocolo de epoxidación se ha aplicado con éxito a una síntesis a escala multigramo de óxido de indeno. Mientras que el C1 a base de prolina -Ti- simétrico (salan) de 4 y Ti (O i Pr) 4 se ha encontrado que son excelentes catalizadores para la epoxidación de derivados de estireno (Esquema\(\PageIndex{11}\)).
5.3.4 Epoxidación catalizada por lantanoides
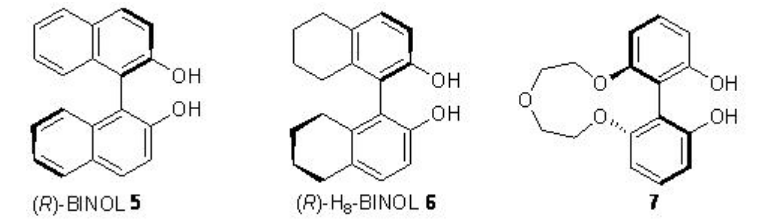
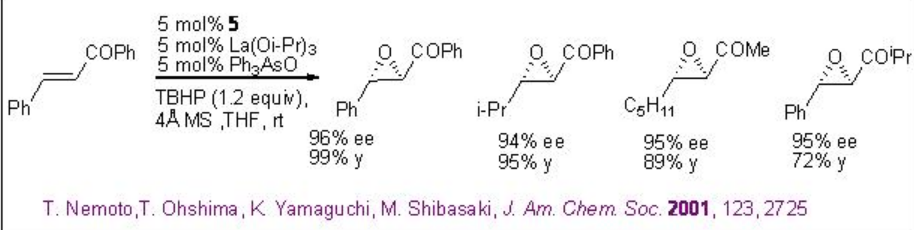
Los métodos de epoxidación nucleofílica representan una alternativa viable a los métodos electrófilos, muchos de los cuales no epoxidan dobles enlaces pobres en electrones. Se ha encontrado que los catalizadores basados en lantánidos derivados de ligandos quirales 5-7 son efectivos en la epoxidación de cetonas α, β-insaturadas (Esquema\(\PageIndex{12}\)). Se trata principalmente de epoxidación nucleofílica de dobles enlaces deficientes en electrones a través de la acción de oxidantes nucleófilos.
Mecanismo propuesto
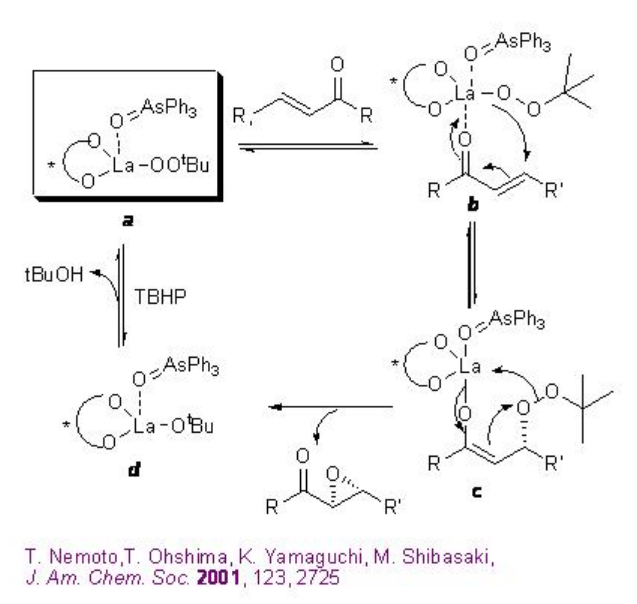
Una mezcla 1:1:1 de La (O i Pr) 3, BINOL y Ph 3 As=O puede proporcionar el complejo activo a en el medio de reacción (Esquema\(\PageIndex{13}\)). La activación de la enona b por coordinación al metal lantano seguida de 1,4-adición de peróxido de lantano puede conducir a la formación de enolato c que podría proporcionar el epóxido y el intermedio d. Este último con TBHP puede proporcionar el complejo activo a para regenerar el ciclo catalítico.
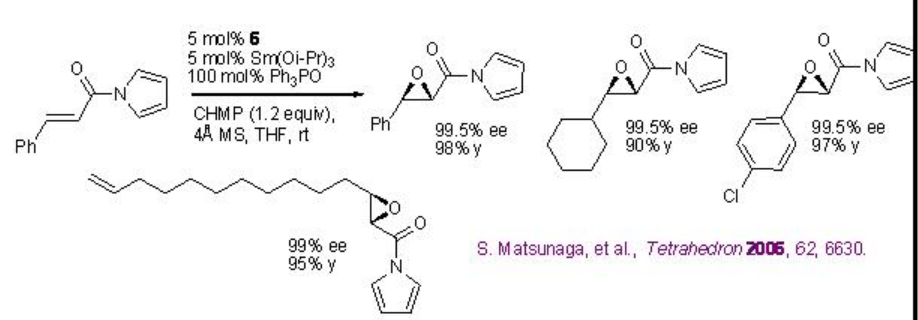
La sustitución de La (O i Pr) 3 por Sm (Oi-Pr) 3, (R) -BINOL 5 por (R) -H 8 -BINOL 6, Ph 3 As=O por Ph 3 P=O y TBHP por CHMP mejora en gran medida el rendimiento y la pureza enantiomérica en condiciones similares para alquenos portadores de amidas (Esquema\(\PageIndex{14}\)).
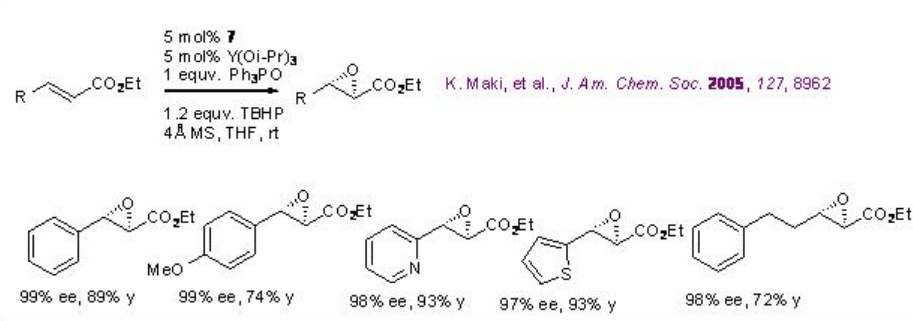
El catalizador derivado de 7 e Y (O i Pr) 3 cataliza la epoxidación de ésteres α, β -insaturados con excelente enantioselectividad (Esquema\(\PageIndex{15}\)). El sistema es compatible con alquenos portadores de anillos heteroaromáticos.
5.3.5 Organocatálisis
Se han logrado avances notables en la epoxidación asimétrica de alquenos mediante catálisis orgánica. Las cetonas quirales se encuentran entre los catalizadores de epoxidación más desarrollados. El dioxirano activo se genera a partir de cetona y oxona (peroxomonosulfato de potasio) o peróxido de hidrógeno en condiciones de reacción más suaves. Entre las muchas cetonas quirales útiles reportadas, la cetona derivada de fructosa desarrollada por el grupo Shi es el catalizador más confiable con respecto a alta enantioselectividad y amplio alcance de sustrato (Esquema\(\PageIndex{16}\)).
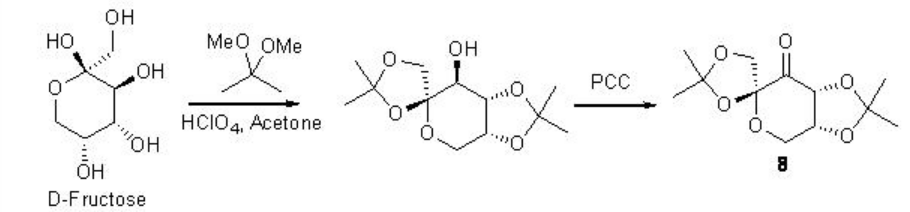
Por ejemplo, en presencia de 8 (típicamente 20-30 mol%), una variedad de alquenos trisustituidos procede a la reacción con excelente enantioselectividad (Esquema\(\PageIndex{17}\)).
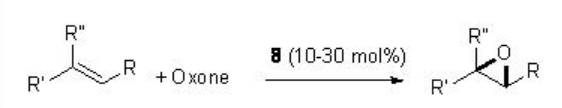
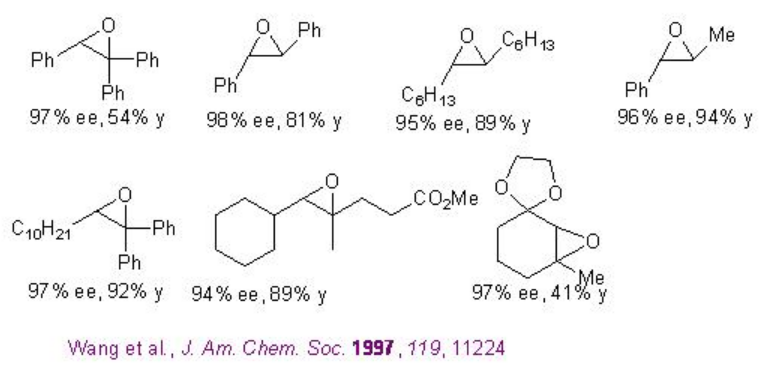
Ejemplos:
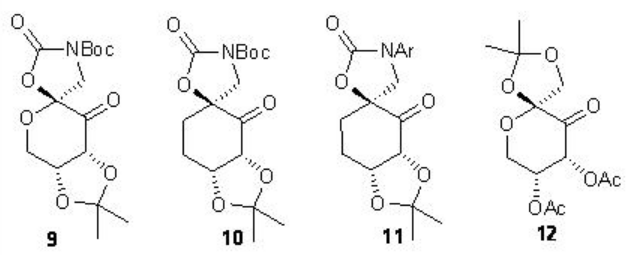
En el caso de los alquenos cis y terminales, la cetona derivada de glucosa 9 con N-Boc oxazolidinona proporciona alta enantioselectividad. También se han introducido un análogo carbocíclico 10 y variantes sustituidas con N-arilo 11 para la epoxidación de derivados de estireno y alquenos cis-disustituidos. Además, se ha encontrado que la cetona quiral 12 con acetato aceptor de electrones cataliza la epoxidación de éster α, β -insaturado con altas enantioselectivias.
Mecanismo propuesto
El esquema\(\PageIndex{18}\) muestra el ciclo catalítico propuesto y el estado de transición más favorecido para las epoxidaciones quirales basadas en cetonas en presencia de oxona como oxidante terminal.
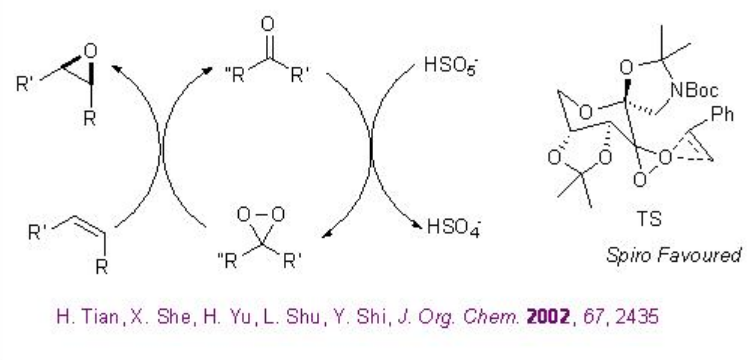
Posteriormente se ha encontrado que la epoxidación quiral catalizada por cetonas es efectiva usando la combinación de peróxido de hidrógeno y acetonitrilo como oxidante alternativo. Por ejemplo, la cetona quiral 8 se ha utilizado para la epoxidación de una variedad de alquenos con rendimientos y enantioselectividad comparables (Esquema\(\PageIndex{19}\)).
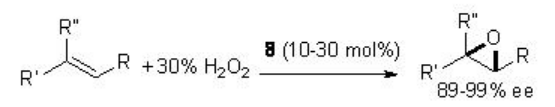
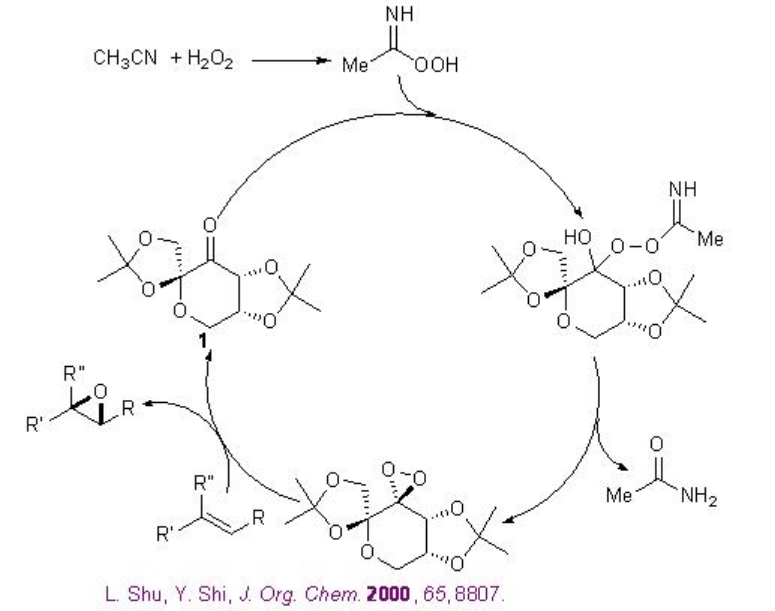
Mecanismo propuesto
En este protocolo, el acetonitrilo reacciona con peróxido de hidrógeno para generar ácido peroxiimídico y luego reacciona con la cetona para dar el dioxirano activo. Bajo estas condiciones, se genera como producto una cantidad estequiométrica de la amida.
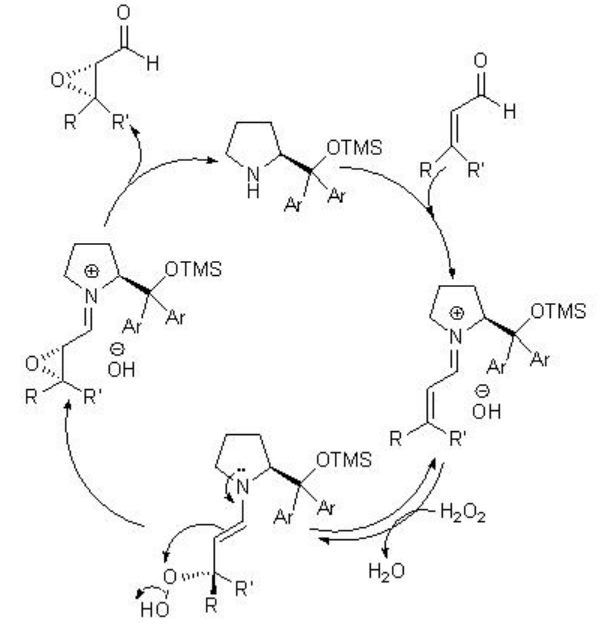
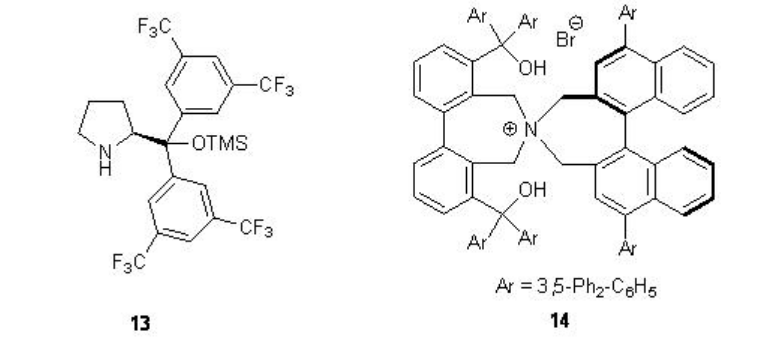
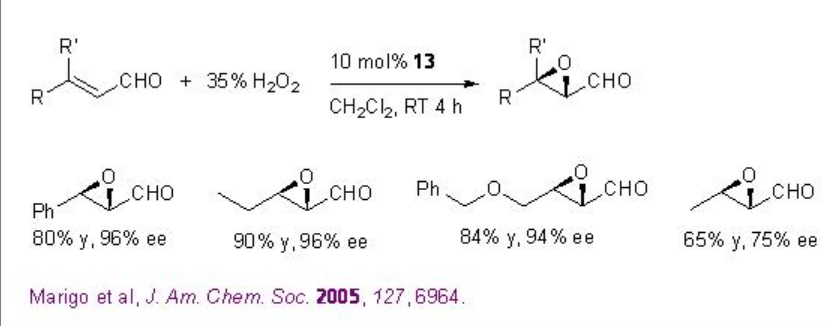
Además de las cetonas quirales, se han explorado los catalizadores 13 y 14 a base de amina quirales para la epoxidación de alquenos no funcionalizados. Por ejemplo, la pirrolidina quiral 15 se ha utilizado para los aldehídos α, β -insaturados con excelente enantioselectividad en presencia de 35% H 2 O 2 (Esquema\(\PageIndex{20}\)). Los aldehídos α, β -insaturados que contienen un sustituyente aromático en la posición β son buenos sustratos proporcionando los epóxidos con altas diastereo- y enantioselectividades.
Mecanismo propuesto
El mecanismo propuesto establece que la reacción se lleva a cabo a través del mecanismo Weitz-Scheffer (Esquema\(\PageIndex{22}\)). La adición de peróxido de hidrógeno al átomo de carbono β del ion iminio electrofílico es reversible y el ataque al átomo de oxígeno electrófilo por parte de la enamina nucleofílica determina la estereoquímica del producto.
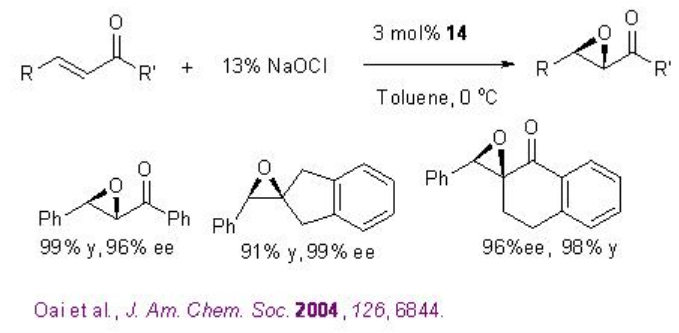
Mientras que la sal quiral de N-espiro amonio 14 que porta una unidad binaftilo axialmente quiral funciona como catalizador de transferencia de fase para la epoxidación de enonas con alta enantioselectividad (Esquema\(\PageIndex{22}\)). Los grupos hidroxilo están unidos apropiadamente para reconocer y activar el sustrato de enona mediante enlaces de hidrógeno.