5.2: Epoxidación de Alcoholes Alílicos
( \newcommand{\kernel}{\mathrm{null}\,}\)
La epoxidación de alcoholes alílicos es un proceso práctico bien desarrollado en catálisis asimétrica.
Epoxidación Catalizada por Titanio
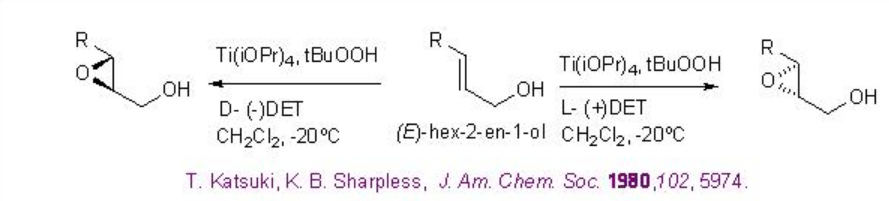
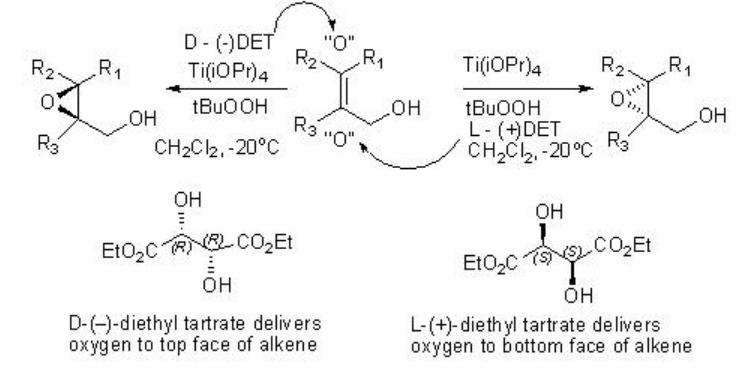
La epoxidación asimétrica Sharpless de alcohol alílico proporciona una poderosa herramienta para la síntesis de alcohol epoxi ópticamente activo. Por ejemplo, hexe-2-en-1-ol se somete a epoxidación para dar alcoholes epoxi quirales con 94% ee y 85% de rendimiento en presencia de 5-10 mol% de Ti (O i Pr) 4, L- (+) -DET y t-BuOOH (Esquema5.2.1). Usando D- (-) -DET como fuente quiral se puede obtener el enantiómero opuesto con rendimiento y enantioselectividad similares.
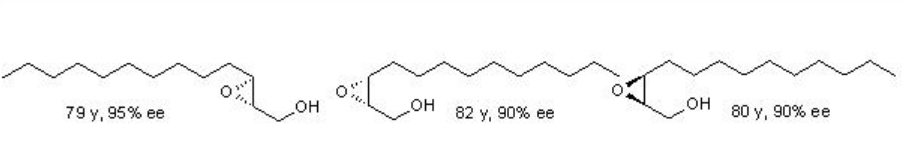
Ejemplos:
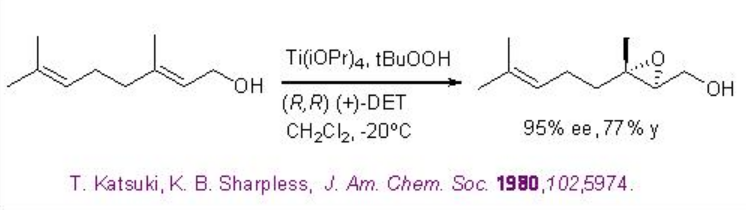
En caso de que los sustratos tengan más dobles enlaces, el doble enlace alílico puede oxidarse. Por ejemplo, el doble enlace alílico del geraniol se puede oxidar selectivamente con 95% ee (Esquema5.2.2).
Mecanismo
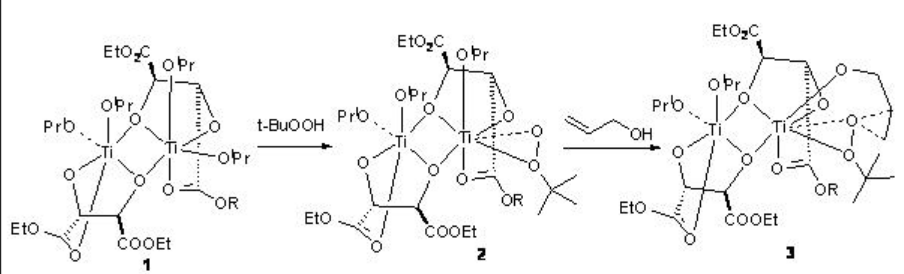
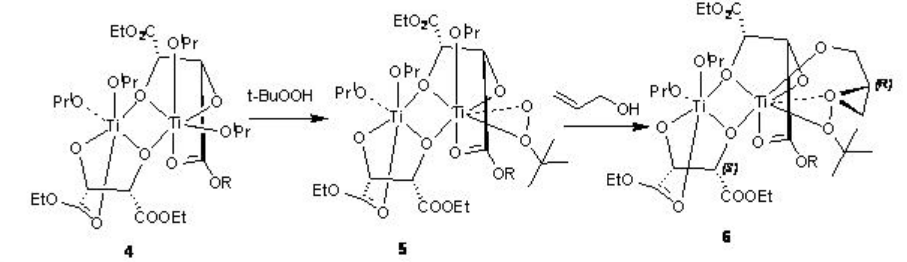
La reacción del alcóxido de titanio con ligandos de tartrato conduce a la formación de los dímeros 1 y 4 que en presencia de t-BuOOH se convierten en los intermedios 2 y 5, respectivamente, por desplazamiento del isopropóxido y tartrato grupos carbonilo (Esquema5.2.3 -5.2.4). La reacción de 2 y 5 con alcohol alílico da los intermedios 3 y 6, respectivamente. La estereoquímica del epóxido está determinada por el diastereómero del diéster de tartrato quiral.
La estereoquímica del producto se puede predecir utilizando el modelo mostrado en Scheme5.2.5.
Aplicación
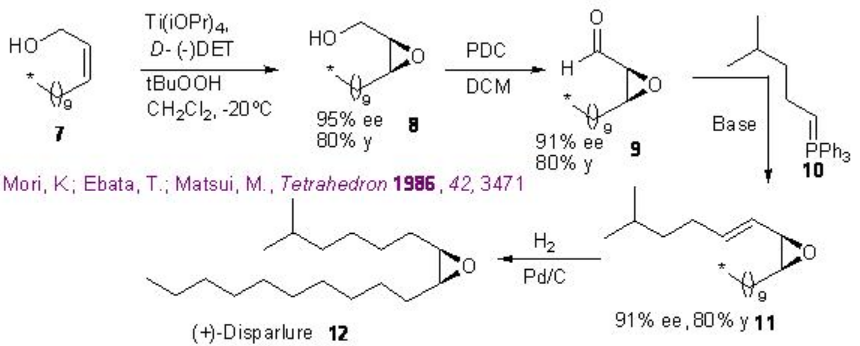
La reacción se ha aplicado para la síntesis de una serie de productos naturales, antibióticos y farmacéuticos. Por ejemplo, se ha logrado la síntesis de la feromona sexual de la polilla gitana (Lymantria dispar) (+) -disparlure 12 (Esquema5.2.6). La epoxidación del alcohol alílico 7 por procedimiento Sharpless proporciona epoxi alchohol 8 ópticamente activo con 95% ee que en presencia de diclorocromato de piridinio (PDC) da aldehído quiral 9. Este último con sal de Wittig 10 proporciona trans-alqueno 11 que podría reducirse usando Pd/C para dar el objetivo (+) -disparlure 12.
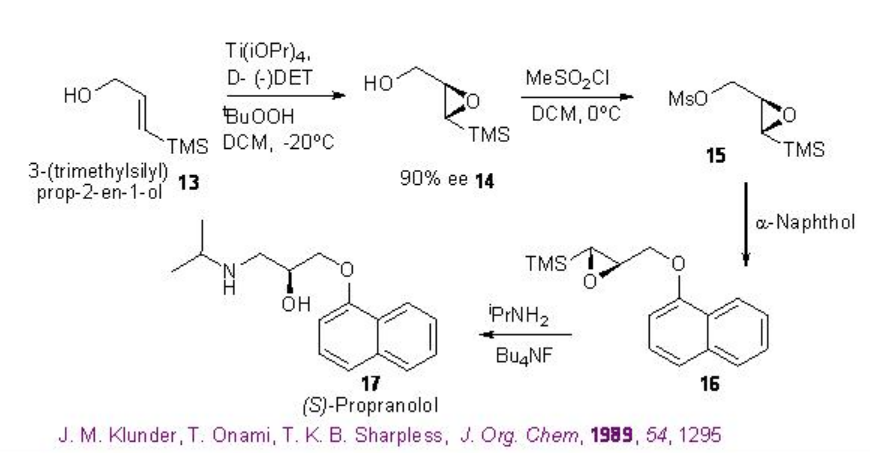
El Esquema5.2.7 muestra el uso de la epoxidación asimétrica Sharpless para la síntesis del inhibidor gástrico (S) -propanolol. La epoxidación de 3- (trimetilsilil) prop-2-en-1-ol 13 proporciona alcohol epoxi 14 con 90% ee que podría convertirse en 16 por mesilación 15 seguido de acoplamiento con 1-naftol. La apertura del epóxido 16 con isopropilamina conduce a la formación del objetivo (S) -propanolol 17.
Epoxidación catalizada con vanadio
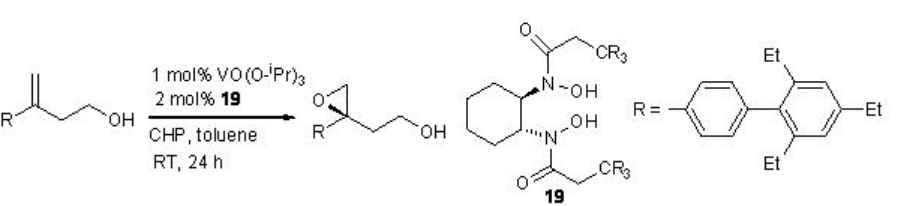
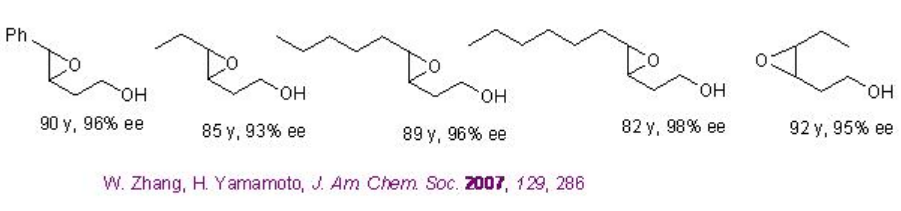
Pocos estudios están enfocados en vanadio quiral catalizado por la epoxidación de alcoholes alílicos. Se ha encontrado que la epoxidación del alcohol homoalílico es exitosa (Esquema5.2.8).
Ejemplos:
Epoxidación catalizada por niobio
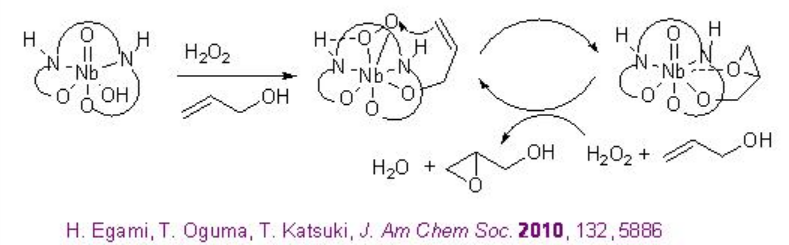
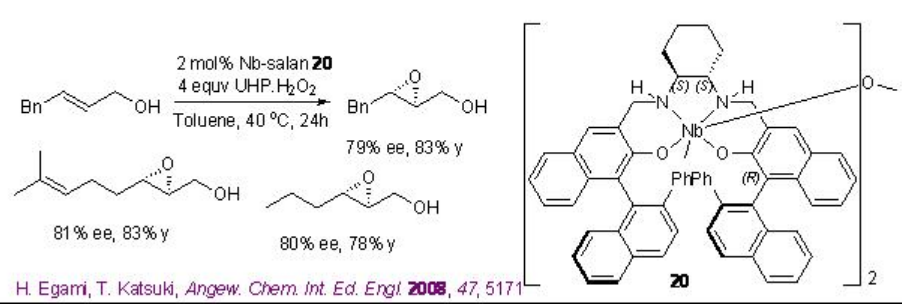
Los complejos quirales de niobio catalizan la epoxidación de alcoholes alílicos en presencia de peróxido de hidrógeno (H 2 O 2) o peróxido de hidrógeno de urea (UHP). Desde el punto de vista ambiental y económico, este proceso es más atractivo porque es económico atómico y genera agua como subproducto. Por ejemplo, [(μ-oxo) {Nb (salan)} 2] 20 cataliza la epoxidación de alcoholes alílicos en presencia de UHP en condiciones ambientales (Esquema5.2.9 -5.2.10).
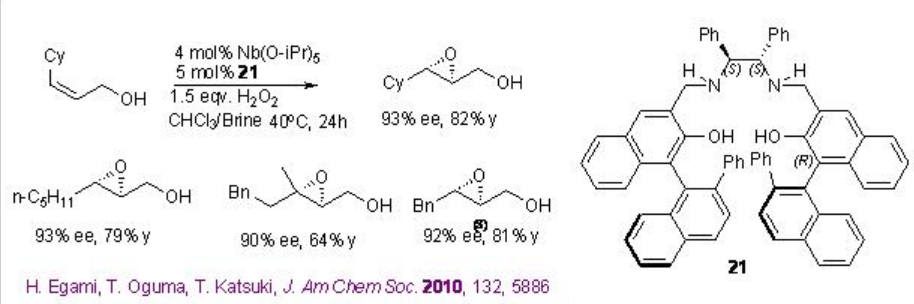
En este protocolo, el dímero μ-oxo se disocia en una especie monomérica que cataliza la reacción (Esquema5.2.11). Además, se encontró que los complejos monoméricos de Nb (salan) preparados in situ a partir de Nb (O i Pr) 5 y ligandos de salán seguidos de tratamiento de agua catalizan mejor la epoxidación usando aq. H 2 O 2 con enantioselectividad que varía de 83 a 95% ee. Este es el primer ejemplo de la epoxidación enantioselectiva de alcoholes alílicos usando ac. H 2 O 2 como oxidante terminal.