5.4: Sulfoxidación enantioselectiva
( \newcommand{\kernel}{\mathrm{null}\,}\)
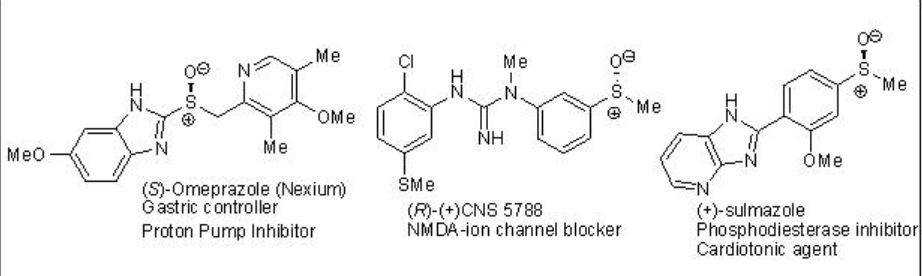
Los sulfóxidos enantiopuros sirven como auxiliares quirales así como intermedios para la síntesis de compuestos ópticamente activos. La unidad estructural de sulfóxido ópticamente activa también está presente en muchos compuestos que exhiben interesantes propiedades biológicas (Esquema5.4.1). El desarrollo de métodos para la sulfoxidación asimétrica ha sido así un tema activo en la catálisis asimétrica. Esta conferencia abarca los métodos comunes que se utilizan para la síntesis de sulfóxidos ópticamente activos.
5.4.1 Reacciones catalizadas por enzimas
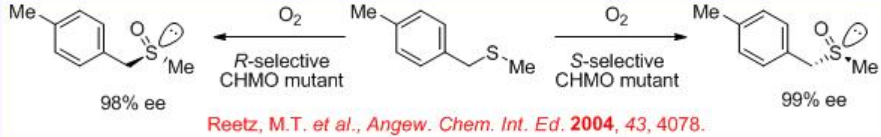
La oxidación asimétrica de sulfuros catalizada por enzimas proporciona métodos efectivos para la síntesis de sulfóxidos ópticamente activos. Por ejemplo, la ciclohexanona monooxigenasa (CHMO), una flavoenzima bacteriana, cataliza la oxidación de tioéteres proquirales con excelente enantioselectividad (Esquema5.4.2).
5.4.2 Reacciones basadas en reactivos quirales
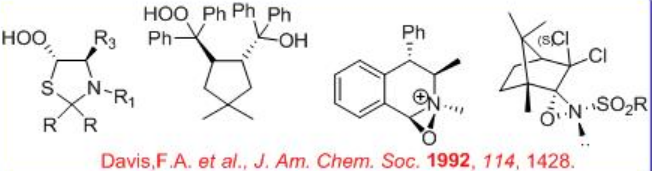
Se han utilizado reactivos quirales para la oxidación de sulfuros proquirales. Por ejemplo, los hidroperóxidos quirales, N-sulfonil oxaziridinas y oxaziridinas quirales pueden oxidar sulfuros proquirales a sulfóxidos ópticamente activos con enantioselectividad moderada a buena (Esquema5.4.3).
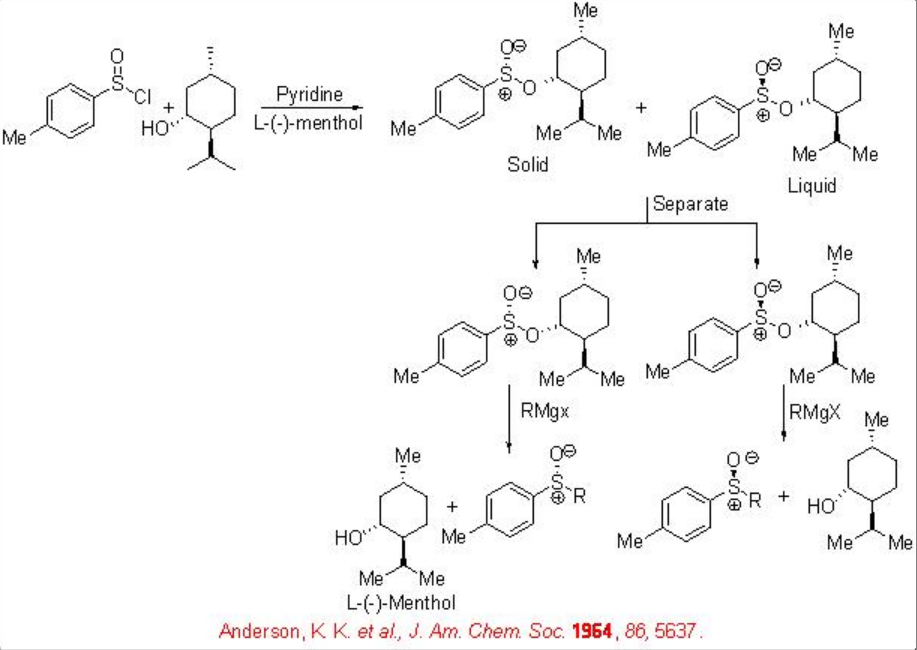
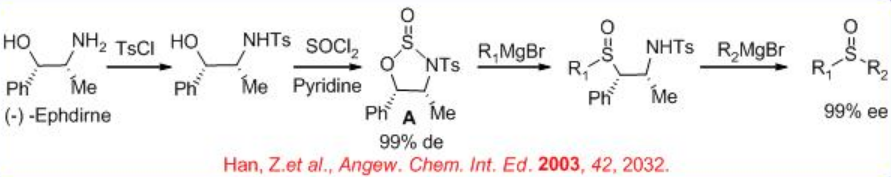
Además, los sulfinatos quirales son precursores de sulfóxidos quirales (Esquema5.4.4). Este enfoque es de interés preparativo para dotar a los sulfóxidos de alta enantioselectividad. El tema importante es la necesidad de preparar los mentil- p-tolilsulfinatos a partir de L- (-) -mentol y luego separarlos.
Además, la N-tosil-norefedrina puede hacerse reaccionar con cloruro de tionilo para proporcionar el compuesto heterocíclico A, el cual podría hacerse reaccionar mediante la adición secuencial de R1 MgX y R2 MgX, en un procedimiento de un solo recipiente para dar sulfóxidos en > 99% ee (Esquema5.4.5). La configuración depende del orden de introducción de los dos reactivos de Grignard.
5.4.3 Reacciones Catalizadas por Metal
5.4.3.1 Reacciones con tartratos de dietilo
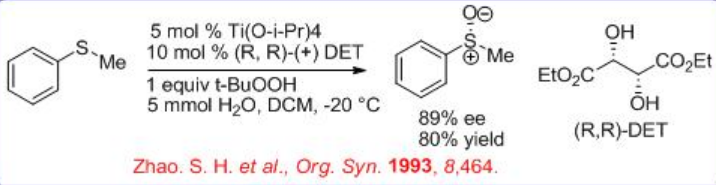
A mediados de 1980, los grupos Kagan y Módena modificaron independientemente las condiciones empleadas por el grupo Sharpless para la epoxidación asimétrica de alcoholes alílicos, y se utilizaron para la oxidación de sulfuros. Las condiciones modificadas implican la combinación de Ti (O i Pr) 4, (R, R) -tartrato de dietilo (DET) y t-BuOOH (TBHP) en agua (Esquema5.4.6). El reemplazo de TBHP con hidroperóxido de cumil (CHP) condujo a una mejora en la enantioselectividad del sulfóxido.
5.4.3.2 Reacciones con Ligandos Tridentados
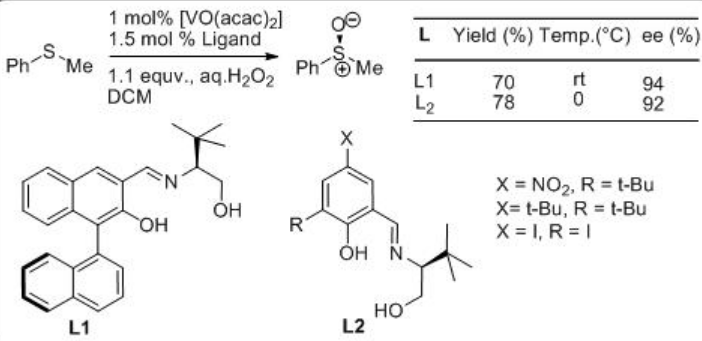
A mediados de 1990, se han estudiado complejos de vanadio que tienen los ligandos tridentados de base Schiff L1-2 derivados de aminoalcoholes ópticamente activos y aldehídos de arilo para la oxidación de sulfuros en presencia de ac. H 2 O 2 como oxidante terminal (Esquema5.4.7). Los catalizadores se preparan in situ y se estudia el efecto de la serie de ligandos base Schiff.
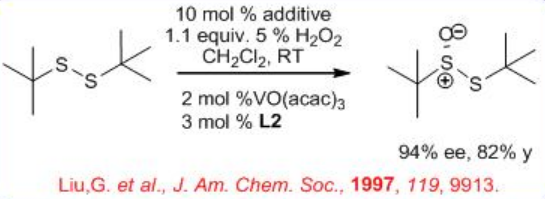
En el caso del disulfuro de di-terc - butilo, la monoxidación ocurre selectivamente con hasta > 90% ee (Esquema5.4.8).
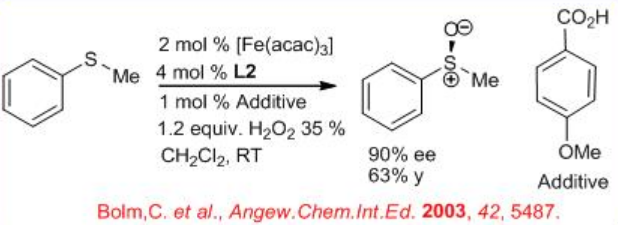
Posteriormente, también se ha encontrado que la reacción es efectiva con Fe (acac) 3 en presencia de aditivos como el ácido p-metoxibenzoico (Esquema5.4.9). Por ejemplo, la oxidación del sulfuro de p-clorofenil metilo se puede lograr con 92% ee y 60% de rendimiento. En algunos casos, se observa resolución cinética.
5.4.3.3 Reacciones con Ligandos Basados en Salen
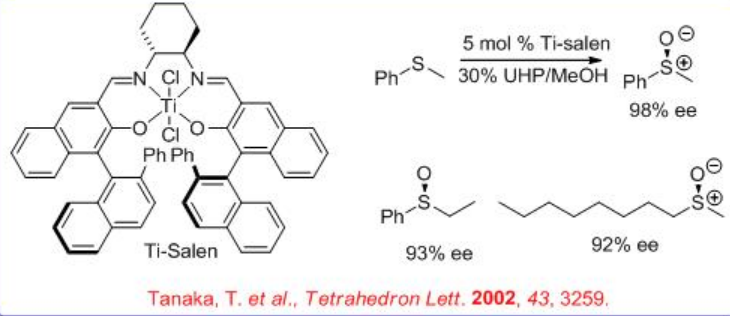
Se ha encontrado que el Ti-Salen quiral es un catalizador eficaz para la oxidación de sulfuros en presencia de peróxido de hidrógeno de urea (UHP) o H 2 O 2 acuoso. Primero, Ti-Salen se convierte en dímero cis - μ -dioxo Ti que reacciona con H 2 O 2 para dar especies de peroxo. Este último puede oxidar el sulfuro a sulfóxido (Esquema5.4.10). La oxidación de varios sulfuros de alquilarilo se puede lograr con 92— 99% ee.
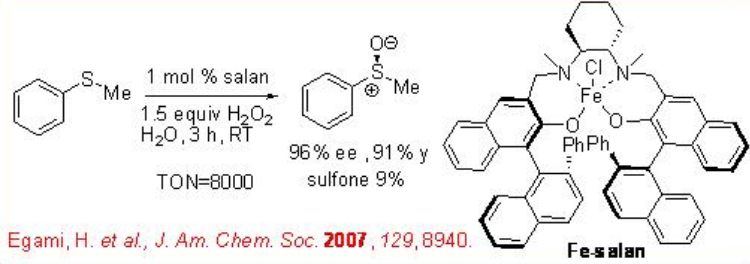
Posteriormente, se ha encontrado que Fe (salan) cataliza la oxidación de sulfuros en presencia de una cola H 2 O 2 en agua (Esquema5.4.11). Este procedimiento tiene las ventajas de un alto número de recambio catalítico (TON) de 8000 así como el uso de agua como medio de reacción.
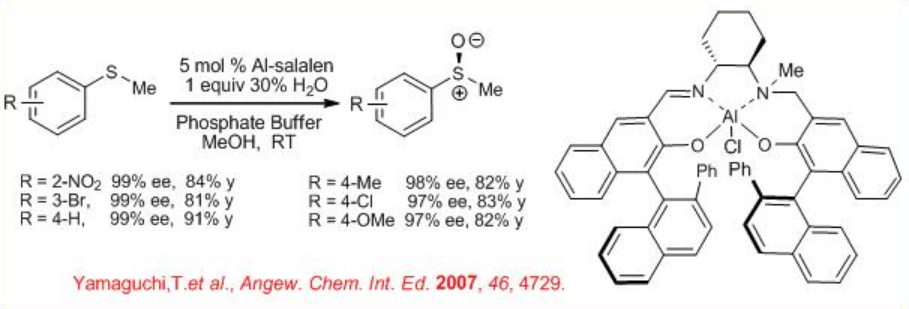
Además, Al (salalen), que es compatible en agua, cataliza la oxidación de sulfuros con H 2 O 2 acuoso a temperatura ambiente en condición de tampón fosfato (Esquema5.4.12). Las reacciones de una variedad de sulfuros han sido demostradas con alta enantioselectividad.
En tanto, se ha encontrado que el Ru (NO) -salen quiral cataliza la sulfoxidación bajo condiciones aeróbicas en presencia de agua bajo irradiación de luz visible a temperatura ambiente (Esquema5.4.13). A diferencia de las reacciones biológicas de transferencia de átomos de oxígeno que necesitan un sistema de transferencia de protones y electrones, esta reacción aeróbica de transferencia de átomos de oxígeno no requiere tal sistema ni un reductor sacrificial.
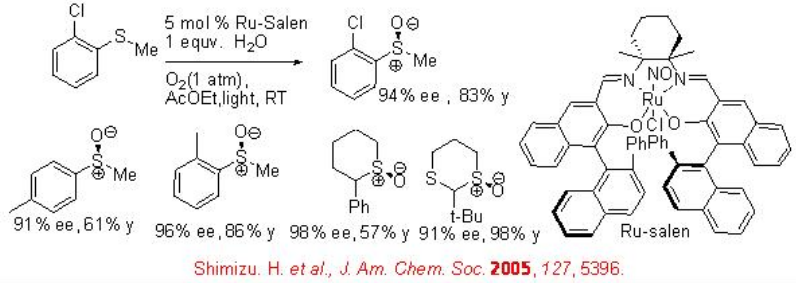
Aunque el mecanismo de esta oxidación no ha sido completamente aclarado, algunos resultados experimentales apoyan la noción de que un ligando aqua coordinado con el ión rutenio sirve como agente de transferencia de protones para el proceso de activación de oxígeno, y es reciclado y utilizado como mediador de transferencia de protones durante el proceso.


