1.15: Fórmulas moleculares y fórmulas empíricas (Revisión)
- Page ID
- 75906
Objetivo de aprendizaje
- Determinar las fórmulas e mpirical y molecular a partir de los datos de combustión
Las fórmulas moleculares te dicen cuántos átomos de cada elemento hay en un compuesto, y las fórmulas empíricas te indican la relación de elementos más simple o más reducida en un compuesto. Si la fórmula molecular de un compuesto ya no se puede reducir, entonces la fórmula empírica es la misma que la fórmula molecular. El análisis de combustión puede determinar la fórmula empírica de un compuesto, pero no puede determinar la fórmula molecular (aunque otras técnicas pueden hacerlo). Una vez conocida, la fórmula molecular puede calcularse a partir de la fórmula empírica.
Fórmulas empíricas
Una fórmula empírica nos dice las relaciones relativas de diferentes átomos en un compuesto. Las proporciones también se mantienen verdaderas en el nivel molar. Así, H 2 O está compuesto por dos átomos de hidrógeno y 1 átomo de oxígeno. Asimismo, 1.0 mol de H 2 O está compuesto por 2.0 moles de hidrógeno y 1.0 mol de oxígeno. También podemos trabajar hacia atrás a partir de relaciones molares ya que si conocemos las cantidades molares de cada elemento en un compuesto podemos determinar la fórmula empírica.
Ejemplo\(\PageIndex{1}\): Mercury Chloride
El mercurio forma un compuesto con cloro que es 73.9% de mercurio y 26.1% de cloro en masa. ¿Cuál es la fórmula empírica?
Digamos que teníamos una muestra de 100 gramos de este compuesto. Por lo tanto, la muestra contendría 73.9 gramos de mercurio y 26.1 gramos de cloro. ¿Cuántos moles de cada átomo representan las masas individuales?
Para Mercury:
\[(73.9 \;g) \times \left(\dfrac{1\; mol}{200.59\; g}\right) = 0.368 \;moles\]
Para Cloro:
\[(26.1\; g) \times \left(\dfrac{1\; mol}{35.45\; g}\right) = 0.736\; mol \]
¿Cuál es la relación molar entre los dos elementos?
\[\dfrac{0.736 \;mol \;Cl}{0.368\; mol\; Hg} = 2.0 \]
Así, tenemos el doble de moles (es decir, átomos) de Cl que Hg. La fórmula empírica sería así (recuerde enumerar primero el catión, el último anión):
\[HgCl_2 \]
Fórmula molecular a partir de fórmula empírica
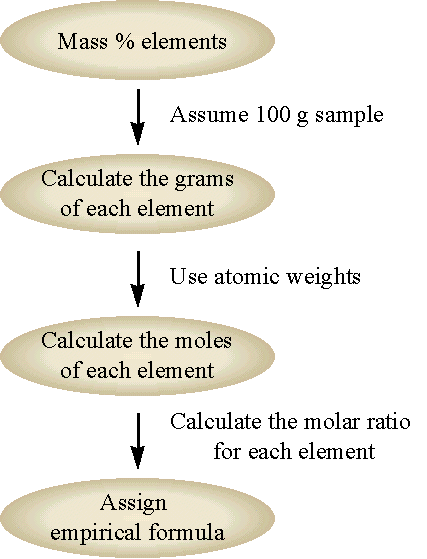
La fórmula química para un compuesto obtenido por análisis de composición es siempre la fórmula empírica. Podemos obtener la fórmula química a partir de la fórmula empírica si conocemos el peso molecular del compuesto. La fórmula química siempre será algún múltiplo entero de la fórmula empírica (es decir, múltiplos enteros de los subíndices de la fórmula empírica). El flujo general para este enfoque se muestra en la Figura\(\PageIndex{1}\) y se demuestra en Ejemplo\(\PageIndex{2}\).
Ejemplo\(\PageIndex{2}\): Ascorbic Acid
La vitamina C (ácido ascórbico) contiene 40.92% C, 4.58% H y 54.50% O, en masa. La masa molecular determinada experimentalmente es de 176 amu. ¿Cuál es la fórmula empírica y química del ácido ascórbico?
Solución
Considera una cantidad arbitraria de 100 gramos de ácido ascórbico, así tendríamos:
- 40.92 gramos C
- 4.58 gramos H
- 54.50 gramos O
Esto nos daría ¿cuántos moles de cada elemento?
- Carbono
\[ (40.92\; \cancel{g\; C}) \times \left( \dfrac{1\; mol\; C}{12.011\; \cancel{g\; C}} \right) = 3.407\; mol \; C \]
- Hidrógeno
\[ (4.58\; \cancel{g\; H}) \times \left( \dfrac{1\; mol\; H}{1.008\; \cancel{g\; H}} \right) = 4.544\; mol \;H \]
- Oxígeno
\[ (54.50\; \cancel{g\; O}) \times \left( \dfrac{1\; mol\; O}{15.999\; \cancel{g\; O}} \right) = 3.406\; mol \; O \]
Determine la relación de números enteros más simple dividiendo por la cantidad molar más pequeña (3.406 moles en este caso - ver oxígeno):
- Carbono
\[ C= \dfrac{3.407\; mol}{3.406\; mol} \approx 1.0\]
- Hidrógeno
\[ C= \dfrac{4.5.44\; mol}{3.406\; mol} = 1.0\]
- Oxígeno
\[ C= \dfrac{3.406\; mol}{3.406\; mol} = 1.0\]
Las cantidades molares relativas de carbono y oxígeno parecen ser iguales, pero la cantidad molar relativa de hidrógeno es mayor. Como no podemos tener átomos “fraccionarios” en un compuesto, necesitamos normalizar la cantidad relativa de hidrógeno para que sea igual a un entero. 1.333 parecería ser 1 y 1/3, así que si multiplicamos las cantidades relativas de cada átomo por '3', deberíamos poder obtener valores enteros para cada átomo.
C = (1.0) *3 = 3
H = (1.333) *3 = 4
O = (1.0) *3 = 3
o
C 3 H 4 O 3
Esta es nuestra fórmula empírica para el ácido ascórbico.
¿Qué pasa con la fórmula química? Se nos dice que la masa molecular determinada experimentalmente es de 176 amu. ¿Cuál es la masa molecular de nuestra fórmula empírica?
(3*12.011) + (4*1.008) + (3*15.999) = 88.062 amu
La masa molecular de nuestra fórmula empírica es significativamente menor que el valor determinado experimentalmente. ¿Cuál es la relación entre los dos valores?
(176 amu /88.062 amu) = 2.0
Así, parecería que nuestra fórmula empírica es esencialmente la mitad de la masa molecular real. Si multiplicamos nuestra fórmula empírica por '2', entonces la masa molecular sería correcta. Así, la fórmula molecular real es:
2* C 3 H 4 O 3 = C 6 H 8 O 6
Análisis de Combustión
Cuando un compuesto que contiene carbono e hidrógeno se somete a combustión con oxígeno en un aparato de combustión especial todo el carbono se convierte en CO 2 y el hidrógeno a H 2 O (Figura\(\PageIndex{2}\)). La cantidad de carbono producido se puede determinar midiendo la cantidad de CO 2 producido. Esto es atrapado por el hidróxido de sodio, y así podemos monitorear la masa de CO 2 producida determinando el aumento de masa de la trampa de CO 2. Asimismo, podemos determinar la cantidad de H producida por la cantidad de H 2 O atrapada por el perclorato de magnesio.
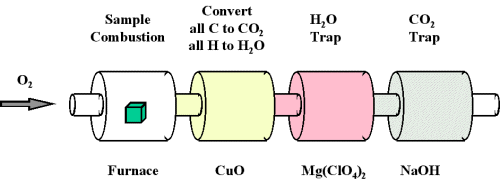
Una de las formas más comunes de determinar la composición elemental de un hidrocarburo desconocido es un procedimiento analítico llamado análisis de combustión. Una muestra pequeña y cuidadosamente pesada de un compuesto desconocido que puede contener carbono, hidrógeno, nitrógeno y/o azufre se quema en una atmósfera de oxígeno. Otros elementos, como los metales, se pueden determinar por otros métodos. y las cantidades de los productos gaseosos resultantes (CO 2, H 2 O, N 2 y SO 2, respectivamente) se determinan por uno de varios métodos posibles. Un procedimiento utilizado en el análisis de combustión se describe esquemáticamente en la Figura\(\PageIndex{3}\) y un análisis de combustión típico se ilustra en los Ejemplos\(\PageIndex{3}\) y\(\PageIndex{4}\).

Ejemplo\(\PageIndex{3}\): Combustion of Isopropyl Alcohol
¿Cuál es la formulación empírica para el alcohol isopropílico (que contiene solo C, H y O) si la combustión de una muestra de alcohol isopropílico de 0.255 gramos produce 0.561 gramos de CO 2 y 0.306 gramos de H 2 O?
Solución
A partir de esta información cuantificar la cantidad de C y H en la muestra.
\[ (0.561\; \cancel{g\; CO_2}) \left( \dfrac{1 \;mol\; CO_2}{44.0\; \cancel{g\;CO_2}}\right)=0.0128\; mol \; CO_2 \]
Ya que un mol de CO 2 está conformado por un mol de C y dos moles de O, si tenemos 0.0128 moles de CO 2 en nuestra muestra, entonces sabemos que tenemos 0.0128 moles de C en la muestra. ¿Cuántos gramos de C es esto?
\[ (0.0128 \; \cancel{mol\; C}) \left( \dfrac{12.011\; g \; C}{1\; \cancel{mol\;C}}\right)=0.154\; g \; C \]
¿Qué tal el hidrógeno?
\[ (0.306 \; \cancel{g\; H_2O}) \left( \dfrac{1\; mol \; H_2O}{18.0\; \cancel{g \;H_2O}}\right)=0.017\; mol \; H_2O \]
Ya que un mol de H 2 O está conformado por un mol de oxígeno y dos moles de hidrógeno, si tenemos 0.017 moles de H 2 O, entonces tenemos 2* (0.017) = 0.034 moles de hidrógeno. Dado que el hidrógeno es de aproximadamente 1 gramo/mol, debemos tener 0.034 gramos de hidrógeno en nuestra muestra original.
Cuando sumamos nuestro carbono e hidrógeno juntos obtenemos:
0.154 gramos (C) + 0.034 gramos (H) = 0.188 gramos
Pero sabemos que consumimos 0.255 gramos de alcohol isopropílico. La masa 'faltante' debe ser de los átomos de oxígeno en el alcohol isopropílico:
0.255 gramos - 0.188 gramos = 0.067 gramos de oxígeno
Esta cantidad de oxígeno es ¿cuántos moles?
\[ (0.067 \; \cancel{g\; O}) \left( \dfrac{1\; mol \; O}{15.994\; \cancel{g \;O}}\right)=0.0042\; mol \; O \]
En general, por lo tanto, tenemos:
- 0.0128 moles de Carbono
- 0.0340 moles de Hidrógeno
- 0.0042 moles Oxígeno
Divida por la cantidad molar más pequeña para normalizar:
- C = 3.05 átomos
- H = 8.1 átomos
- O = 1 átomo
Dentro del error experimental, la fórmula empírica más probable para el propanol sería\(C_3H_8O\)
Ejemplo\(\PageIndex{4}\): Combustion of Naphalene
La naftalina, el ingrediente activo en una variedad de bolas de naftalina, es un compuesto orgánico que solo contiene carbono e hidrógeno. La combustión completa de una muestra de 20.10 mg de naftaleno en oxígeno arrojó 69.00 mg de CO 2 y 11.30 mg de H 2 O. Determinar la fórmula empírica del naftaleno.
Dado: masa de muestra y masa de productos de combustión
Preguntado por: fórmula empírica
Estrategia:
- Utilizar las masas y masas molares de los productos de combustión, CO 2 y H 2 O, para calcular las masas de carbono e hidrógeno presentes en la muestra original de naftaleno.
- Utilice esas masas y las masas molares de los elementos para calcular la fórmula empírica del naftaleno.
Solución:
A Tras la combustión,\(\ce{CO2}\) se produce 1 mol de por cada mol de átomos de carbono en la muestra original. De igual manera, se produce 1 mol de H 2 O por cada 2 mol de átomos de hidrógeno presentes en la muestra. Las masas de carbono e hidrógeno en la muestra original se pueden calcular a partir de estas relaciones, las masas de CO 2 y H 2 O, y sus masas molares. Debido a que las unidades de masa molar son gramos por mol, primero debemos convertir las masas de miligramos a gramos:
\[ mass \, of \, C = 69.00 \, mg \, CO_2 \times {1 \, g \over 1000 \, mg } \times {1 \, mol \, CO_2 \over 44.010 \, g \, CO_2} \times {1 \, mol C \over 1 \, mol \, CO_2 } \times {12.011 \,g \over 1 \, mol \, C} \]
\[ = 1.883 \times 10^{-2} \, g \, C \]
\[ mass \, of \, H = 11.30 \, mg \, H_2O \times {1 \, g \over 1000 \, mg } \times {1 \, mol \, H_2O \over 18.015 \, g \, H_2O} \times {2 \, mol H \over 1 \, mol \, H_2O } \times {1.0079 \,g \over 1 \, mol \, H} \]
\[ = 1.264 \times 10^{-3} \, g \, H \]
B Para obtener los números relativos de átomos de ambos elementos presentes, necesitamos calcular el número de moles de cada uno y dividirlos por el número de moles del elemento presente en la menor cantidad:
\[ moles \, C = 1.883 \times 10^{-2} \,g \, C \times {1 \, mol \, C \over 12.011 \, g \, C} = 1.568 \times 10^{-3} \, mol C \]
\[ moles \, H = 1.264 \times 10^{-3} \,g \, H \times {1 \, mol \, H \over 1.0079 \, g \, H} = 1.254 \times 10^{-3} \, mol H \]
Dividiendo cada número por el número de moles del elemento presente en la menor cantidad da
\[H: {1.254\times 10^{−3} \over 1.254 \times 10^{−3}} = 1.000 \, \, \, C: {1.568 \times 10^{−3} \over 1.254 \times 10^{−3}}= 1.250\]
Así, el naftaleno contiene una relación de 1. 25:1 de moles de carbono a moles de hidrógeno: C 1.25 H 1.0. Debido a que las proporciones de los elementos en la fórmula empírica deben expresarse como pequeños números enteros, multiplique ambos subíndices por 4, lo que da C 5 H 4 como la fórmula empírica del naftaleno. De hecho, la fórmula molecular del naftaleno es C 10 H 8, lo que concuerda con nuestros resultados.
Ejercicio 1\(\PageIndex{4}\)
- El xileno, un compuesto orgánico que es un componente importante de muchas mezclas de gasolina, solo contiene carbono e hidrógeno. La combustión completa de una muestra de 17.12 mg de xileno en oxígeno arrojó 56.77 mg de CO 2 y 14.53 mg de H 2 O. Determinar la fórmula empírica del xileno.
- La fórmula empírica del benceno es CH (su fórmula molecular es C 6 H 6). Si 10.00 mg de benceno se someten a análisis de combustión, ¿qué masa de CO 2 y H 2 O se producirá?
- Contestar a
-
La fórmula empírica es C 4 H 5. (La fórmula molecular del xileno es en realidad C 8 H 10.)
- Respuesta b
-
33.81 mg de CO 2; 6.92 mg de H 2 O
Ejercicio 2
El análisis elemental de un compuesto orgánico indica que su composición es 37.82% de carbono, 6.36% de hidrógeno y 55.82% de cloro.
a. ¿Cuál es la fórmula empírica para este compuesto?
b. El análisis espectral de masas indica una masa molar de 129 g/mol. ¿Cuál es la fórmula molecular para este compuesto?
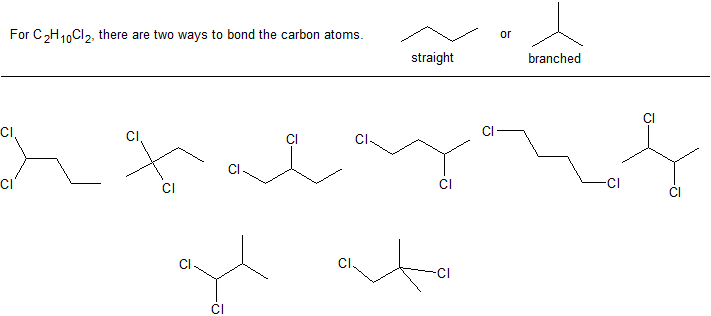
c. Dibujar todas las estructuras posibles de líneas de enlace con esta fórmula molecular.
Soluciones al Ejercicio 2
a. C 2 H 5 Cl con una masa molar de 64.5 g/mol
b. C 4 H 10 Cl 2
c. Hay 8 estructuras posibles con la fórmula molecular C 4 H 10 Cl 2. Puede ayudar comenzar con las diferentes cadenas principales de carbono y luego agregar sistemáticamente cualquier rama (sustituyentes).