2.3: Hibridación y Formas Moleculares (Revisión)
- Page ID
- 76667
Objetivos de aprendizaje
- predecir la hibridación y geometría de los átomos en una molécula - consulte la sección 2.3
- dibujar representaciones 3-D precisas de moléculas con ángulos de enlace aproximados
Formación de enlaces sigma: la molécula H 2
El caso más sencillo a considerar es la molécula de hidrógeno, H 2. Cuando decimos que los dos electrones de cada uno de los átomos de hidrógeno se comparten para formar un enlace covalente entre los dos átomos, lo que queremos decir en términos de teoría de enlaces de valencia es que los dos orbitales esféricos de 1 s se superponen, permitiendo que los dos electrones formen un par dentro de los dos orbitales superpuestos.

Estos dos electrones son ahora atraídos por la carga positiva de ambos núcleos de hidrógeno, con el resultado de que sirven como una especie de 'cola química' que mantiene unidos los dos núcleos.
Vinculación en Metano
Ahora volvamos al metano, la molécula orgánica más simple. Recordemos la configuración electrónica de valencia del carbono central:
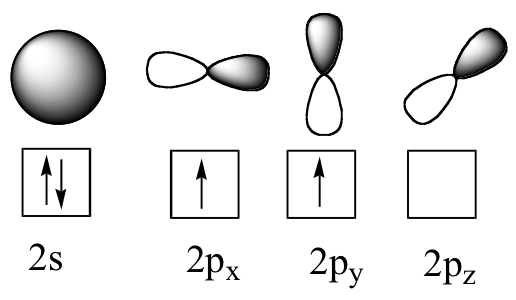
Esta imagen, sin embargo, es problemática. ¿Cómo forma el carbono cuatro enlaces si solo tiene dos orbitales p medio llenos disponibles para la unión? Un indicio proviene de la observación experimental de que los cuatro enlaces C-H en metano están dispuestos con geometría tetraédrica alrededor del carbono central, y que cada enlace tiene la misma longitud y resistencia. Para explicar esta observación, la teoría del enlace de valencia se basa en un concepto llamado hibridación orbital. En esta imagen, los cuatro orbitales de valencia del carbono (uno de 2 s y tres orbitales de 2 p) se combinan matemáticamente (recuerde: los orbitales se describen mediante ecuaciones) para formar cuatro orbitales híbridos equivalentes, que se llaman orbitales sp 3 porque se forman a partir de la mezcla de orbitales uno s y tres p. En la nueva configuración electrónica, cada uno de los cuatro electrones de valencia en el carbono ocupa un solo orbital sp 3.

Los orbitales híbridos sp 3, al igual que los orbitales p de los que están parcialmente compuestos, son de forma oblonga y tienen dos lóbulos de signo opuesto. A diferencia de los orbitales p, sin embargo, los dos lóbulos son de tamaño muy diferente. Los lóbulos más grandes de los híbridos sp 3 se dirigen hacia las cuatro esquinas de un tetraedro, lo que significa que el ángulo entre dos orbitales cualesquiera es de 109.5 o.
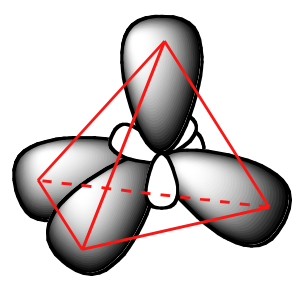
Esta disposición geométrica tiene mucho sentido si consideras que es precisamente este ángulo el que permite que los cuatro orbitales (y los electrones en ellos) estén lo más alejados entre sí como sea posible.Esto es simplemente una reformulación de la teoría de Repulsión de Par de Electrones de Concha de Valencia (VSEPR) que aprendiste en Química General: los pares de electrones (en orbitales) se dispondrán de tal manera que permanezcan lo más separados posible, debido a la repulsión electrostática negativo-negativa.
Cada enlace C-H en metano, entonces, puede describirse como un solapamiento entre un orbital medio lleno de 1 s en un átomo de hidrógeno y el lóbulo más grande de uno de los cuatro orbitales híbridos sp 3 medio llenos en el carbono central. La longitud de los enlaces carbono-hidrógeno en metano es de 1.09 Å (1.09 x 10 -10 m).
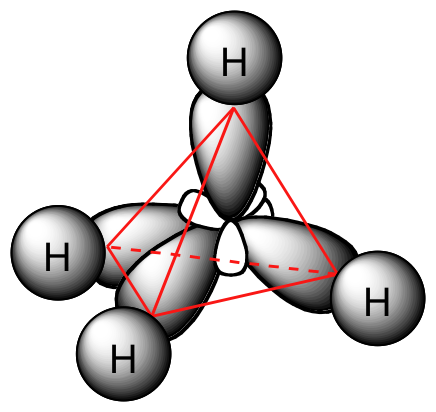
Mientras que anteriormente dibujamos una estructura Lewis de metano en dos dimensiones usando líneas para denotar cada enlace covalente, ahora podemos dibujar una estructura más precisa en tres dimensiones, mostrando la geometría de unión tetraédrica. Para hacer esto en una página bidimensional, sin embargo, necesitamos introducir una nueva convención de dibujo: el sistema de cuña sólida/discontinua. En esta convención, una cuña sólida simplemente representa un vínculo que está destinado a ser representado emergiendo del plano de la página. Una cuña discontinua representa un vínculo que está destinado a ser representado apuntando hacia, o detrás, del plano de la página. Las líneas normales implican vínculos que se encuentran en el plano de la página.
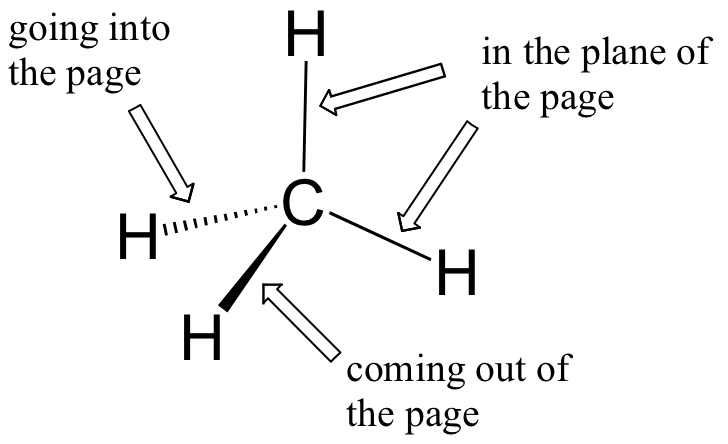
Este sistema requiere un poco de acostumbrarse, pero con la práctica tu ojo aprenderá a 'ver' inmediatamente la tercera dimensión que se está representando.
| Ejemplo |
|---|
|
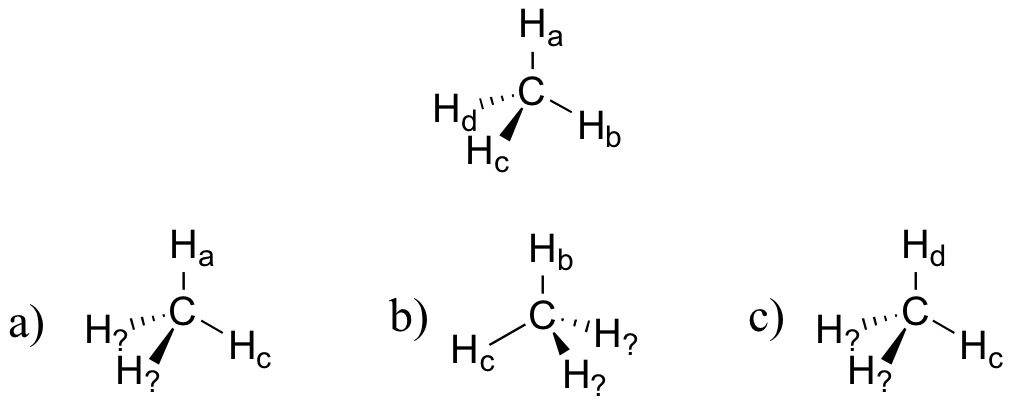
Imagina que podrías distinguir entre los cuatro hidrógenos en una molécula de metano, y etiquetarlos de H a a H d. En las imágenes de abajo, la misma molécula de metano es rotada y volteada en varias posiciones. Dibuja las etiquetas de átomos de hidrógeno que faltan. (Será mucho más fácil hacer esto si haces un modelo.)
|
| Ejercicio |
|---|
|
Describir, con una imagen y con palabras, la unión en cloroformo, CHCl 3. |
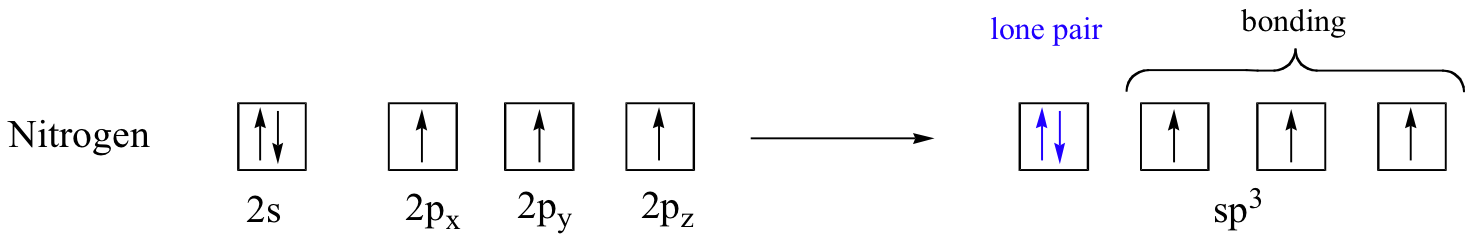
La disposición de unión aquí también es tetraédrica: los tres enlaces N-H de amoníaco se pueden representar formando la base de una pirámide trigonal, con el cuarto orbital, conteniendo el par solitario, formando la parte superior de la pirámide.
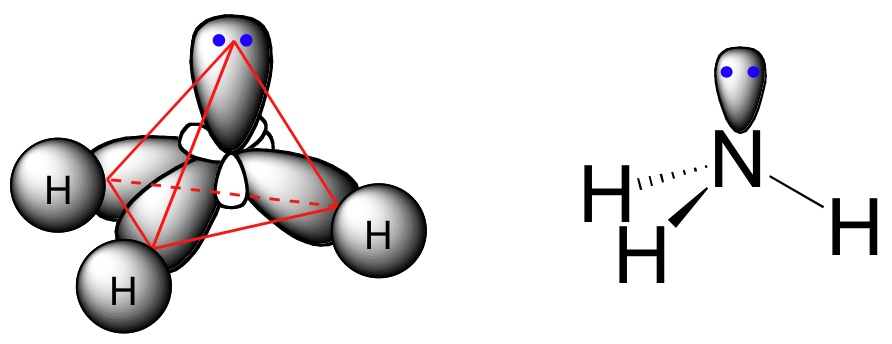
Recordemos de su estudio de la teoría VSEPR en Química General que el par solitario, con su efecto repulsivo ligeramente mayor, 'empuja' a los tres N-H se escabulle lejos de la parte superior de la pirámide, lo que significa que los ángulos de enlace H-N-H son ligeramente menores que tetraédricos, a 107.3˚ en lugar de 109.5˚.
La teoría de VSEPR también predice, con precisión, que una molécula de agua está 'doblada' en un ángulo de aproximadamente 104.5˚. Parecería lógico, entonces, describir el enlace en el agua como ocurriendo a través de la superposición de orbitales híbridos sp 3 en oxígeno con orbitales de 1 s en los dos átomos de hidrógeno. En este modelo, los dos pares solitarios no enlazantes sobre oxígeno se ubicarían en orbitales sp 3.
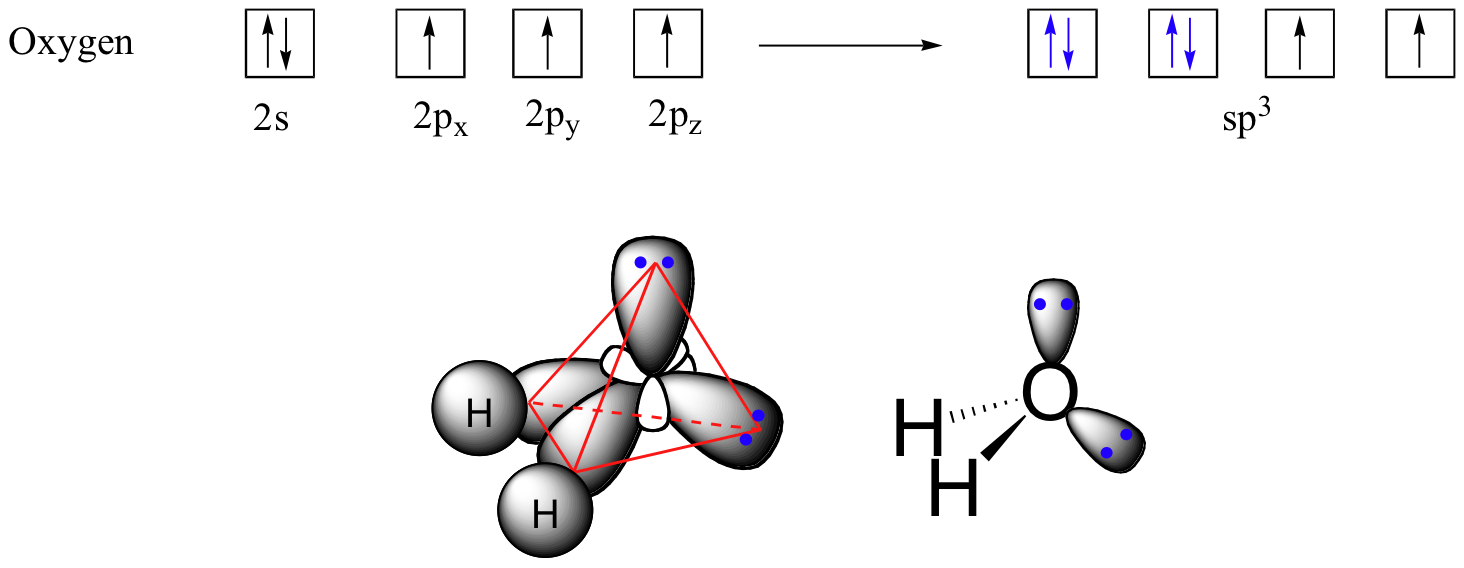
Algunas pruebas experimentales, sin embargo, sugieren que los orbitales de unión en el oxígeno son en realidad orbitales 2 p no hibridados en lugar de híbridos sp 3. Si bien esto parecería implicar que el ángulo de enlace H-O-H debe ser de 90˚ (recuerde que los orbitales p están orientados perpendiculares entre sí), parece que la repulsión electrostática tiene el efecto de distorsionar este ángulo p-orbital a 104.5˚. Tanto el modelo orbital híbrido como el orbital no híbrido presentan explicaciones razonables para la disposición de unión observada en el agua, por lo que no nos preocuparemos más por la distinción.
| Ejercicio |
|---|
|
Dibuja, en el mismo estilo que las figuras anteriores, una imagen orbital para la unión en metilamina. |
Formación de\(\pi\) enlaces -\(sp^2\) e\(sp\) hibridación
La teoría del enlace de valencia, junto con el concepto orbital híbrido, hace un muy buen trabajo al describir compuestos de doble enlace como el eteno. Tres características experimentalmente observables de la molécula de eteno deben ser contabilizadas por un modelo de unión:
- El eteno es una molécula plana (plana).
- Los ángulos de enlace en el eteno son aproximadamente 120 o, y la longitud del enlace carbono-carbono es de 1.34 Å, significativamente más corta que el enlace simple carbono-carbono de 1.54 Å en etano.
- Existe una barrera significativa para la rotación alrededor del doble enlace carbono-carbono.
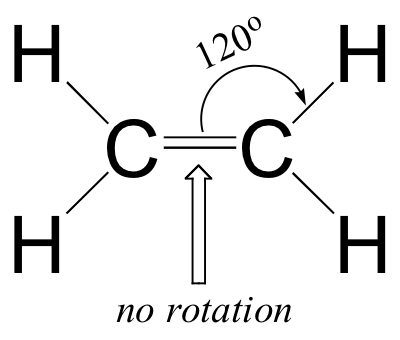
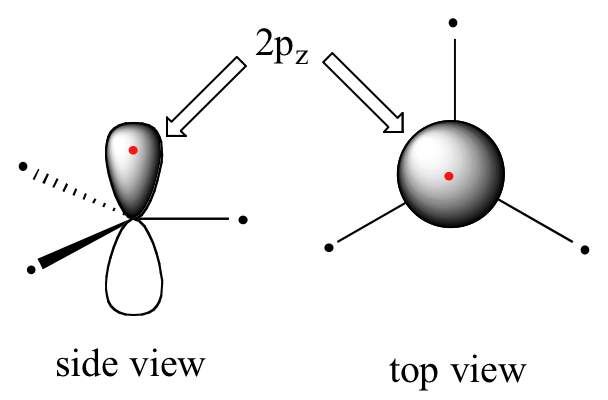
Claramente, estas características no son consistentes con una imagen de unión híbrida sp 3 para los dos átomos de carbono. En cambio, la unión en eteno se describe mediante un modelo que implica la participación de un tipo diferente de orbital híbrido. Tres orbitales atómicos en cada carbono —los orbitales 2 s, 2 p x y 2 p y — se combinan para formar tres híbridos sp 2, dejando el orbital 2 p z sin hibridar.

Los tres híbridos sp 2 están dispuestos con geometría plana trigonal, apuntando a las tres esquinas de un triángulo equilátero, con ángulos de 120°entre ellos. El orbital 2 p z no hibridado es perpendicular a este plano (en las siguientes figuras, los orbitales sp 2 y los enlaces sigma a los que contribuyen están representados por líneas y cuñas; solo los orbitales 2 p z se muestran en el 'espacio modo -llenado').
El doble enlace carbono-carbono en eteno consiste en un sbond, formado por el solapamiento de dos orbitales sp 2, y un segundo enlace, llamado enlace π (pi), que se forma por el solapamiento lado a lado de los dos no hibridados 2 p z orbitales de cada carbono.
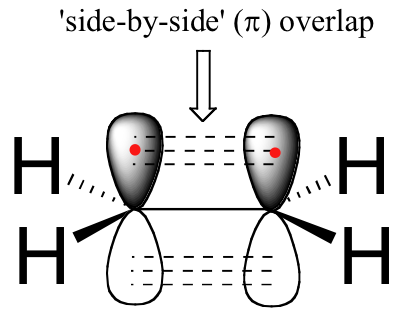
imagen de vuelo espacial de unión en eteno
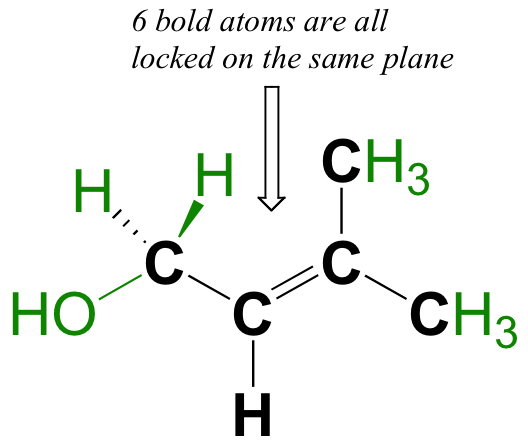
El enlace pi no tiene simetría simétrica. Debido a que son el resultado de una superposición lado a lado (en lugar de superponerse de extremo a extremo como un enlace sigma), los enlaces pi no son libres de rotar. Si se produjera una rotación sobre este enlace, implicaría interrumpir el solapamiento lado a lado entre los dos orbitales de 2 p z que componen el enlace pi. La presencia del enlace pi así 'bloquea' los seis átomos de eteno en el mismo plano. Este argumento se extiende a grupos alquenos más grandes: en cada caso, los seis átomos del grupo forman un solo plano.
Por el contrario, los sbonds como el enlace sencillo carbono-carbono en etano (CH 3 CH 3) exhiben rotación libre, y pueden asumir muchas conformaciones o formas diferentes, este es uno de los temas principales del Capítulo 3.
| Ejercicio |
|---|
|
Encierra en círculo los seis átomos en la molécula de abajo que están 'bloqueados' en el mismo plano.
|
| Ejercicio |
|---|
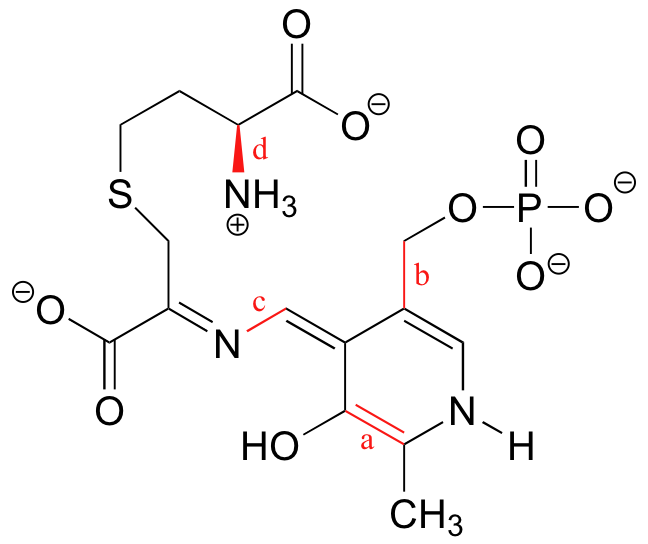
| ¿Qué tipos de orbitales se superponen en los enlaces a-d indicados a continuación?
|
| Ejercicio |
|---|
|
¿Qué hay de malo en la forma en que se dibuja la siguiente estructura?
|
Se puede dibujar una imagen similar para la unión en grupos carbonilo, como el formaldehído. En esta molécula, el carbono está hibridado con sp 2, y asumiremos que el átomo de oxígeno también está hibridado con sp 2. El carbono tiene tres enlaces sigma: dos se forman por solapamiento entre dos de sus orbitales sp 2 con el orbital 1 s de cada uno de los hidrógenos, y el tercer enlace sigma se forma por solapamiento entre el carbono restante sp 2 orbital y un orbital sp 2 en el oxígeno . Los dos pares solitarios en oxígeno ocupan sus otros dos orbitales sp 2.
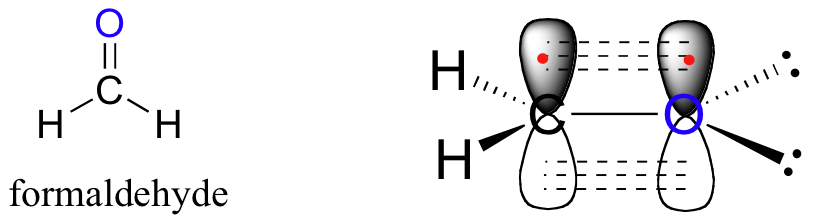
El enlace pi se forma por solapamiento lado a lado de los orbitales 2 p z no hibridados en el carbono y el oxígeno. Al igual que en los alquenos, los orbitales 2 p z que forman el enlace pi son perpendiculares al plano formado por los enlaces sigma.
| Ejercicio |
|---|
|
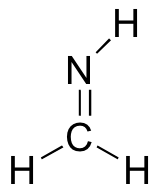
Describa y dibuje la imagen de unión para el grupo imine que se muestra a continuación. Utilice el dibujo de formaldehído anterior como su guía.
|
Colaboradores y Atribuciones
- Química Orgánica con Énfasis Biológico por Tim Soderberg (Universidad de Minnesota, Morris)