2.5: Electrones de Par Solitario y Teorías de Vinculación
- Page ID
- 76675
Objetivo de aprendizaje
- identificar los orbitales ocupados por electrones de pares solitarios
Enlace de valencia y teorías orbitales moleculares
La siguiente tabla resume los puntos principales de las dos teorías de vinculación complementaria. Ambas teorías proporcionan formas diferentes y útiles de describir la estructura molecular. Utilizaremos ambas teorías y a menudo las mezclaremos para analizar y predecir la estructura química y la reactividad. Las teorías de vinculación se revisan con mayor detalle en las dos secciones siguientes.
| Teoría de los bonos de valencia | Teoría Orbital Molecular |
|---|---|
| considera enlaces localizados entre un par de átomos | considera electrones deslocalizados en toda la molécula |
| crea enlaces a partir del solapamiento de orbitales atómicos (s, p, d...) y orbitales híbridos (sp, sp 2, sp 3...) | combina orbitales atómicos para formar orbitales moleculares (σ, σ*, π, π*) |
| forma enlaces σ o π | crea interacciones de unión y antiadhesión basadas en las cuales se llenan los orbitales |
| predice la forma molecular basada en el número de regiones de densidad electrónica | predice la disposición de los electrones en las moléculas |
| necesita múltiples estructuras para describir la resonancia |
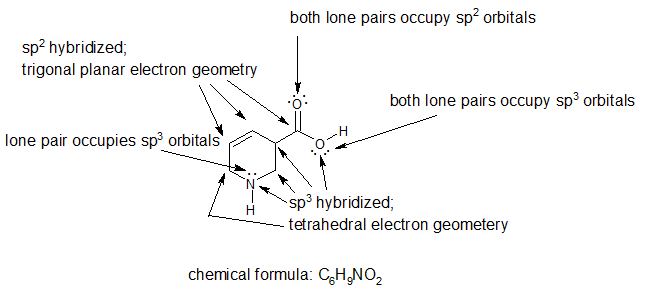
Orbitales de Electrones de Par Solitario
Hay situaciones en las que vamos a querer integrar teorías de enlaces orbitales moleculares y de valencia. Identificar los orbitales de electrones de pares solitarios es una situación. Los orbitales hibridados crean enlaces sigma y mantienen pares solitarios. Los enlaces sigma crean el “marco” que mantiene todos los átomos juntos como una molécula o ion. Los orbitales p no hibridados crean enlaces pi perpendiculares a este marco sigma. En el futuro, aprenderemos que algunos electrones de pares solitarios en heteroátomos de anillos pueden ocupar p orbitales para crear aromaticidad. Estén atentos a las próximas atracciones. Para los diez primeros capítulos de este texto, sólo nos centraremos en los compuestos no aromáticos.
Para identificar los orbitales de los electrones de par solitario en compuestos no aromáticos, podemos seguir un enfoque de dos pasos.
Paso 1: Añadir cualquier electrón de par solitario faltante a los heteroátomos (átomos distintos de carbono e hidrógeno).
Paso 2: Determinar la hibridación de cualquier átomo con pares solitarios (heteroátomos). Los pares solitarios ocupan los orbitales hibridados.
Ejemplo
Para identificar los orbitales de los electrones de par solitario en el compuesto a continuación, seguiremos el enfoque anterior.
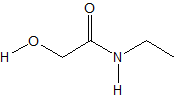
Paso 1: Agregar pares solitarios.
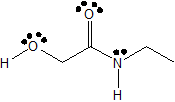
Paso 2: Determinar la hibridación de cualquier átomo con pares solitarios.
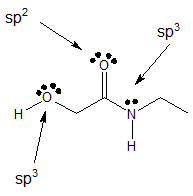
Los pares solitarios de cada heteroátomo ocupan el orbital hibridado indicado.
NOTA: Estas pautas solo aplican para compuestos no aromáticos. Puede haber excepciones a estas pautas para algunos compuestos aromáticos heterocíclicos. Estas excepciones se explican a fondo en un capítulo posterior de este texto.
Ejercicio
1. Para el compuesto siguiente:
a) añadir los electrones del par solitario
b) marcar la hibridación y la geometría de electrones para todos los átomos que no son de hidrógeno
c) especificar la hibridación del orbital para cada par solitario
d) ¿Cuál es la fórmula química de este compuesto?
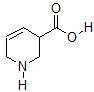
- Contestar
-
1.