2.6: Rotación de Bond
- Page ID
- 76733
Objetivo de aprendizaje
- distinguir entre los enlaces que pueden girar y los que no pueden
Los bonos Sigma pueden girar
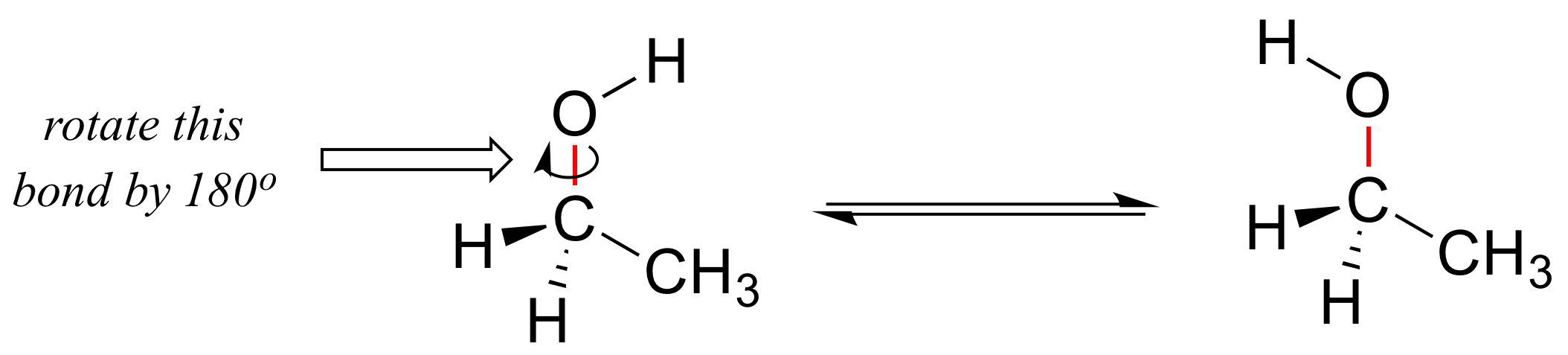
Aprendimos en la sección 2.1 que los enlaces simples en las moléculas orgánicas son libres de rotar, debido a la naturaleza 'de extremo a extremo' (sigma) de su superposición orbital. Considere el enlace carbono-oxígeno en etanol, por ejemplo: con una rotación de 180 o alrededor de este enlace, la forma de la molécula se vería bastante diferente:
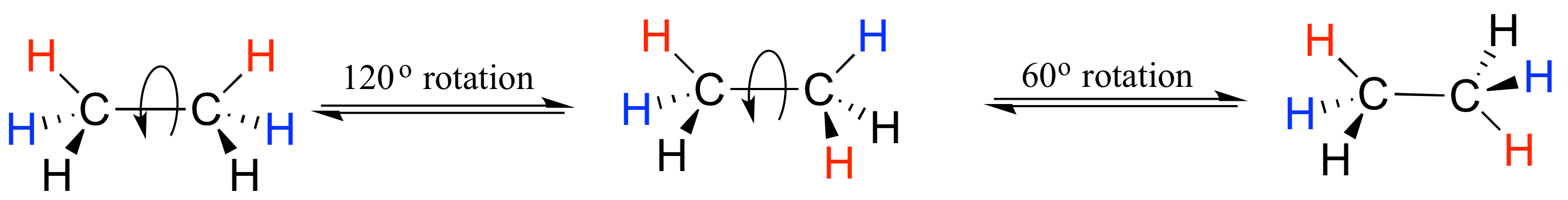
Para el etano, la rotación alrededor del enlace sigma carbono-carbono da como resultado muchas disposiciones tridimensionales diferentes de los átomos.
Los enlaces Pi son rígidos
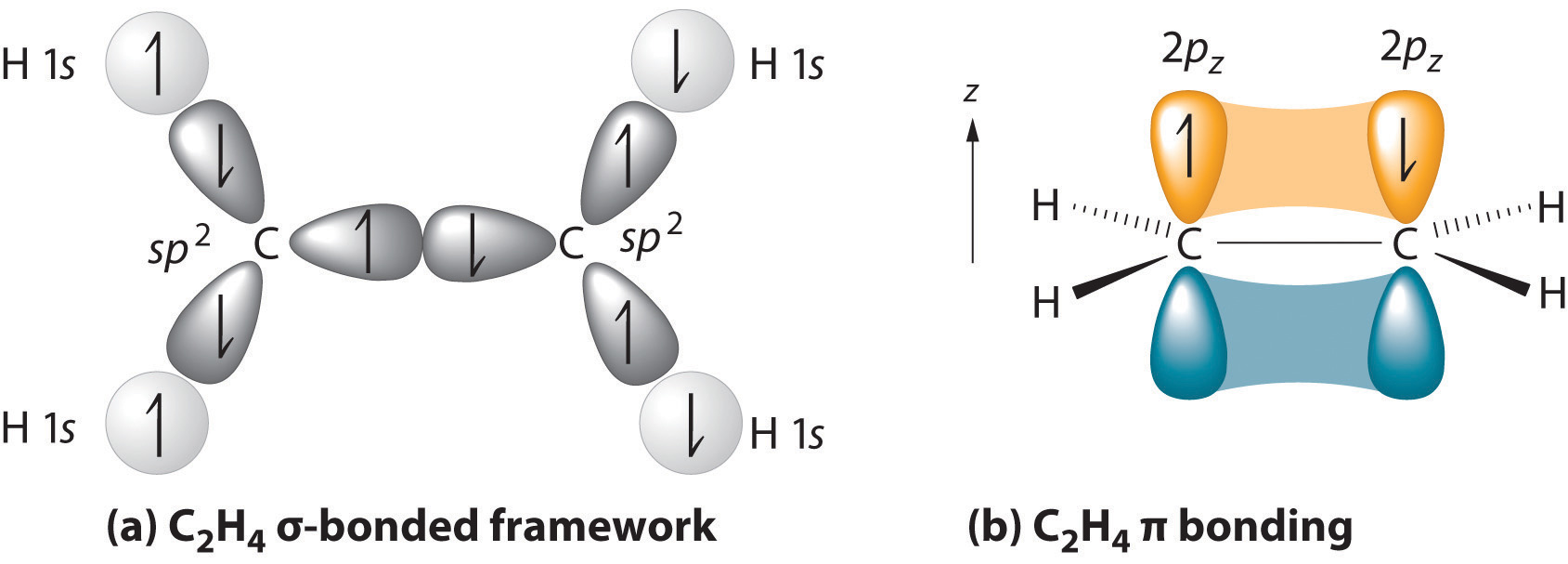
Los enlaces Pi se crean a partir de orbitales p superpuestos. Los lóbulos de los orbitales p impiden que los átomos que comparten enlaces pi roten como se muestra en el siguiente diagrama.
Los enlaces dobles y triples no pueden rotar
Los enlaces pi en dobles y triples enlaces impiden que estos enlaces roten. Esta rigidez tiene un efecto sobre la estructura física de los compuestos y puede influir en la reactividad química. Por ahora, queremos construir el hábito de mirar dibujos estáticos y diagramas de compuestos orgánicos y visualizar su naturaleza dinámica.
Para el eteno, no hay rotación sobre el doble enlace carbono-carbono debido al enlace pi.

Ejercicio
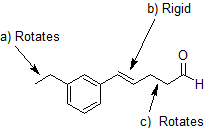
1. Etiquete los enlaces seleccionados en el siguiente compuesto como “Gira” o “Rígido”.
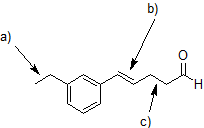
- Contestar
-
1. Las flechas para (a) y (c) apuntan a enlaces simples que pueden rotar. La flecha (b) apunta a un doble enlace que es rígido debido al enlace pi.