4.6: Cicloalcanos y Cepa de Anillo
- Page ID
- 76394
Objetivo de aprendizaje
- explicar la rotación parcial de los enlaces simples carbono-carbono en anillos
- explicar la tensión del anillo y su relación con la estabilidad del cicloalcano
Cicloalcanos (también conocido como anillos)
Los cicloalcanos tienen uno o más anillos de átomos de carbono. Los ejemplos más simples de esta clase consisten en un solo anillo de carbono no substituido, y estos forman una serie homóloga similar a los alcanos no ramificados. Los nombres de la IUPAC de los cinco primeros miembros de esta serie se dan en la siguiente tabla. La última columna da la fórmula general para un cicloalcano de cualquier tamaño. Si un alcano simple no ramificado se convierte en un cicloalcano se deben perder dos átomos de hidrógeno, uno de cada extremo de la cadena. De ahí que la fórmula general para un cicloalcano compuesto de n carbonos es C n H 2n. Aunque un cicloalcano tiene dos hidrógenos menos que el alcano equivalente, cada carbono está unido a otros cuatro átomos por lo que dichos compuestos aún se consideran saturados con hidrógeno.
| Nombre | Ciclopropano | Ciclobutano | Ciclopentano | Ciclohexano | Cicloheptano | Cicloalcano |
|---|---|---|---|---|---|---|
Fórmula molecular |
C 3 H 6 | C 4 H 8 | C 5 H 10 | C 6 H 12 | C 7 H 14 | C n H 2n |
Fórmula estructural |
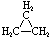 |
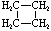 |
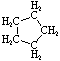 |
 |
 |
(CH 2) n |
Fórmula de Línea |
 |
 |
 |
 |
 |
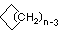 |
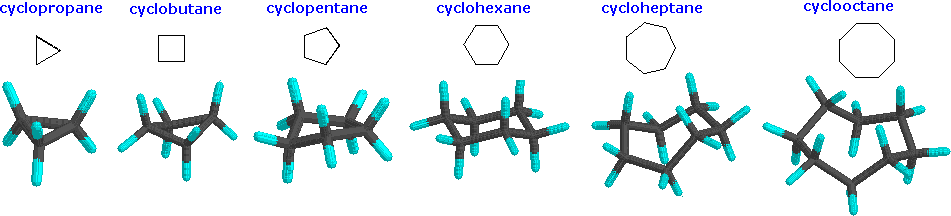
Aunque los dibujos lineales habituales de los cicloalcanos simples son polígonos geométricos, la forma real de estos compuestos en la mayoría de los casos es muy diferente. Los sistemas cíclicos son un poco diferentes de los sistemas de cadena abierta. En una cadena abierta, cualquier enlace puede girarse 360 grados, pasando por muchas conformaciones diferentes. La rotación completa no es posible en un sistema cíclico, porque las partes que estarías tratando de torcer lejos unas de otras seguirían conectadas entre sí. Los sistemas cíclicos tienen menos “grados de libertad” que los sistemas alifáticos; tienen “rotación restringida”. Debido a la rotación restringida de los sistemas cíclicos, la mayoría de ellos tienen formas mucho más definidas que sus contrapartes alifáticas. Echemos un vistazo a las formas básicas de algunos anillos comunes. Muchos compuestos biológicamente importantes se construyen alrededor de estructuras que contienen anillos, por lo que es importante que nos familiaricemos con ellos. En la naturaleza, con frecuencia se encuentran anillos de tres a seis miembros, por lo que nos centraremos en esos.
La teoría de Baeyer y la evidencia experimental de la tensión del anillo
Muchas de las propiedades del ciclopropano y sus derivados son similares a las propiedades de los alquenos. En 1890, el famoso químico orgánico alemán, A. Baeyer, sugirió que los derivados de ciclopropano y ciclobutano son diferentes de ciclopentano y ciclohexano, porque sus ángulos C—C—C no pueden tener el valor tetraédrico de 109.5°. Al mismo tiempo, Baeyer planteó la hipótesis de que las dificultades encontradas en la síntesis de anillos de cicloalcano desde C7 hacia arriba eran el resultado de la deformación angular que se esperaría si los anillos grandes fueran polígonos planos regulares (ver Tabla 12-3). Baeyer también creía que el ciclohexano tenía una estructura plana como la que se muestra en la Figura 12-2, lo que significaría que los ángulos de enlace tendrían que desviarse 10.5° del valor tetraédrico. Sin embargo, en 1895, el entonces desconocido químico H. Sachse sugirió que el ciclohexano existe en las formas de silla y barco libres de tensión discutidas en la Sección 12-3. Esta sugerencia no fue aceptada en ese momento porque condujo a la predicción de varios isómeros posibles para compuestos como el clorociclohexano (ver Ejercicio 12-4). La idea de que tales isómeros pudieran actuar como una sola sustancia, como resultado de un rápido equilibrio, parecía una complicación innecesaria, y no fue hasta 1918 que E. Mohr propuso una forma definitiva de distinguir entre los ciclohexanos Baeyer y Sachse. Como se discutirá en la Sección 12-9, el resultado, ahora conocido como la teoría de Sachse-Mohr, fue la confirmación completa de la idea de anillos grandes no planares.
| Compuesto | n | Deformación angular en cada CH2 | Calor de Combustión ΔHO (kcal/mol) | Calor de Combustión ΔHO por CH2/N (kcal/mol) | Cepa total (kcal/mol) |
|---|---|---|---|---|---|
| eteno | 2 | 109.5 | 337.2 | 168.6 | 22.4 |
| ciclopropano | 3 | 49.5 | 499.9 | 166.6 | 27.7 |
| ciclobutano | 4 | 19.5 | 655.9 | 164.0 | 26.3 |
| ciclopentano | 5 | 1.5 | 793.4 | 158.7 | 6.5 |
| ciclohexano | 6 | 10.5 | 944.8 | 157.5 | 0.4 |
| cicloheptano | 7 | 19.1 | 1108.1 | 158.4 | 6.3 |
| ciclooctano | 8 | 25.5 | 1268.9 | 158.6 | 9.7 |
| ciclononano | 9 | 30.5 | 1429.5 | 158.8 | 12.9 |
| ciclodecano | 10 | 34.5 | 1586.1 | 158.6 | 12.1 |
| ciclopentadecano | 15 | 46.5 | 2362.5 | 157.5 | 1.5 |
| alcano de cadena abierta | 157.4 | - |
Cepa de anillo en cicloalcanos
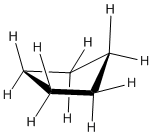
La cepa de anillo ocurre porque los carbonos en los cicloalcanos están hibridados sp 3, lo que significa que no tienen el ángulo de enlace ideal esperado de 109.5 o; esto provoca un aumento en la energía potencial debido al deseo de que los carbonos estén en un ideal 109 .5 o. Un ejemplo de tensión de anillo se puede ver en el diagrama de ciclopropano a continuación en el que el ángulo de unión es de 60 o entre los carbonos.
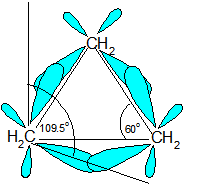
La razón de la deformación del anillo se puede ver a través del modelo de carbono tetraédrico. Los ángulos de enlace C-C-C en ciclopropano (diagrama anterior) (60 o) y ciclobutano (90 o) son muy diferentes al ángulo de unión ideal de 109.5 o. Este ángulo de unión hace que el ciclopropano y el ciclobutano tengan una tensión de anillo alta. Sin embargo, las moléculas, como el ciclohexano y el ciclopentano, tendrían una tensión de anillo mucho menor debido a que el ángulo de enlace entre los carbonos es mucho más cercano a 109.5 o.
A continuación se presentan algunos ejemplos de cicloalcanos. La deformación del anillo se puede ver de manera más prevalente en los modelos de ciclopropano y ciclobutano
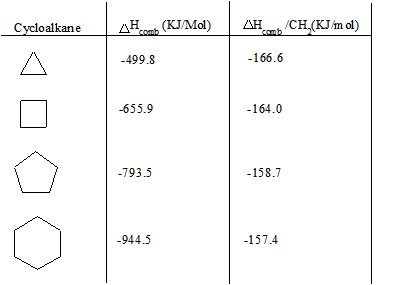
A continuación se muestra una tabla de cicloalcanos y sus respectivos calores de combustión (Δ H comb). El valor de peine Δ H aumenta a medida que aumenta el número de carbonos en el cicloalcano (anillo de miembros más altos), y la relación Δ H peine /CH 2 disminuye. El incremento en el peine Δ H se puede atribuir a la mayor cantidad de fuerzas de dispersión de Londres. Sin embargo, la disminución en Δ H peine /CH 2 puede atribuirse a una disminución en la tensión del anillo.
Ciertos cicloalcanos, como el ciclohexano, tratan la deformación del anillo formando confórmeros. Un conformador es un estereoisómero en el que existen moléculas de la misma conectividad y fórmula como isómeros diferentes, en este caso, para reducir la cepa del anillo. La deformación del anillo se reduce en confórmeros debido a las rotaciones alrededor de los enlaces sigma.
Otros tipos de cepa 
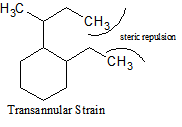
Hay muchos tipos diferentes de cepas que ocurren con los cicloalcanos. Además de la tensión del anillo, también hay deformación transanular, eclipsante o deformación torsional y tensión de ángulo de unión.La deformación transanular existe cuando hay repulsión estérica entre átomos. La deformación eclipsante (torsional) existe cuando un cicloalcano es incapaz de adoptar una conformación escalonada alrededor de un enlace C-C, y la deformación del ángulo de unión es la energía necesaria para distorsionar los carbonos tetraédricos lo suficiente como para cerrar el anillo. La presencia de deformación angular en una molécula indica que hay ángulos de enlace en esa molécula particular que se desvían de los ángulos de enlace ideales requeridos (es decir, esa molécula tiene confórmeros).


Ciclopropano
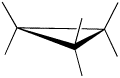
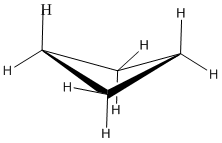
Un anillo de tres miembros no tiene libertad de rotación en absoluto, por lo que los tres átomos de carbono en el ciclopropano están todos obligados a estar en el mismo plano en las esquinas de un triángulo equilátero. Los ángulos de enlace de 60º son mucho menores que los ángulos óptimos de 109.5º de un átomo de carbono tetraédrico normal, y la deformación angular resultante influye dramáticamente en el comportamiento químico de este cicloalcano. El ciclopropano también sufre una tensión eclipsante sustancial, ya que todos los enlaces carbono-carbono están completamente eclipsados.
Además, si miras un modelo encontrarás que los enlaces C-H vecinos (también los bonos C-C) se mantienen en conformaciones eclipsadas.
El ciclopropano está siempre a máxima tensión torsional. Esta cepa se puede ilustrar en un dibujo lineal de ciclopropano como se muestra desde el lado. En esta vista oblicua, las líneas oscuras significan que esos lados del anillo están más cerca de ti.
Sin embargo, el anillo no es lo suficientemente grande como para introducir ninguna cepa estérica, lo que no se convierte en un factor hasta que alcanzamos anillos de seis miembros. Hasta ese punto, los anillos no son lo suficientemente flexibles como para que dos átomos alcancen alrededor y choquen entre sí.
El problema realmente grande con el ciclopropano es que los ángulos de enlace C-C-C son demasiado pequeños.
- Todos los átomos de carbono en el ciclopropano parecen ser tetraédricos.
- Estos ángulos de unión deben ser de 109 grados.
- Los ángulos en un triángulo equilátero son en realidad 60 grados, aproximadamente la mitad de grandes que el ángulo óptimo.
- Este factor introduce una gran cantidad de cepa en la molécula, llamada cepa de anillo.
Ciclobutano
El ciclobutano es un anillo de cuatro miembros. En dos dimensiones, es un cuadrado, con ángulos de 90 grados en cada esquina. El ciclobutano reduce cierta tensión de eclipsar el enlace al plegarse (el ángulo diedro fuera del plano es de aproximadamente 25º), pero la eclipsación total y la deformación angular siguen siendo altas. El ciclopentano tiene muy poca deformación angular (los ángulos de un pentágono son 108º), pero su deformación eclipsante sería grande (aproximadamente 10 kcal/mol) si permaneciera plana. En consecuencia, el anillo de cinco miembros adopta conformaciones frunzadas no planas siempre que sea posible.
Sin embargo, en tres dimensiones, el ciclobutano es lo suficientemente flexible como para doblarse en forma de “mariposa”, aliviando un poco la tensión torsional. Cuando hace eso, los ángulos de unión empeoran un poco, pasando de 90 grados a 88 grados.
En un dibujo lineal, esta forma de mariposa generalmente se muestra desde un lado, con los bordes cercanos dibujados usando líneas más oscuras.
- Con ángulos de unión de 88 grados en lugar de 109 grados, el ciclobutano tiene mucha tensión de anillo, pero menos que en el ciclopropano.
- La tensión torsional aún está presente, pero los enlaces vecinos no se eclipsan exactamente en la mariposa.
- El ciclobutano aún no es lo suficientemente grande como para que la molécula pueda alcanzar alrededor para causar hacinamiento. La cepa estérica es muy baja.
- Los ciclobutanos son un poco más estables que los ciclopropanos y también son un poco más comunes en la naturaleza.
Ciclopentano
Los ciclopentanos son aún más estables que los ciclobutanos, y son el segundo anillo parafínico más común en la naturaleza, después de los ciclohexanos. En dos dimensiones, un ciclopentano parece ser un pentágono regular.
En tres dimensiones, hay suficiente libertad de rotación para permitir un ligero giro fuera de esta forma plana. En un dibujo lineal, esta forma tridimensional se dibuja desde una vista oblicua, al igual que el ciclobutano.
- El ángulo ideal en un pentágono regular es de aproximadamente 107 grados, muy cercano a un ángulo de unión tetraédrico.
- El ciclopentano se distorsiona solo muy ligeramente en forma de “envolvente” en la que una esquina del pentágono se eleva por encima del plano de los otros cuatro, y como resultado, la tensión del anillo se elimina por completo.
- El sobre elimina la tensión torsional a lo largo de los lados y el colgajo del sobre. Sin embargo, los carbonos vecinos son eclipsados a lo largo del “fondo” de la envoltura, lejos del colgajo. Todavía hay alguna cepa torsional en el ciclopentano.
- Nuevamente, no hay tensión estérica en este sistema.
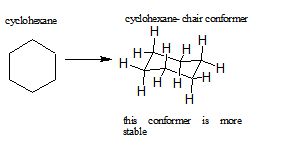
Los anillos más grandes que el ciclopentano tendrían deformación angular si fueran planos. Sin embargo, esta tensión, junto con la deformación eclipsante inherente a una estructura plana, se puede aliviar al plegar el anillo. El ciclohexano es un buen ejemplo de un sistema carbocíclico que prácticamente elimina la eclipsación y la deformación angular al adoptar conformaciones no planas. El cicloheptano y el ciclooctano tienen mayor cepa que el ciclohexano, en gran parte debido al hacinamiento transanular (impedimento estérico por grupos en lados opuestos del anillo).
Ejercicio\(\PageIndex{1}\)
1. Si el ciclobutano fuera plano, cuántas interacciones eclipsantes H-H habría, y suponiendo 4 kJ/mol por interacción eclipsante H-H ¿cuál es la tensión en esta molécula “plana”?
2. En las dos conformaciones de cis-ciclopentano una es más estable que la otra. Explique por qué es esto.

- Contestar
-
1. Hay 8 interacciones eclipsantes (dos por enlace C-C). La cepa extra en esta molécula sería de 32 kJ/mol (4 kJ/mol x 8).
2. La primera conformación es más estable. A pesar de que los grupos metilo son cis en el modelo de la izquierda, están eclipsando debido a la conformación, aumentando así la cepa dentro de la molécula.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John's University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry