6.3: Configuración absoluta y el sistema (R) y (S)
- Page ID
- 76448
Objetivo de aprendizaje
- nombrar compuestos quirales usando la nomenclatura (R) & (S)
UTILIZA TU KIT DE MODELADO: Los modelos ayudan a visualizar la estructura. Al usar un modelo, asegúrese de que la prioridad más baja esté apuntando lejos de usted. Luego determinar la dirección desde el sustituyente de mayor prioridad hasta el más bajo: en sentido horario (R) o antihorario (S).
SI NO TIENES UN KIT DE MODELADO: recuerde que los guiones significan que la unión va a entrar en la pantalla y las cuñas significa que la unión está saliendo de la pantalla. Si el vínculo de menor prioridad no está apuntando hacia atrás, rotarlo mentalmente para que así sea. Sin embargo, es muy útil a la hora de aprender química orgánica utilizar modelos.
Si tienes un kit de modelado úsalo mientras lees esta sección y trabajas los problemas de práctica.
Introducción y las reglas de Prioridad de Cahn-Ingold Prelog
Para nombrar inequívocamente a los enantiómeros de un compuesto, sus nombres deben incluir la “mano” de la molécula. Las letras “R” y “S” se determinan aplicando las reglas de Cahn-Ingold-Prelog (CIP). La actividad óptica (+/-) también se puede comunicar en el nombre, pero debe derivarse empíricamente. También existen convenciones bioquímicas para los carbohidratos (azúcares) y los aminoácidos (los componentes básicos de las proteínas).
El método de asignación inequívoca de las moléculas fue originado por tres químicos: R.S. Cahn, C. Ingold y V. Prelog y, como tal, a menudo también se le llama reglas Cahn-Inold-Prelog. Además del sistema CIP, existen dos formas de determinar experimentalmente la configuración absoluta de un enantiómero:
- Análisis de difracción de rayos X. Obsérvese que no existe correlación entre el signo de rotación y la estructura de un enantiómero particular.
- Correlación química con una molécula cuya estructura ya ha sido determinada por difracción de rayos X.
Sin embargo, para fines no de laboratorio, es beneficioso enfocarse en el sistema R/S. El signo de rotación óptica, aunque diferente para los dos enantiómeros de una molécula quiral, a la misma temperatura, no puede usarse para establecer la configuración absoluta de un enantiómero; esto se debe a que el signo de rotación óptica para un enantiómero particular puede cambiar cuando la temperatura cambios.
Las reglas de prioridad de Cahn-Ingold-Prelog se basan en los números atómicos de los átomos de interés. Para la quiralidad, los átomos de interés son los átomos unidos al carbono quiral.
- El átomo con mayor número atómico tiene mayor prioridad (I > Br > Cl > S > P > F > O > N > C > H).
- Al comparar isótopos, el átomo con mayor número de masa tiene mayor prioridad [18 O > 16 O o 15 N > 14 N o 13 C > 12 C o T (3 H) > D (2 H) > H].
- Cuando haya un empate en (2) anterior, establezca la prioridad relativa procediendo al siguiente átomo (s) a lo largo de la cadena hasta que se observe la primera diferencia.
Los enlaces múltiples se tratan como si cada enlace del enlace múltiple estuviera unido a un átomo único. Por ejemplo, el grupo etenilo (CH 2 =CH) tiene mayor prioridad que el grupo etilo (CH 3 CH 2). La prioridad de carbono de etenilo es “dos” enlaces a átomos de carbono y un enlace a un átomo de hidrógeno en comparación con el carbono etílico que tiene solo un enlace a un átomo de carbono y dos enlaces a dos átomos de hidrógeno. De manera similar, el triple enlace carbono-carbono del acetileno le daría mayor prioridad CIP que el grupo etenilo como se resume a continuación.
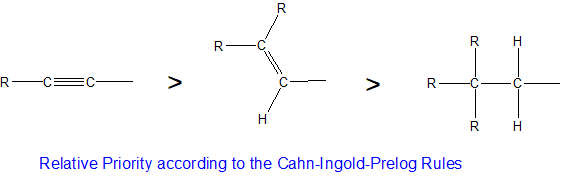
Los estereocentros están etiquetados como R o S
Se utiliza la nomenclatura “mano derecha” y “mano izquierda” para nombrar los enantiómeros de un compuesto quiral. Los estereocentros están etiquetados como R o S.
Considere el diagrama de arriba a la izquierda: se dibuja una flecha curva en sentido antihorario (c-cw) desde el sustituyente de mayor prioridad (1) hasta el sustituyente de prioridad más baja (4) en t él S - configuración (“Siniestro” → Latin=” izquierda”). El sentido contrario a las agujas del reloj puede ser reconocido por el movimiento a la izquierda al salir de la posición del reloj de 12 o'. Ahora considere el diagrama anterior a la derecha donde se dibuja una flecha curva en el sentido de las agujas del reloj (cw) desde el sustituyente de mayor prioridad (1) hasta el sustituyente de menor prioridad (4) en la configuración R (“Recto” → Latin= “derecho”). A continuación se agrega la R o S como prefijo, entre paréntesis, al nombre del enantiómero de interés. Se requiere un número de localizador si hay más de un centro quiral. De lo contrario, se espera que la persona que lea el nombre reconozca el centro quiral.
Ejemplo 1
Los dos compuestos quirales a continuación se dibujan para enfatizar el carbono quiral con el nombre químico completo debajo de cada estructura.
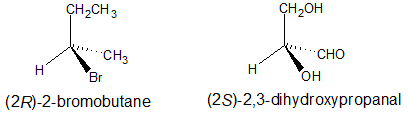
Configuraciones absolutas de fórmulas de perspectiva
Los químicos necesitan una manera conveniente de distinguir un estereoisómero de otro. El sistema Cahn-Ingold Prelog es un conjunto de reglas que nos permite definir sin ambigüedades la configuración estereoquímica de cualquier estereocentro, utilizando las designaciones 'R' (del latín recto, que significa diestro) o 'S' (de el latín siniestro, que significa zurdo).
Las reglas para este sistema de nomenclatura estereoquímica son, en la superficie, bastante simples.

