6.7: Actividad óptica y mezclas racémicas
- Page ID
- 76398
Objetivo de aprendizaje
- definir y explicar la falta de actividad óptica de mezclas racémicas
- determinar la composición porcentual de una mezcla enantiomérica a partir de los datos de polarimetría y la fórmula para rotación específica
Mezclas Racémicas (Racimates)
Una mezcla racémica es una mezcla 50:50 de dos enantiómeros. Las mezclas racémicas fueron un descubrimiento experimental interesante porque dos muestras ópticamente activas se pueden combinar en una proporción 1:1 para crear una muestra ópticamente INACTIVA. La polarimetría se utiliza para medir la actividad óptica. A continuación se discuten la historia y los fundamentos teóricos.
Identificar y distinguir enantiómeros es intrínsecamente difícil, ya que sus propiedades físicas y químicas son en gran parte idénticas. Afortunadamente, un descubrimiento de casi doscientos años del físico francés Jean-Baptiste Biot ha facilitado mucho esta tarea. Este descubrimiento reveló que los enantiómeros diestros y zurdos de un compuesto quiral perturban la luz polarizada en el plano de maneras opuestas. Esta perturbación es única para las moléculas quirales, y se ha denominado actividad óptica.
Polarimetría
La luz polarizada en el plano se crea haciendo pasar luz ordinaria a través de un dispositivo polarizador, que puede ser tan simple como una lente tomada de gafas de sol polarizantes. Dichos dispositivos transmiten selectivamente solo ese componente de un haz de luz que tiene vectores de campo eléctrico y magnético que oscilan en un solo plano. El plano de polarización puede ser determinado por un instrumento llamado polarímetro, mostrado en el diagrama a continuación.
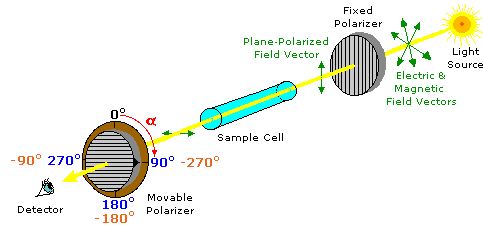
Luz monocromática (longitud de onda única), es polarizada por un polarizador fijo junto a la fuente de luz. Se ubica un portacélula de muestra alineado con el haz de luz, seguido de un polarizador móvil (el analizador) y un ocular a través del cual se puede observar la intensidad de la luz. En los instrumentos modernos un detector electrónico de luz toma el lugar del ojo humano. En ausencia de una muestra, la intensidad de la luz en el detector es máxima cuando el segundo polarizador (móvil) se establece paralelo al primer polarizador (α = 0º). Si el analizador se gira 90º al plano de polarización inicial, se bloqueará toda la luz para que no llegue al detector.
Los químicos utilizan polarímetros para investigar la influencia de compuestos (en la celda de muestra) en la luz polarizada plana. Las muestras compuestas solo por moléculas aquirales (por ejemplo, agua o hexano), no tienen ningún efecto sobre el haz de luz polarizada. Sin embargo, si se examina un solo enantiómero (todas las moléculas de muestra son diestras, o todas son zurdas), el plano de polarización se gira en sentido horario (positivo) o antihorario (negativo), y el analizador debe girarse en un ángulo coincidente apropiado, α, si está lleno la intensidad de la luz es llegar al detector. En la ilustración anterior, la muestra ha girado el plano de polarización en sentido horario +90º, y el analizador se ha girado esta cantidad para permitir la máxima transmisión de luz.
Las rotaciones observadas (\(\alpha\)) de los enantiómeros son opuestas en dirección. Un enantiómero rotará la luz polarizada en el sentido de las agujas del reloj, denominado dextrorrotatorio o (+), y su compañero de imagen especular en sentido antihorario, denominado levorrotatorio o (—). Los prefijos dextro y levo provienen del latín dexter, que significa derecha, y laevus, para izquierda, y se abrevian d y l respectivamente. Si se examinan cantidades iguales de cada enantiómero, utilizando la misma celda de muestra, entonces la magnitud de las rotaciones será la misma, siendo una positiva y la otra negativa. Para estar absolutamente seguro de si una rotación observada es positiva o negativa, a menudo es necesario realizar una segunda medición utilizando una cantidad o concentración diferente de la muestra. En la ilustración anterior, por ejemplo, α podría ser —90º o +270º en lugar de +90º. Si la concentración de la muestra se reduce en un 10%, entonces la rotación positiva cambiaría a +81º (o +243º) mientras que la rotación negativa cambiaría a —81º, y la α correcta se identificaría sin ambigüedades.
Dado que no siempre es posible obtener o utilizar muestras de exactamente el mismo tamaño, la rotación observada generalmente se corrige para compensar las variaciones en la cantidad de muestra y longitud de celda. Por lo tanto, es práctica común convertir la rotación observada, α, en una rotación específica, mediante la siguiente fórmula:
\[[\alpha]_D = \dfrac{\alpha}{l c} \tag{5.3.1}\]
donde
- \([\alpha]_D\)es la rotación específica
- \(l\)es la longitud de celda en dm
- \(c\)es la concentración en g/ml
- \(D\)designa que la luz utilizada es la línea 589 de una lámpara de sodio
Los compuestos que giran el plano de la luz polarizada se denominan ópticamente activos. Cada enantiómero de un par estereoisomérico es ópticamente activo y tiene una rotación específica igual pero opuesta en signo. Las rotaciones específicas son útiles ya que son constantes determinadas experimentalmente que caracterizan e identifican enantiómeros puros. Por ejemplo, los enantiómeros de ácido láctico y carvona discutidos anteriormente tienen las siguientes rotaciones específicas.
| Carvone de comino: [α] D = +62.5º | este isómero puede denominarse (+) -carvona o d - carvona |
| Carvone de menta verde: [α] D = —62.5º | este isómero puede denominarse (—) -carvona o l-carvona |
| Ácido láctico del tejido muscular: [α] D = +2.5º | este isómero puede denominarse ácido (+) -láctico o ácido d - láctico |
| Ácido láctico de la leche agria: [α] D = —2.5º | este isómero puede denominarse ácido (—) -láctico o ácido l-láctico |
Una mezcla 50:50 de enantiómeros no tiene actividad óptica observable. Dichas mezclas se denominan racematos o modificaciones racémicas, y se designan (±). Cuando los compuestos quirales se crean a partir de compuestos aquirales, los productos son racémicos a menos que un solo enantiómero de un co-reactante quiral o catalizador esté involucrado en la reacción. La adición de HBr a cis- o trans-2-buteno es un ejemplo de formación de producto racémico (el centro quiral es de color rojo en la siguiente ecuación).
| CH 3 CH=CHCH 3 + HBr |  |
(±) CH 3 CH 2 C HBrCH 3 |
Los compuestos orgánicos quirales aislados de organismos vivos suelen ser ópticamente activos, lo que indica que predomina uno de los enantiómeros (a menudo es el único isómero presente). Esto es resultado de la acción de los catalizadores quirales que llamamos enzimas, y refleja la naturaleza inherentemente quiral de la vida misma. Los compuestos sintéticos quirales, por otro lado, son comúnmente racematos, a menos que hayan sido preparados a partir de materiales de partida enantioméricamente puros.
Hay dos formas en las que se puede cambiar la condición de una sustancia quiral:
1. Un racemato puede separarse en sus enantiómeros componentes. Este proceso se llama resolución.
2. Un enantiómero puro puede transformarse en su racemato. Este proceso se llama racemización.
Exceso enantiomérico
La “pureza óptica” es una comparación de la rotación óptica de una muestra pura de estereoquímica desconocida versus la rotación óptica de una muestra de enantiómero puro. Se expresa como porcentaje. Si la muestra solo gira la luz polarizada en plano la mitad de lo esperado, la pureza óptica es del 50%.

Debido a que los enantiómeros R y S tienen actividad óptica igual pero opuesta, se deduce naturalmente que una mezcla racémica 50:50 de dos enantiómeros no tendrá actividad óptica observable. Si conocemos la rotación específica para una molécula quiral, sin embargo, podemos calcular fácilmente la relación de enantiómeros presentes en una mezcla de dos enantiómeros, en base a su actividad óptica medida. Cuando una mezcla contiene más de un enantiómero que el otro, los químicos suelen utilizar el concepto de exceso enantiomérico (ee) para cuantificar la diferencia. El exceso enantiomérico se puede expresar como:
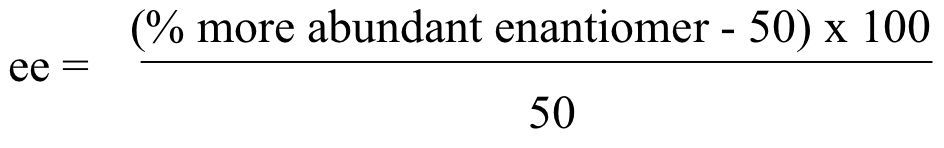
Por ejemplo, una mezcla que contiene 60% de enantiómero R (y 40% enantiómero S) tiene un 20% de exceso enantiomérico de R: ((60-50) x 100)/50 = 20%.
Ejemplo
La rotación específica de (S) -carvona es (+) 61°, medida 'pura' (muestra líquida pura, sin disolvente). La rotación óptica de una muestra pura de una mezcla de carvona R y S se mide a (-) 23°. ¿Qué enantiómero está en exceso, y cuál es su ee? ¿Cuáles son los porcentajes de (R) - y (S) -carvona en la muestra?
Solución
La rotación observada de la mezcla es levorotaria (negativa, antihoraria), y la rotación específica del enantiómero S puro se da como dextrorrotatorio (positivo, en sentido horario), lo que significa que el enantiómero R puro debe ser levorotario, y la mezcla debe contener más de Enantiómero R que del enantiómero S.
Rotación (mezcla R/S) = [Fracción (S) × Rotación (S)] + [Fracción (R) × Rotación (R)]
Dejar Fracción (S) = x, por lo tanto Fracción (R) = 1 — x
Rotación (mezcla R/S) = x [Rotación (S)] + (1 — x) [Rotación (R)]
—23 = x (+61) + (1 — x) (—61)
Resolver para x: x = 0.3114 y (1 — x) = 0.6885
Por lo tanto, los porcentajes de (R) - y (S) -carvona en la muestra son 68.9% y 31.1%, respectivamente.
ee = [(% enantiómero más abundante — 50) × 100] /50
= [68.9 — 50) × 100] /50 = 37.8%
Las moléculas quirales a menudo se marcan de acuerdo con el signo de su rotación específica, como en (S) - (+) -carvona y (R) - (-) -carvona, o (±) -carvona para la mezcla racémica. Sin embargo, no existe relación alguna entre la designación R/S de una molécula y el signo de su rotación específica. Sin realizar un experimento de polarimetría o buscar en la literatura, no tendríamos idea de que (-) -carvona tiene la configuración R y (+) -carvona tiene la configuración S.
Separación de compuestos quirales
Como se señaló anteriormente, los compuestos quirales sintetizados a partir de materiales de partida y reactivos aquirales son generalmente racémicos (es decir, una mezcla 50:50 de enantiómeros). La separación de racematos en sus enantiómeros componentes es un proceso llamado resolución. Dado que los enantiómeros tienen propiedades físicas idénticas, como la solubilidad y el punto de fusión, la resolución es extremadamente difícil. Los diastereómeros, por otro lado, tienen diferentes propiedades físicas, y este hecho se utiliza para lograr la resolución de los racematos. La reacción de un racemato con un reactivo quiral enantioméricamente puro da una mezcla de diastereómeros, que pueden separarse. Por ejemplo, si una mezcla racémica de un alcohol quiral se hace reaccionar con un ácido carboxílico enantioméricamente puro, el resultado es una mezcla de diastereómeros: en este caso, debido a que se utilizó el entantiómero (R) puro del ácido, el producto es una mezcla de ésteres diastereoméricos (R-R) y (R-S), que pueden, en teoría, ser separados por sus diferentes propiedades físicas. La hidrólisis posterior de cada éster separado producirá los alcoholes 'resueltos' (enantioméricamente puros). Los utilizados en esta técnica se conocen como '
Ejercicio 1
Una muestra con una concentración de 0.3 g/mL se colocó en una celda con una longitud de 5 cm. La rotación resultante en la línea D de sodio fue de +1.52°. ¿Qué es la [α] D?
Solución
5 cm = 0.5 dm
[α] D = α/ (c x l) = +1.52/ (0.3 x 0.5) = +10.1°
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)

