7.5: La Reacción S2
- Page ID
- 76219
Objetivos de aprendizaje
- determinar la ley de velocidad y predecir el mecanismo basado en su ecuación de velocidad o datos de reacción para reacciones S N 2
- proponer mecanismos para reacciones de S N 2
- dibujar e interpretar Diagramas de Energía de Reacción para reacciones S N 2
Introducción
En muchos sentidos, el proceso de transferencia de protones de una reacción ácido-base de Brønsted-Lowry puede considerarse simplemente como un tipo especial de reacción de sustitución nucleofílica, una en la que el electrófilo es un hidrógeno en lugar de un carbono.
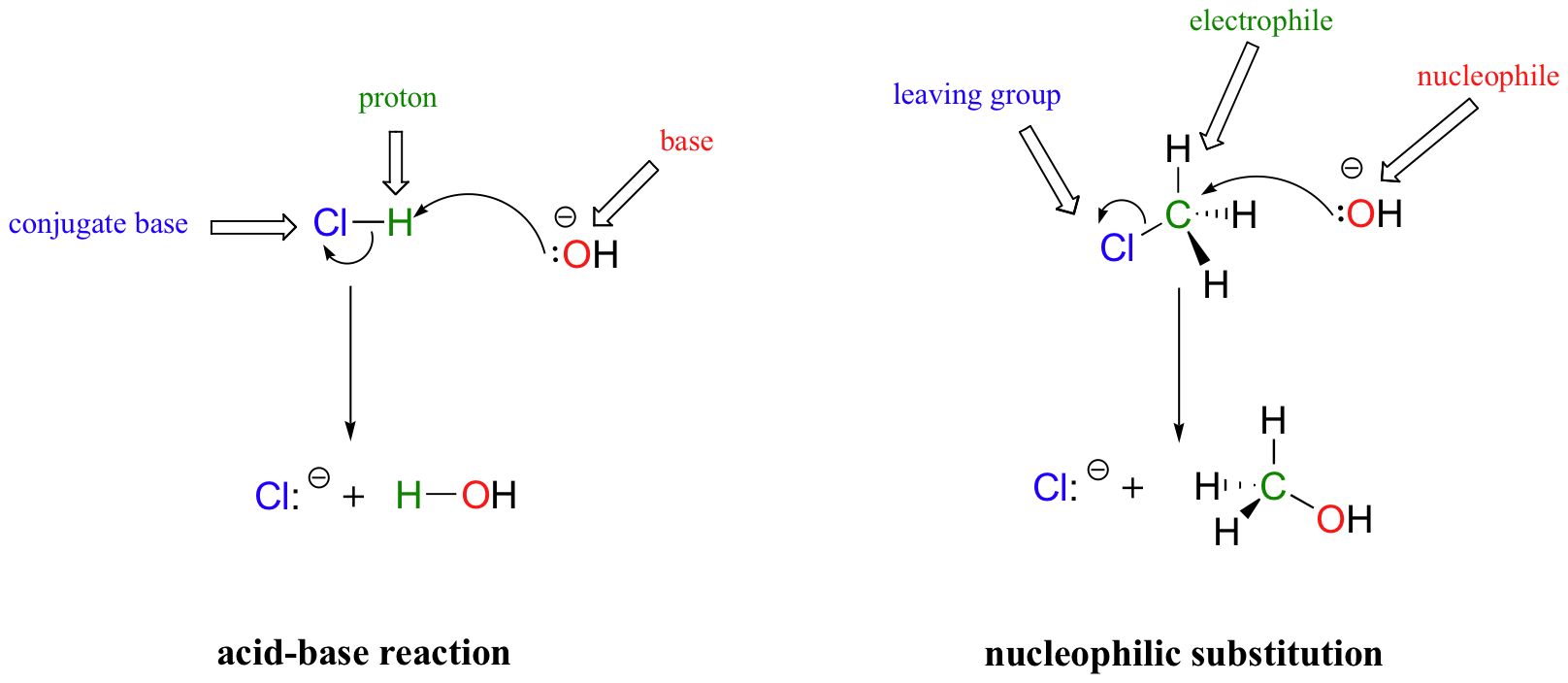
En ambos tipos de reacción, estamos viendo jugadores muy similares: una especie rica en electrones (el nucleófilo/base) reacciona con una especie pobre en electrones (el electrófilo/protón), expulsando del grupo saliente/base conjugada.
En las próximas secciones, vamos a estar discutiendo algunos aspectos generales de las reacciones de sustitución nucleofílica, y al hacerlo simplificará mucho las cosas si podemos usar algunas abreviaturas y generalizaciones antes de sumergirnos en ejemplos reales.
¿Qué es un nucleófilo (Nu)?
En lugar de mostrar un nucleófilo específico como el hidróxido, simplemente nos referiremos al reactivo nucleófilo como 'Nu'. Los grupos funcionales nucleofílicos son aquellos que tienen átomos ricos en electrones capaces de donar un par de electrones para formar un nuevo enlace covalente. Los nucleófilos pueden estar cargados negativamente y algunos que son neutros con electrones de par solitario. Tanto en la química orgánica de laboratorio como biológica, los átomos nucleofílicos más relevantes son el oxígeno, el nitrógeno y el azufre, y los grupos funcionales nucleofílicos más comunes son el agua, alcoholes, fenoles, aminas, tioles y ocasionalmente carboxilatos.
Más específicamente en las reacciones de laboratorio, los aniones haluro y azida (N 3 -) se ven comúnmente actuando como nucleófilos.
Al pensar en nucleófilos, lo primero que hay que reconocer es que, en su mayor parte, la misma cualidad de 'riqueza de electrones' que hace algo nucleofílico también lo hace básico: los nucleófilos pueden ser bases, y las bases pueden ser nucleófilos. No debería sorprendernos, entonces, que la mayoría de las tendencias de basicidad que ya hemos discutido se apliquen también a la nucleofilia.
Es inevitable cierta confusión para distinguir la basicidad (fuerza base) y la nucleofilia (fuerza nucleofílica). Dado que la basicidad es un concepto menos problemático; es conveniente comenzar con él. La basicidad se refiere a la capacidad de una base para aceptar un protón. La basicidad puede estar relacionada con el pKa del ácido conjugado correspondiente, como se muestra a continuación. Las bases más fuertes tienen los ácidos conjugados más débiles y viceversa. El rango de basicidades incluidas en la siguiente tabla es notable, ¡cubriendo más de cincuenta potencias de diez!
En un equilibrio ácido-base predominarán el ácido más débil y la base más débil (necesariamente estarán del mismo lado del equilibrio). Aprender los valores de pKa para compuestos comunes proporciona una base útil sobre la cual construir una comprensión de los factores ácido-base en los mecanismos de reacción.
| Base | I (—) | Cl (—) | H 2 O | CH 3 CO 2 (—) | RS (—) | CN (—) | RO (—) | NH 2 (—) | CH 3 (—) |
|---|---|---|---|---|---|---|---|---|---|
| Conj. Ácido | HOLA | HCl | H 3 O (+) | CH 3 CO 2 H | RSH | HCN | ROH | NH 3 | CH 4 |
| pK a | -9 | -7 | -1.7 | 4.8 | 8 | 9.1 | 16 | 33 | 48 |

La nucleofilia es una propiedad más compleja. Comúnmente se refiere a la velocidad de reacciones de sustitución en el átomo de carbono portador de halógenos de un haluro de alquilo de referencia, tal como CH 3 -Br. Así, la nucleofilia del reactivo Nu: (—) en la siguiente reacción de sustitución varía como se muestra en la siguiente tabla:
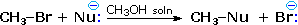 |
|---|
|
Nucleofilia: CH 3 CO 2 (—) < Cl (—) < Br (—) < N 3 (—) < CH 3 O (—) < CN (—) < I (—) < CH 3 S (—) |
 |
¿Qué es un grupo de salida (X o LG)?
De manera similar, llamaremos al grupo de salida 'X' para halógenos como es costumbre. Para otras reacciones, será más preciso abreviar al grupo de salida como “LG”. El contexto de la reacción dictará la abreviatura. Los grupos que salen a veces están cargados negativamente, a veces neutrales, y a veces positivamente cargados. Por lo tanto, en este cuadro general no incluiremos una designación de carga en las especies 'X' o 'LG'. Al referirse a la comparación entre la química ácido-base y las reacciones de sustitución, se evalúa la estabilidad del grupo saliente de la misma manera que evaluamos la estabilidad de las bases conjugadas.
Al comparar la reactividad de los electrófilos que varían solo en sus grupos de salida, entonces la estabilidad del grupo de salida juega un papel dominante. Se favorecerá al electrófilo con el grupo de salida más estable. Cuanto menor es la densidad electrónica del grupo lábil, más estable es. Los grupos neutrales están favoreciendo sobre los grupos de salida cargados. Al comparar grupos salientes cargados, aplique los conceptos utilizados para determinar la estabilidad relativa de las bases conjugadas:
1) identidad o identidades del átomo o átomos que sostienen la carga
2) deslocalización de la carga por resonancia
3) efectos inductivos
4) hibridación orbital
¿Qué es un electrófilo (E)?
Un electrófilo acepta electrones análogos a un ácido de Lewis. Los electrófilos (E) a veces son protonados y a veces neutros. Los electrófilos también se pueden llamar “Sustratos”. Dado que los nucleófilos, grupos de salida y electrones pueden estar cargados o neutros, no incluiremos cargas en 'Nu' o 'X' (o 'LG') o 'E'.
Generalizaremos los otros tres grupos unidos en el carbono alfa electrófilo como R1, R2 y R3: estos símbolos podrían representar tanto hidrógenos como grupos alquilo. Por último, para evitar que las cifras se llenen demasiado, utilizaremos en la mayoría de los casos la convención de estructura lineal en la que el carbono central electrófilo no se dibuja como una 'C'.
Aquí, entonces, está el cuadro generalizado de una reacción de sustitución nucleofílica concertada (de un solo paso):
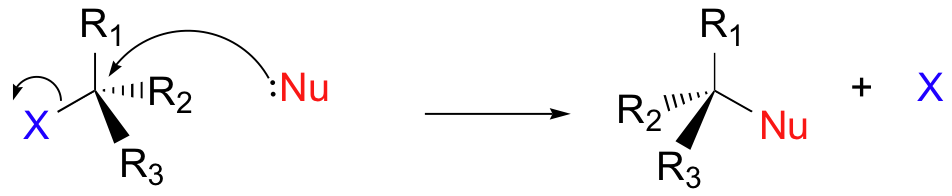
Para reconocer los electrófilos neutros, necesitaremos identificar la polaridad y/o resonancia con compuestos para crear una carga positiva parcial que atraiga al nucleófilo. La electrofilicidad de los haluros de alquilo proviene del enlace polar carbono-halógeno.
Los halógenos comunes son flúor, cloro, bromo y yodo. A excepción del yodo, estos halógenos tienen electronegatividades significativamente mayores que el carbono. En consecuencia, este grupo funcional se polariza de manera que el carbono es electrófilo y el halógeno es nucleófilo, como se muestra en el dibujo de la derecha. Dos características distintas de la electronegatividad también tienen una influencia importante en el comportamiento químico de estos compuestos. El primero de ellos es la fuerza de enlace covalente. El más fuerte de los enlaces covalentes carbono-halógeno es el del flúor. Sorprendentemente, este es el enlace simple común más fuerte al carbono, siendo aproximadamente 30 kcal/mol más fuerte que un enlace carbono-carbono y aproximadamente 15 kcal/mol más fuerte que un enlace carbono-hidrógeno. Debido a esto, los fluoruros de alquilo y los fluorocarbonos en general son química y termodinámicamente bastante estables, y no comparten ninguno de los patrones de reactividad mostrados por los otros haluros de alquilo. El enlace covalente carbono-cloro es ligeramente más débil que un enlace carbono-carbono, y los enlaces a los otros halógenos son aún más débiles, siendo el enlace al yodo aproximadamente 33% más débil. El segundo factor a considerar es la estabilidad relativa de los correspondientes aniones haluro, que es probablemente la forma en que estos átomos electronegativos serán reemplazados. Esta estabilidad puede estimarse a partir de las acidedades relativas de los ácidos H-X, asumiendo que el ácido más fuerte libera la base conjugada más estable (anión haluro). Con la excepción del HF (pK a = 3.2), todos los ácidos hidrohalogenados son muy fuertes, siendo pequeñas diferencias en la dirección HCl < HBr < HI.
Ejercicio
1. Dado que todo es relativo en química, el nucleófilo de una reacción puede ser el grupo de salida de otra reacción. Algunos grupos funcionales solo pueden reaccionar como nuclefilo o electrófilo, mientras que otros grupos funcionales pueden reaccionar como nuclefilo o electrófilo dependiendo de las condiciones de reacción. Clasificar los siguientes compuestos como nucleófilos, electrófilos o grupos salientes. Más de una respuesta puede ser posible.
a) bromoetano
b) hidróxido
c) agua
d) clorociclohexano
e) etanol
f) bromuro
- Responder
-
a) electrófilo (Los haluros de alquilo son siempre electrófilos, una razón por la que son el mejor amigo de un estudiante de o-química).
b) nucleófilo fuerte
c) nucleófilo débil y buen grupo de salida
d) electrófilo (Los haluros de alquilo son siempre electrófilos, una razón por la que son el mejor amigo de un estudiante de o-química).
e) nucleófilo débil, un electrófilo pobre sin química inteligente (estad atentos para futuros capítulos), buen grupo de salida
f) buen nucleófilo y un buen grupo de salida
El mecanismo S N 2
Existen dos modelos mecanicistas de cómo un haluro de alquilo puede sufrir sustitución nucleofílica, S N 2 y S N 1. La reacción de S N 2 tiene lugar en una sola etapa con la formación de la unión y la ruptura de la unión ocurriendo simultáneamente. (En todas las cifras de esta sección, 'X' indica un sustituyente halógeno).
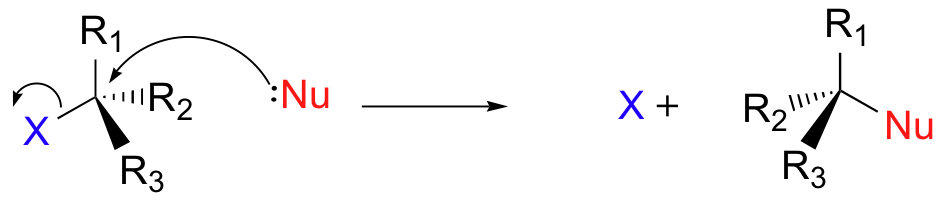
Esto se llama un mecanismo 'S N 2'. En el término S N 2, S significa 'sustitución', el subíndice N significa 'nucleofílico', y el número 2 se refiere a que se trata de una reacción bimolecular: la velocidad global depende de un paso en el que dos moléculas separadas (el nucleófilo y el electrófilo) chocan. Un diagrama de energía potencial para esta reacción muestra el estado de transición (TS) como el punto más alto en la ruta de los reactivos a los productos.
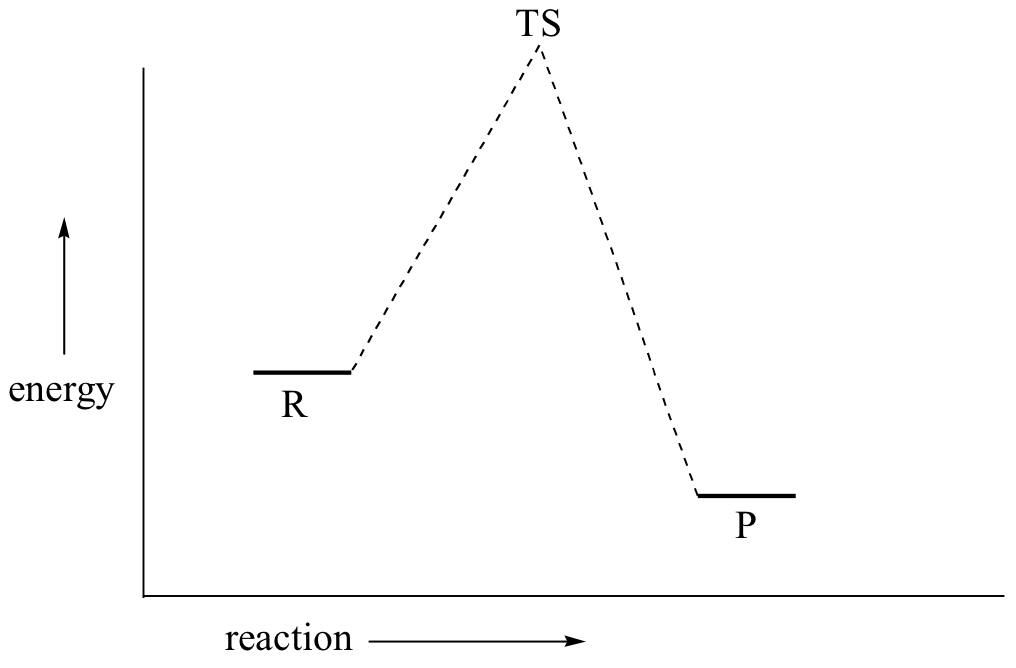
Si miras detenidamente el progreso de la reacción del S N 2, te darás cuenta de algo muy importante sobre el resultado. El nucleófilo, al ser una especie rica en electrones, debe reaccionar con el carbono electrófilo de la parte posterior en relación con la ubicación del grupo lápida. Acercarse desde la parte frontal simplemente no funciona: el grupo rico en electrones, dejando bloquea el camino con repulsión electrostática y obstáculo estérico.
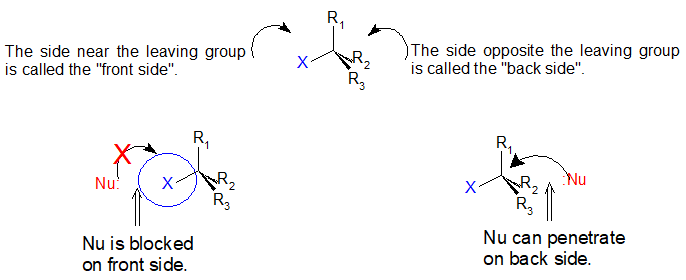
El resultado de esta penetración posterior es que la configuración estereoquímica en el carbono central se invierte a medida que avanza la reacción. En cierto sentido, la molécula se da vuelta del revés. En el estado de transición, el carbono electrófilo y los tres sustituyentes 'R' se encuentran todos en el mismo plano.

Lo que esto significa es que las reacciones de S N 2 catalizadas por enzimas o no, son inherentemente estereoselectivas: cuando la sustitución tiene lugar en un estereocentro, podemos predecir con confianza la configuración estereoquímica del producto. A continuación se muestra una animación que ilustra los principios que acabamos de aprender, mostrando la reacción de S N 2 entre el ión hidróxido y el yoduro de metilo. Observe cómo el ataque posterior por el nucleófilo de hidróxido resulta en inversión en el electrófilo de carbono tetraédrico.

Ejercicio
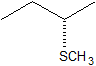
2. Predecir la estructura del producto en esta reacción de S N 2. Asegúrese de especificar la estereoquímica.

Solución
2.
S N 2 Las reacciones ocurren en los carbonos sp 3 con un grupo de salida
Se debe hacer un punto más importante antes de continuar: las sustituciones nucleofílicas por regla general ocurren en los carbonos hibridados sp 3 unidos a un grupo lápida. Las reacciones de SN2 no pueden ocurrir cuando el grupo lábil está unido a un carbono hibridado sp 2:

Los enlaces en los carbonos hibridados sp 2 son inherentemente más cortos y más fuertes que los enlaces en los carbonos hibridados sp 3, lo que significa que es más difícil romper el enlace C-X en estos sustratos. Las reacciones de S N 2 de este tipo son improbables también porque el carbono electrófilo (hipotético) está protegido del ataque nucleofílico por la densidad electrónica en el enlace p. Las reacciones de S N 1 son altamente improbables, ya que el intermedio de carbocatión resultante, que sería hibridado por SP, sería muy inestable (discutiremos la estabilidad relativa de los intermedios de carbocationes en una sección posterior de este módulo).
Para referencia futura al discernir entre reacciones de sustitución y eliminación, evaluar la estructura del electrófilo puede eliminar posibles productos. Si el carbono electrófilo no tiene betahidrógenos, entonces solo pueden ocurrir reacciones de sustitución y las reacciones de eliminación no son posibles (por supuesto, puede ser necesario considerar reordenamientos de carbocationes). Los primeros cuatro haluros que se muestran a la izquierda de abajo no dan reacciones de eliminación en el tratamiento con base, debido a que no tienen β-hidrógenos. Los dos haluros de la derecha normalmente no experimentan tales reacciones debido a que los productos de eliminación potenciales tienen dobles o triples enlaces altamente tensos. También vale la pena señalar que los compuestos C-X hibridados con sp 2, como los tres de la derecha, normalmente no experimentan reacciones de sustitución nucleofílica, a menos que otros grupos funcionales perturben el doble enlace (s).
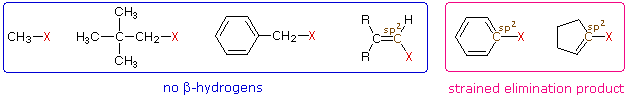
Ejercicio
3. Predecir qué haluros de alquilo pueden sufrir una reacción de S N 2.
a) C 6 H 5 Br
b) CH 3 CH 2 CH 2 Br
c) CH 2 CHBr
d) CH 3 CH 2 CH 2 CHBRCH 3
- Soluciones
- 3.
- a) No, haluro de arilo.
- b) Sí, haluro de alquilo primario
- c) No, haluro de vinilo
- d) Sí, haluro de alquilo secundario
Cinética de reacción S N 2
En el término S N 2, el S significa sustitución, el N significa nucleófilo y el número dos significa bimolecular, lo que significa que hay dos moléculas involucradas en el paso determinante de la velocidad. La tasa de reacciones de sustitución nucleofílica bimolecular depende de la concentración tanto del haloalcano como del nucleófilo. Para entender cómo la tasa depende de las concentraciones tanto del haloalcano como del nucleófilo, veamos el siguiente ejemplo. El ion hidróxido es el nucleófilo y el yoduro de metilo es el haloalcano.
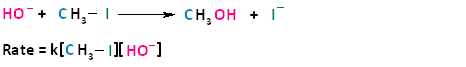
Si tuviéramos que duplicar la concentración ya sea del haloalcano o del nucleófilo, podemos ver que la velocidad de la reacción procedería dos veces más rápida que la velocidad inicial.
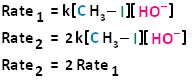
Si tuviéramos que duplicar la concentración tanto del haloalcano como del nucleófilo, podemos ver que la velocidad de la reacción procedería cuatro veces más rápido que la velocidad inicial.
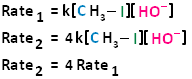
La reacción de sustitución nucleofílica bimolecular sigue una cinética de segundo orden; es decir, la velocidad de reacción depende de la concentración de dos reactivos de primer orden. En el caso de la sustitución nucleofílica bimolecular, estos dos reactivos son el haloalcano y el nucleófilo. Para obtener más aclaraciones sobre la cinética de reacción, los siguientes enlaces pueden facilitar su comprensión de las leyes de velocidad, las constantes de velocidad y la cinética de segundo orden
Ejercicio
4. La reacción siguiente sigue el mecanismo SN2.
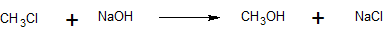
a) Escribir la ley de tarifas para esta reacción.
b) Determinar el valor del coeficiente de velocidad, k, si las concentraciones iniciales son 0.01 M CH 3 Cl, 0.01 M NaOH, y la velocidad de reacción inicial es 6 x 10 -10 M/s.
c) Calcular la velocidad de reacción inicial si las concentraciones iniciales de reactivos se cambian a 0.02 M CH 3 Cl y 0.0005 M NaOH.
- Soluciones
-
4.
a) tasa = k [CH 3 Cl] [OH -]
b) sustituir los datos en la expresión de tasa anterior y aplicar álgebra para resolver para k
k = 6 x 10 -6 Lmol -1 s -1
c) Utilizando la ley de tasas anterior, sustituir el valor por k de la pregunta anterior junto con las nuevas concentraciones para determinar la nueva tasa inicial.
tasa = 6 x 10 -10 M/s
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)

