7.6: Características de la Reacción S2
- Page ID
- 76196
Objetivo de aprendizaje
- determinar la ley de velocidad y predecir el mecanismo basado en su ecuación de velocidad o datos de reacción para reacciones S N 2
- predecir los productos y especificar los reactivos para reacciones de S N 2 con estereoquímica
- proponer mecanismos para reacciones de S N 2
- dibujar e interpretar Diagramas de Energía de Reacción para reacciones S N 2
Introducción
Para entender por qué algunas combinaciones de haluros de alquilo y nucleófilos dan una reacción de sustitución, mientras que otras combinaciones dan eliminación, y otras no dan reacción observable, debemos investigar sistemáticamente la forma en que los cambios en las variables de reacción perturban el curso de la reacción. La siguiente ecuación general resume los factores que serán importantes en dicha investigación donde X representa el grupo saliente (un haluro para este capítulo).

En orden de importancia decreciente, los factores que impactan en las vías de reacción de S N 2 son
1) estructura del haluro de alquilo
2) fuerza del nucleófilo
3) estabilidad del grupo saliente
4) tipo de solvente.
El estado de transición bimolecular de la vía S N 2 significa que los esterinos son una consideración primaria. Los orbitales del nucleófilo deben ser capaces de penetrar a través de la solución de reacción y crear solapamiento orbital con los orbitales del carbono electrófilo. Los esteros de este mecanismo se pueden determinar aplicando las teorías de unión para compuestos e iones individuales a la interacción del nucleófilo y el electrófilo. La fuerza del nucleófilo también influirá en la reacción junto con la estabilidad del grupo saliente. Los solventes pueden tener un efecto sutil pero medible en la vía de S N 2. La solvatación puede definirse como la interacción entre moléculas de disolvente y partículas de soluto. El resultado de la solvatación es estabilizar (es decir, disminuir la energía de) las partículas de soluto. Los solventes con pares solitarios de electrones son buenos para solvatar cationes. Los solventes próticos (es decir, hidroxílicos) son capaces de solvatar aniones a través de enlaces de hidrógeno. Como el agua tiene dos pares solitarios de electrones y también es prótica, es buena para solvatar tanto aniones como cationes. El papel del solvente a menudo se malinterpreta y, en consecuencia, se le da demasiada importancia. No se ahogue en el solvente. Los efectos de solvatación son menos significativos que la estructura del haluro de alquilo, la reactividad del nucleófilo y la estabilidad del grupo saliente.
Se pueden utilizar las siguientes variables y observables para estudiar el mecanismo S N 2.
| Variables |
R cambia α-carbono de 1º a 2º a 3º |
|---|---|
| Observables |
Sustitución de productos, eliminación, sin reacción. |
Cuando se pueden cambiar varias variables de reacción, es importante aislar los efectos de cada una durante el curso del estudio. En otras palabras: solo se debe cambiar una variable a la vez, manteniéndose las otras lo más constantes posible. Por ejemplo, podemos examinar el efecto de cambiar el sustituyente halógeno de Cl a Br a I, usando etilo como grupo R común, anión cianuro como nucleófilo común y etanol como disolvente común. Encontraríamos un producto de sustitución común, C 2 H 5 —CN, en todos los casos, pero la velocidad o velocidad de la reacción aumentaría en el orden: Cl < Br < I. Este orden de reactividad refleja tanto la fuerza del enlace C—X como la estabilidad de X (—) como grupo saliente, y lleva a la conclusión general de que los yoduros de alquilo son los miembros más reactivos de esta clase funcional.
Las reacciones de sustitución nucleofílica bimolecular están concertadas
Las reacciones de sustitución nucleofílica bimolecular (SN 2) son concertadas, lo que significa que son un proceso de un solo paso. La formación de enlaces entre el nucleófilo y el carbono electrófilo ocurre al mismo tiempo que la ruptura del enlace entre el carbono electofílico y el halógeno.
A continuación se muestra el diagrama de energía potencial para una reacción de SN 2. El mecanismo de un solo paso significa que solo se forma un solo estado de transición. Un estado de transición, a diferencia de un intermedio de reacción, es una especie de vida muy corta que no se puede aislar ni observar directamente.
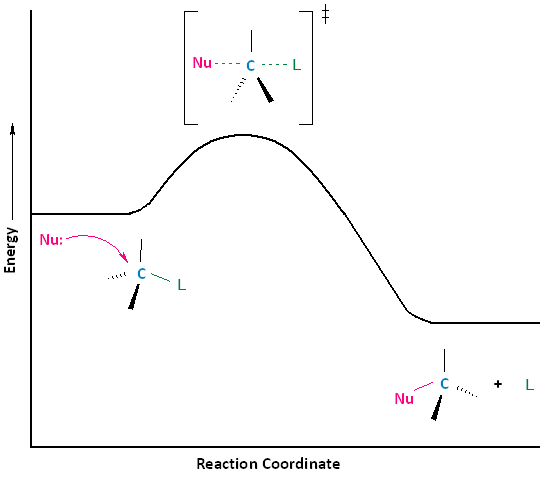
Estructura de haluro de alquilo (sustrato) y velocidades de reacción de S N 2
Ahora que hemos discutido los efectos que el grupo saliente, el nucleófilo y el disolvente tienen sobre las reacciones de sustitución nucleofílica biomolecular (S N 2), es el momento de centrar nuestra atención en cómo el sustrato afecta la reacción. Si bien el sustrato, en el caso de la sustitución nucleofílica de haloalcanos, se considera que es la molécula entera en un círculo abajo, estaremos prestando especial atención a la porción alquílica del sustrato. En otras palabras, estamos más interesados en el centro electrófilo que lleva el grupo saliente.

El estado de transición S N 2 está muy abarrotado con un total de cinco grupos alrededor del centro electrófilo, el nucleófilo, el grupo saliente y tres sustituyentes.
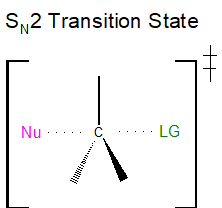
Si cada uno de los tres sustituyentes en este estado de transición fueran pequeños átomos de hidrógeno, como se ilustra en el primer ejemplo a continuación, habría poca repulsión estérica entre el nucleófilo entrante y el centro electrófilo, aumentando así la facilidad con la que la reacción de sustitución nucleofílica puede ocurrir. Recuerde, para que ocurra la reacción de SN 2, el nucleófilo debe ser capaz de solapar orbitales con el centro de carbono electrófilo, resultando en la expulsión del grupo saliente. Si uno de los hidrógenos, sin embargo, fuera reemplazado por un grupo R, como un grupo metilo o etilo, habría un incremento en la repulsión estérica con el nucleófilo entrante. Si dos de los hidrógenos fueran reemplazados por grupos R, habría un incremento aún mayor en la repulsión estérica con el nucleófilo entrante.
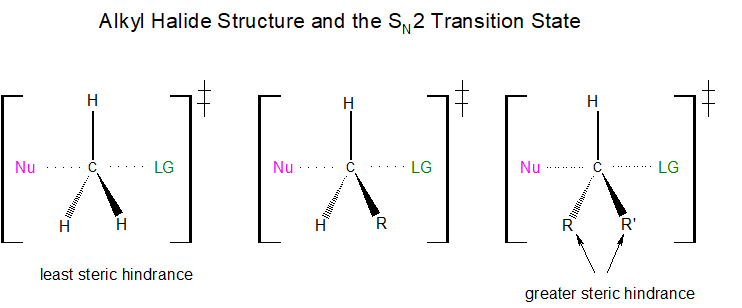
¿Cómo afecta el impedimento estérico a la velocidad a la que ocurrirá una reacción de SN 2? A medida que cada hidrógeno es reemplazado por un grupo R, la velocidad de reacción disminuye significativamente. Esto se debe a que la adición de uno o dos grupos R protege la parte posterior del carbono electrófilo impidiendo la penetración nucleofílica.
El siguiente diagrama ilustra este concepto, mostrando que los carbonos electrofílicos unidos a tres átomos de hidrógeno dan como resultado reacciones de sustitución nucleofílica más rápidas, en comparación con los haloalcanos primarios y secundarios, que dan como resultado reacciones de sustitución nucleofílica que ocurren a velocidades más lentas o mucho más lentas. respectivamente. Observe que un haloalcano terciario, aquel que tiene tres grupos R unidos, no experimenta reacciones de sustitución nucleofílica en absoluto. La adición de un tercer grupo R a esta molécula crea un carbono que está completamente bloqueado.

Sustitutos en carbonos vecinos Reacciones de Sustitución Nucleofílica Lentamente
Anteriormente aprendimos que agregar grupos R al carbono electrófilo da como resultado reacciones de sustitución nucleofílica que ocurren a una velocidad más lenta. ¿Qué pasa si los grupos R se agregan a los carbonos vecinos? Resulta que la adición de sustitutos en los carbonos vecinos también ralentizará las reacciones de sustitución nucleofílica.
En el siguiente ejemplo, el 2-metil-1-bromopropano difiere del 1-bromopropano en que tiene un grupo metilo unido al carbono que vecina al carbono electrófilo. La adición de este grupo metilo da como resultado una disminución significativa en la velocidad de una reacción de sustitución nucleofílica.

Si los grupos R se agregaran a carbonos más alejados del carbono electrófilo, aún veríamos una disminución en la velocidad de reacción. Sin embargo, la ramificación en carbonos más alejados del carbono electrófilo tendría un efecto mucho menor.
Nucleofilia
Hay tendencias periódicas predecibles en la nucleofilia. Moviéndose horizontalmente a través de la segunda fila de la tabla, la tendencia en la nucleofilia es paralela a la tendencia en basicidad:
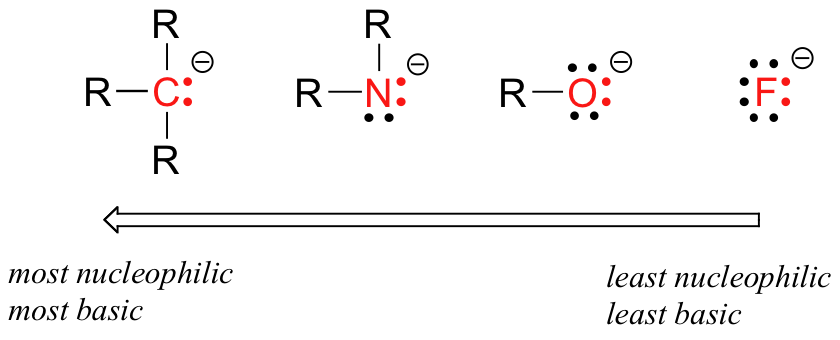
El razonamiento detrás de la tendencia de nucleofilia horizontal es el mismo que el razonamiento detrás de la tendencia de basicidad: más elementos electronegativos sujetan sus electrones con mayor fuerza, y son menos capaces de donarlos para formar un nuevo vínculo. Esta tendencia horizontal también nos dice que las aminas son más nucleofílicas que los alcoholes, aunque ambos grupos comúnmente actúan como nucleófilos tanto en reacciones de laboratorio como bioquímicas.
Recordemos que la basicidad de los átomos disminuye a medida que nos desplazamos verticalmente hacia abajo de una columna en la tabla periódica: los iones tiolato son menos básicos que los iones alcóxido, por ejemplo, y el ion bromuro es menos básico que el ion cloruro, que a su vez es menos básico que el ion fluoruro. Recordemos también que esta tendencia puede explicarse considerando el tamaño creciente de la 'nube electrónica' alrededor de los iones más grandes: la densidad electrónica inherente a la carga negativa se extiende alrededor de un área mayor, lo que tiende a aumentar la estabilidad (y así reducir la basicidad).
La tendencia periódica vertical para la nucleofilia es algo más complicada porque el solvente puede influir en la tendencia de nucleofilia en cualquier dirección. Tomemos el ejemplo simple de la reacción de S N 2 a continuación:
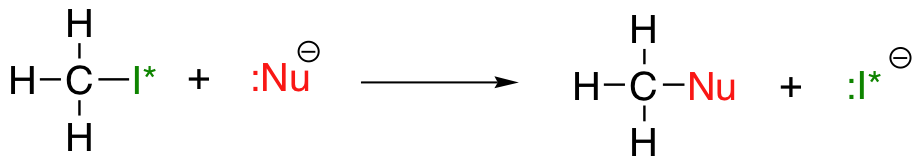
. .donde Nu - es uno de los iones haluro: fluoruro, cloruro, bromuro o yoduro, y el grupo saliente I* es un isótopo radiactivo de yodo (que permite distinguir el grupo saliente del nucleófilo cuando ambos son yoduro). Si esta reacción se produce en un disolvente prótico (es decir, un disolvente que tiene un hidrógeno unido a un oxígeno o nitrógeno - agua, metanol y etanol son los ejemplos más importantes), entonces la reacción irá más rápida cuando el yoduro es el nucleófilo, y más lenta cuando el fluoruro es el nucleófilo, reflejando la fuerza relativa del nucleófilo.
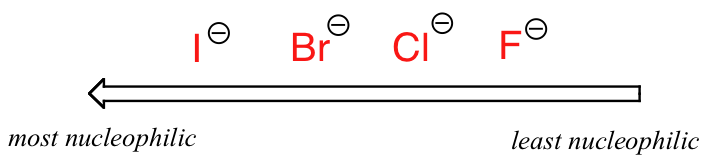
Nucleofilicidad relativa en un disolvente prótico
Esto por supuesto, es opuesto al de la tendencia periódica vertical para la basicidad, donde el yoduro es el menos básico. ¿Qué está pasando aquí? ¿No debería ser también la base más fuerte, con sus electrones de valencia no enlazados más reactivos, el nucleófilo más fuerte?
Como se mencionó anteriormente, todo tiene que ver con el solvente. Recuerde, ahora estamos hablando de la reacción que ocurre en un solvente prótico como el etanol. Las moléculas de disolvente prótico forman interacciones ión-dipolo muy fuertes con el nucleófilo cargado negativamente, creando esencialmente una 'jaula disolvente' alrededor del nucleófilo:

Para que el nucleófilo reaccione con el electrófilo, debe liberarse, al menos en parte, de su jaula de solventes. Los electrones de par solitario en el ion yoduro más grande y menos básico interactúan menos estrechamente con los protones en las moléculas de disolvente prótico, lo que resulta en una solvatación más débil, por lo que el nucleófilo yoduro es más capaz de liberarse de su jaula de solventes en comparación con el ion fluoruro más pequeño y básico, cuyo par solitario los electrones están unidos más fuertemente a los protones de la jaula de solventes.
El panorama cambia si cambiamos a un disolvente aprótico polar, como la acetona, en el que hay un dipolo molecular pero no hay hidrógenos unidos al oxígeno o al nitrógeno. Ahora bien, el fluoruro es el mejor nucleófilo, y el yoduro el más débil.
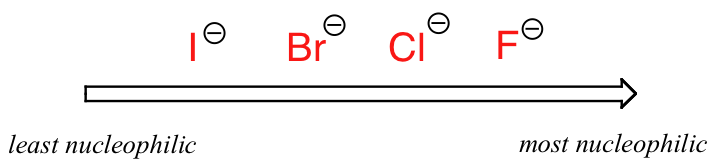
Nucleofilicidad relativa en un disolvente aprótico polar
La razón de la inversión es que, con un disolvente aprótico, las interacciones ión-dipolo entre solvente y nucleófilo son mucho más débiles: el extremo positivo del dipolo del solvente está oculto en el interior de la molécula, y así se protege de la carga negativa del nucleófilo.
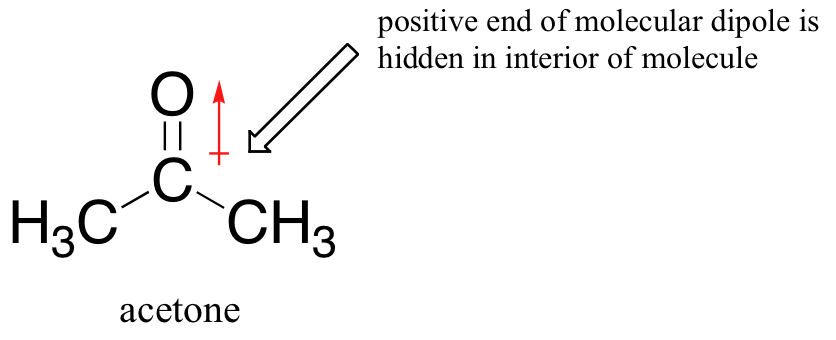
Una interacción disolvente-nucleófilo más débil significa una jaula de disolvente más débil para que el nucleófilo se rompa, por lo que el efecto solvente es mucho menos importante, y cuanto más básico es el ion fluoruro también mejor nucleófilo.
¿Por qué no usar un disolvente completamente no polar, como el hexano, para esta reacción, de manera que la jaula del disolvente se elimine por completo? La respuesta a esto es simple: el nucleófilo necesita estar en solución para reaccionar a una velocidad apreciable con el electrófilo, y un disolvente como el hexano no solvatará en absoluto un nucleófilo cargado (o altamente polar). Es por ello que los químicos utilizan disolventes apróticos polares para las reacciones de sustitución nucleofílica en el laboratorio: son lo suficientemente polares como para solvatar al nucleófilo, pero no tan polares como para encerrarlo en una jaula de disolventes impenetrable. Además de la acetona, otros tres disolventes apróticos polares de uso común son acetonitrilo, dimetilformamida (DMF) y dimetilsulfóxido (DMSO).
En la química biológica, donde el solvente es prótico (agua), la implicación más importante de las tendencias periódicas en la nucleofilia es que los tioles son nucleófilos más potentes que los alcoholes. El grupo tiol en un aminoácido de cisteína, por ejemplo, es un potente nucleófilo y a menudo actúa como nucleófilo en reacciones enzimáticas, y por supuesto los tiolatos cargados negativamente (RS -) son aún más nucleófilos. Esto no quiere decir que los grupos hidroxilo de la serina, la treonina y la tirosina no actúen también como nucleófilos, lo hacen.
Efectos de resonancia sobre la nucleofilia
Los efectos de resonancia también entran en juego al comparar la nucleofilia inherente de diferentes moléculas. El razonamiento involucrado es el mismo que el que usamos para entender los efectos de resonancia sobre la basicidad. Si el par solitario de electrones en un heteroátomo se deslocaliza por resonancia, es inherentemente menos reactivo, lo que significa menos nucleófilo y también menos básico. Un ion alcóxido, por ejemplo, es más nucleófilo y más básico que un grupo carboxilato, aunque en ambos casos el átomo nucleófilo es un oxígeno cargado negativamente. En el alcóxido, la carga negativa se localiza en un solo oxígeno, mientras que en el carboxilato la carga se deslocaliza sobre dos átomos de oxígeno por resonancia.

El átomo de nitrógeno en una amida es menos nucleófilo que el nitrógeno de una amina, debido a la estabilización por resonancia del par solitario de nitrógeno proporcionado por el grupo amida carbonilo.

El grupo de salida
Cuanto más estable es el grupo saliente, menor es la energía del estado de transición, menor es la energía de activación, más rápida es la velocidad de reacción. Evaluar la estabilidad del grupo saliente es análogo a determinar la acidez relativa evaluando la estabilidad de la base conjugada Las consideraciones son las mismas: identidad del átomo (s) y posición relativa en la tabla periódica, deslocalización de resonancia y electronegatividad. La hibridación orbital rara vez es relevante.
A medida que aumenta el tamaño, disminuye la basicidad, aumenta la estabilidad del grupo de salida: En general, si nos movemos de la parte superior de la tabla periódica a la parte inferior de la tabla periódica como se muestra en el diagrama a continuación, el tamaño de un átomo aumentará. A medida que aumenta el tamaño, la basicidad disminuirá, lo que significa que una especie tendrá menos probabilidades de actuar como base; es decir, la especie tendrá menos probabilidades de compartir sus electrones.
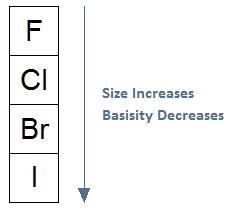
Al evaluar los halógenos como grupos salientes, la misma tendencia es significativa. El fluoruro tiene la mayor densidad de electrones y se considera el peor grupo saliente hasta el punto de no reactividad. A medida que bajan la columna, los grupos salientes tienen menor densidad de electrones y mayor estabilidad con yoduro considerado un excelente grupo saliente.

La resonancia disminuye la basicidad y aumenta la estabilidad del grupo saliente: La formación de una estructura estabilizada por resonancia deslocaliza los electrones sobre dos o más átomos disminuyendo la densidad electrónica del grupo saliente y aumenta su estabilidad. Para los haluros como grupos salientes no hay aplicaciones para esta consideración, por lo que veremos brevemente la química del carbonilo para ilustrar este efecto. Al comparar las tasas de hidrólisis de los anhidridos y ésteres, los anhidros reaccionan espontáneamente con el agua y se someten a hidrólisis para formar un ion carboxilato estabilizado por resonancia. Mientras que la hidrólisis del éster es una reacción mucho más lenta y requiere un catalizador para superar los alcóxidos como grupos salientes pobres. Los detalles de estas dos reacciones se estudiarán con mayor detalle más adelante en este texto.
A medida que aumenta la electronegatividad, disminuye la basicidad y aumenta la estabilidad del grupo de salida: En general, si nos movemos de la izquierda de la tabla periódica a la derecha de la tabla periódica como se muestra en el diagrama a continuación, aumenta la electronegatividad. A medida que aumenta la electronegatividad, la basicidad disminuirá, lo que significa que una especie tendrá menos probabilidades de actuar como base; es decir, la especie tendrá menos probabilidades de compartir sus electrones.

El siguiente diagrama ilustra este concepto, mostrando - CH 3 como el peor grupo saliente y F - ser el mejor grupo saliente. Este ejemplo en particular solo debe ser utilizado para facilitar su comprensión de este concepto. En los mecanismos de reacción reales, estos grupos no son buenos dejando grupos en absoluto. Por ejemplo, el fluoruro es un grupo saliente tan pobre que rara vez se observan reacciones de S N 2 de fluoroalcanos.
Dejar grupos a lo largo de un periodo

Efectos del disolvente en una reacción de S N 2
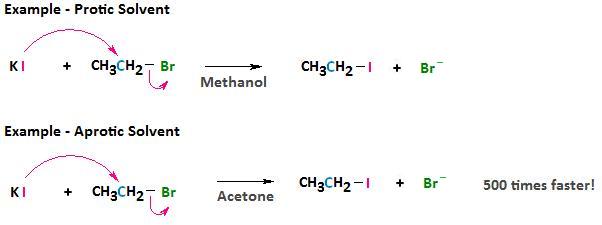
La velocidad de una reacción de S N 2 está significativamente influenciada por el disolvente en el que tiene lugar la reacción. El uso de solventes próticos (aquellos, como agua o alcoholes, con capacidad de donación de enlaces de hidrógeno) disminuye el poder del nucleófilo a través de una fuerte solvatación. Podemos ver al nucleófilo como encerrado en una jaula de solventes a través de las fuertes interacciones de enlaces de hidrógeno entre los protones del solvente y los pares solitarios reactivos en el nucleófilo. Un nucleófilo menos potente a su vez significa una reacción S N 2 más lenta.
Las reacciones de S N 2 son más rápidas en disolventes polares apróticos: aquellos que carecen de capacidad de donación de enlaces de hidrógeno. A continuación se presentan varios disolventes apróticos polares que se utilizan comúnmente en el laboratorio:
Estos disolventes apróticos son polares pero, debido a que no forman enlaces de hidrógeno con el nucleófilo aniónico, existe una interacción relativamente débil entre el disolvente aprótico y el nucleófilo. Mediante el uso de un disolvente aprótico podemos elevar la reactividad del nucleófilo. Esto a veces puede tener efectos dramáticos sobre la velocidad a la que puede ocurrir una reacción de sustitución nucleofílica. Por ejemplo, si consideramos la reacción entre bromoetano y yoduro de potasio, la reacción ocurre 500 veces más rápido en acetona que en metanol.
Ejemplo
En cada par (A y B) a continuación, ¿qué electrófilo se esperaría que reaccionara más rápidamente en una reacción de S N 2 con el grupo tiol de la cisteína como nucleófilo común?
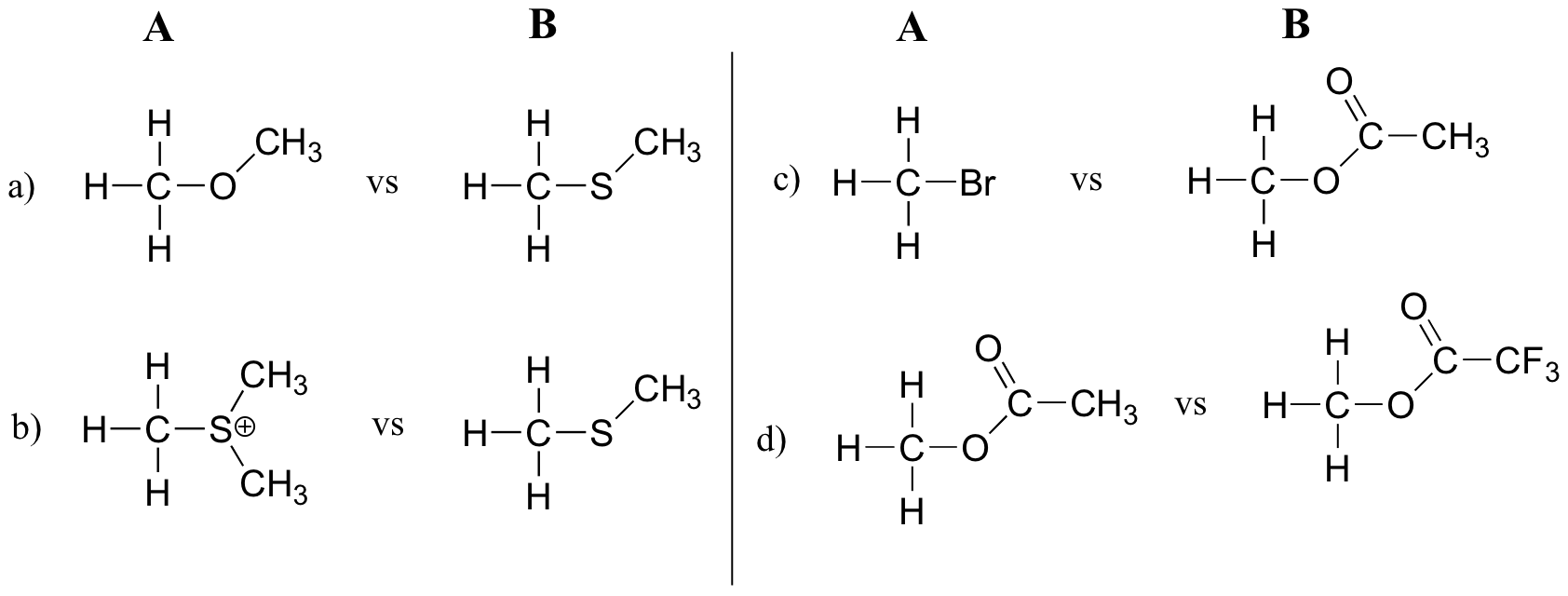
Las explicaciones para explicar las diferencias en la reactividad química necesitan discutir las diferencias estructurales y/o electrostáticas entre los reactivos
a) Cpd B b/c tiene un grupo saliente más estable.Ejercicio
1. ¿Qué producto (s) espera de la reacción del 1-bromopentano con cada uno de los siguientes reactivos en una reacción de S N 2?
a) KI
b) NaOH
c) CH 3 Cº C-Li
d) NH 3
2. ¿Cuál en los siguientes pares es un mejor nuceófilo?
a) (CH 3 CH 2) 2 N - o (CH 3 CH 2) 2 NH
b) (CH 3 CH 2) 3 N o (CH 3 CH 2) 3 B
c) H 2 O o H 2 S
3. Ordene lo siguiente para aumentar la reactividad para una reacción de S N 2.
CH 3 CH 2 Br CH 3 CH 2 OTOs (CH 3 CH 2) 3 CCl (CH 3 CH 2) 2 CHCl
4. Los disolventes benceno, éter, cloroformo son disolventes no polares y no fuertemente polares. ¿Qué efectos tienen estos disolventes en una reacción de S N 2?
- Contestar
-
1. a) a d

2.
a) (CH 3 CH 2) 2 N - ya que hay una carga presente en el nitrógeno.
b) (CH 3 CH 2) 3 N porque está presente un par solitario de electrones.
c) H 2 O ya que el oxígeno es más electronegativo.
3.
.png)
4. Disminuirán la reactividad de la reacción.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)
Jim Clark (Chemguide.co.uk)


