7.8: La Reacción S1
- Page ID
- 76229
Objetivo de aprendizaje
- determinar la ley de velocidad y predecir el mecanismo basado en su ecuación de velocidad o datos de reacción para reacciones S N 1
- predecir los productos y especificar los reactivos para reacciones de S N 1 con estereoquímica
- proponer mecanismos para reacciones de S N 1
- dibujar e interpretar Diagramas de Energía de Reacción para reacciones S N 1
El mecanismo S N 1 con Estereoquímica
Un segundo modelo para una reacción de sustitución nucleofílica se denomina mecanismo 'disociativo' o 'S N 1'. En muchos casos, el nucleófilo es el solvente, por lo que a este mecanismo también se le puede llamar “solvolisis”.
Paso 1: En el mecanismo S N 1, el carbocatión se forma cuando el enlace C-X se rompe primero, antes de que se acerque el nucleófilo
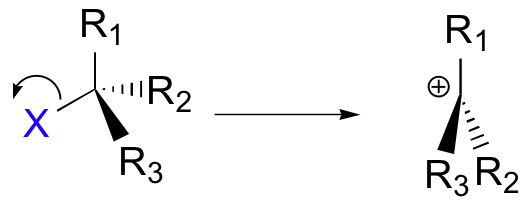
El carbocatión tiene un carbono central con solo tres enlaces y lleva una carga formal de +1. Recordemos que un carbocatión debe ser representado como sp 2 hibridado, con geometría plana trigonal. Perperpendicular al plano formado por los tres orbitales híbridos sp 2 es un orbital p vacío, no hibridado.

Paso 2: El nucleófilo reacciona con el orbital p vacío, 'hambre de electrones' del carbocatión para formar un nuevo enlace y devolver el carbono a la geometría tetraédrica. Debido a esta geometría plana trigonal, el nucleófilo puede acercarse al carbocatión desde cualquier lóbulo del orbital p vacío (también conocido como cualquiera de los lados del carbocatión). Esto significa que aproximadamente la mitad del tiempo el producto tiene la misma configuración estereoquímica que el material de partida (retención de configuración), y aproximadamente la mitad del tiempo que se ha invertido la estereoquímica. En otras palabras, la racemización del producto ocurre durante las reacciones SN1 si el carbono electrófilo es quiral. Si el intermedio de un haluro de alquilo quiral sobrevive el tiempo suficiente para encontrarse con un ambiente aleatorio, se espera que los productos sean racémicos (una mezcla 50:50 de enantiómeros). Por otro lado, si el anión haluro que sale bloquea temporalmente el lado frontal, o si un nucleófilo se orienta selectivamente en una u otra cara, entonces la sustitución podría ocurrir con inversión predominante o incluso retención de configuración.
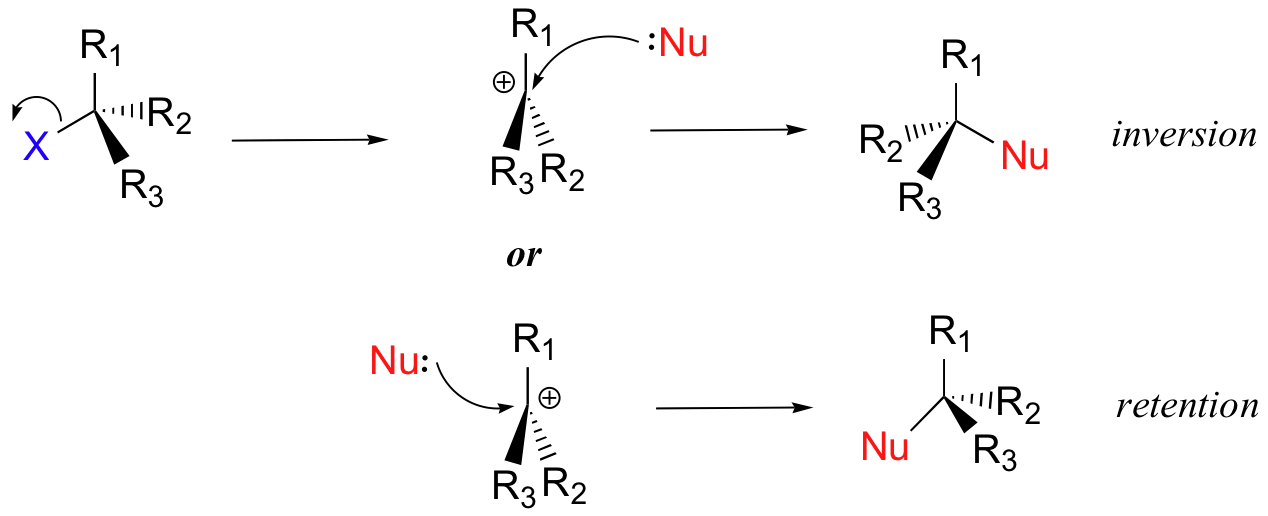
Como ejemplo, se esperaría que el bromuro de alquilo terciario a continuación, (S) -3-bromo-3-metilhexano, formara una mezcla racémica de R - y S-3-metil-3-hexanol después de una reacción de S N 1 con agua como nucleófilo.

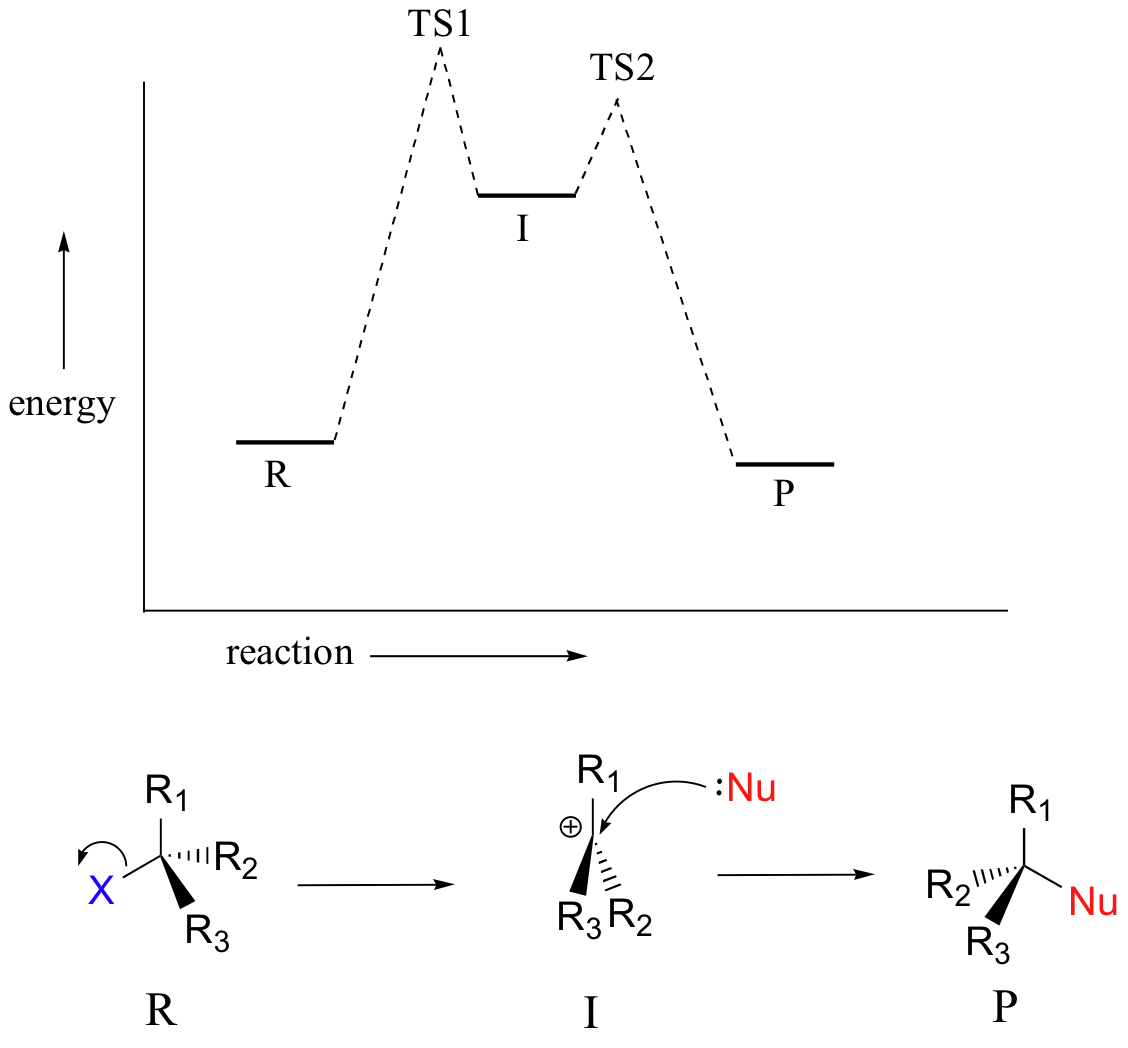
El diagrama de energía de reacción S N 1
La reacción de S N 1 es un ejemplo de una reacción de dos etapas con un intermedio de reacción. La evaluación de intermedios reactivos es una habilidad muy importante en el estudio de los mecanismos de reacción orgánica. Muchas reacciones orgánicas importantes no ocurren en un solo paso; más bien, son la suma de dos o más etapas discretas de formación de enlaces/ruptura de enlaces, e involucran especies intermedias transitorias que reaccionan muy rápidamente. En la reacción de S N 1, la especie de carbocatión es un intermedio de reacción. Un diagrama de energía potencial para una reacción de S N 1 muestra que el intermedio de carbocatión se puede visualizar como una especie de valle en la trayectoria de la reacción, mayor en energía que tanto el reactivo como el producto pero menor en energía que los dos estados de transición.