7.9: Características de la Reacción S1
- Page ID
- 76247
Objetivo de aprendizaje
- determinar la ley de velocidad y predecir el mecanismo basado en su ecuación de velocidad o datos de reacción para reacciones S N 1
- predecir los productos y especificar los reactivos para reacciones de S N 1 con estereoquímica
- proponer mecanismos para reacciones de S N 1
- dibujar e interpretar diagramas de energía de reacción para reacciones S N 1
En orden de importancia decreciente, los factores que impactan las vías de reacción de SN 1 son
- estructura del haluro de alquilo
- estabilidad del grupo de salida
- tipo de solvente.
El estado de transición unimolecular de la ruta S N 1 significa que la estructura del haluro de alquilo y la estabilidad del grupo lápida son las consideraciones principales. Los haluros de alquilo que pueden ionizarse para formar carbocationes estables son más reactivos a través del mecanismo S N 1. Debido a que la estabilidad de los carbocationes es la consideración energética principal, la estabilización del carbocatión por solvatación también es una consideración importante.
Estructura de haluro de alquilo y estabilidad de carbocationes
La cinética de primer orden de las reacciones de S N 1 sugiere un mecanismo de dos etapas en el que la etapa de determinación de la velocidad consiste en la formación de carbocationes a partir de la ionización del haluro de alquilo como se muestra en el siguiente diagrama. En este mecanismo, el carbocatión es un intermedio de alta energía que se une inmediatamente a nucleófilos cercanos. El único reactivo que está experimentando cambios en la primera etapa (determinante de la velocidad) es el haluro de alquilo, por lo que esperamos que tales reacciones sean unimoleculares y sigan una velocidad de primer orden ecuación. De ahí que se aplique el nombre S N 1 a este mecanismo.
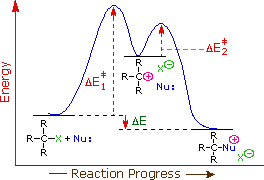
El postulado de Hammond sugiere que la energía de activación del primer paso determinante de la velocidad será inversamente proporcional a la estabilidad del carbocatión intermedio: cuanto más estable sea el carbocatión, menor sea la energía de activación, más rápida será la reactividad. Por lo tanto, la estabilidad de carbocationes es una consideración primordial en las reacciones de S N 1. Los carbocationes pueden estabilizarse deslocalizando la carga por resonancia y mediante la donación inductiva de electrones de grupos alquilo. Los carbocationes también pueden estabilizarse por reordenamiento a través de cambios de 1,2-hidruro o 1,2-metilo. Los reordenamientos de carbocationes se explican en una sección posterior de este capítulo.
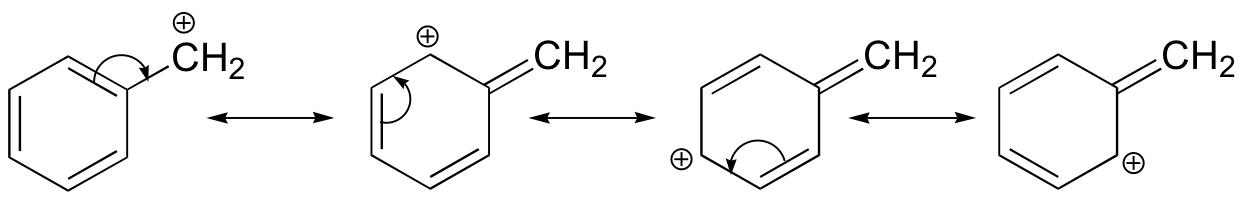
Carbocatión de bencilo
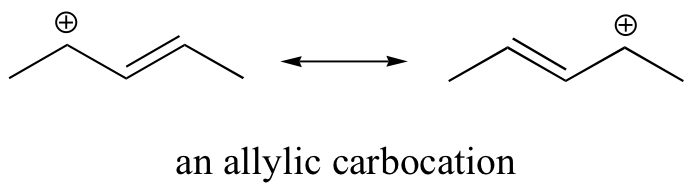
La estabilidad relativa de los carbocationes se resume a continuación.

|
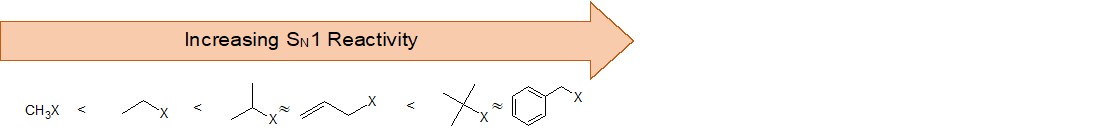
En consecuencia, esperamos que los haluros de 3º-alquilo sean más reactivos que sus homólogos 2º y 1º-en reacciones que siguen un mecanismo de S N 1. Esto es opuesto al orden de reactividad observado para el mecanismo S N 2. Los haluros alílicos y bencílicos son excepcionalmente reactivos por cualquiera de los dos mecanismos. Esta tendencia se resume en el siguiente diagrama.
Efectos del grupo de salida
Una reacción de S N 1 se acelera con un buen grupo de salida. Esto se debe a que el grupo de salida está involucrado en el paso de determinación de la tasa. Un buen grupo de salida quiere irse por lo que rompe el vínculo del Grupo C-Leaving más rápido. Una vez que se rompe el enlace, se forma el carbocatión y cuanto más rápido se forme el carbocatión, más rápido puede entrar el nucleófilo y más rápido se completará la reacción.
Un buen grupo de salida es una base débil porque las bases débiles pueden aguantar la carga. Están felices de irse con ambos electrones y para que el grupo de salida se vaya, necesita poder aceptar electrones. Bases fuertes, por otro lado, donan electrones por lo que no pueden ser buenos dejando grupos. A medida que vas de izquierda a derecha en la tabla periódica, la capacidad donadora de electrones disminuye y así aumenta la capacidad de ser un buen grupo de salida. Los haluros son un ejemplo de un buen grupo de salida cuya capacidad de grupo de salida aumenta a medida que baja la columna.
.jpg)
Las dos reacciones siguientes son la misma reacción realizada con dos grupos salientes diferentes. Uno es significativamente más rápido que el otro. Esto se debe a que el mejor grupo de salida sale más rápido y así la reacción puede proceder más rápido.
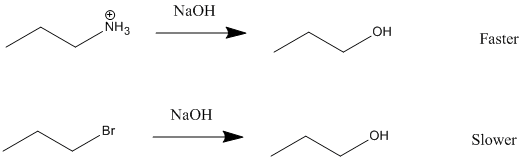
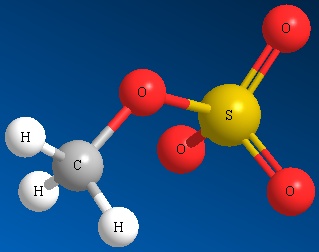
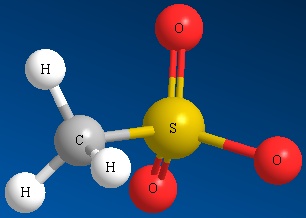
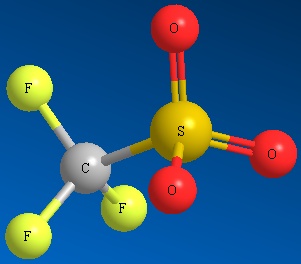
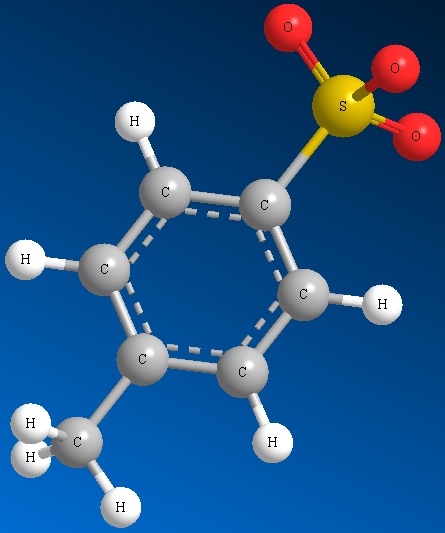
Methyl Sulfate Ion Mesilato Ion Triflato Ion Tosilato
CH 3 SO 4 2- CH 3 SO 3 2- CF 3 SO 3 2- CH 3 C 6 H 4 SO 3 2-
Efectos del Solvente en la Reacción de S N 1
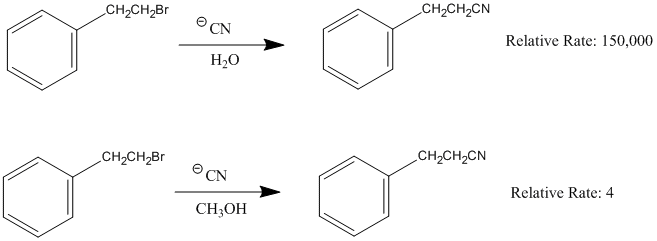
Para facilitar la separación de carga de la reacción de ionización en la primera etapa, se necesita un buen disolvente ionizante. Dos características del disolvente serán particularmente importantes: la polaridad y el poder de solvatación. La constante dieléctrica, ε, mide la polaridad de las moléculas de disolvente y su capacidad de orientarse entre iones para atenuar (reducir) la fuerza electrostática que un ion ejerce sobre el otro. T a mayor constante dieléctrica cuanto más polar es la sustancia y en el caso de las reacciones SN1, más rápida es la velocidad. Una constante dieléctrica por debajo de 15 generalmente se considera no polar. Disolventes con constantes dieléctricas altas, como agua (ε=81), ácido fórmico (ε=58), dimetilsulfóxido (ε=45) y acetonitrilo (ε=39) generalmente se consideran mejores solventes ionizantes que algunos solventes orgánicos comunes como el etanol (ε=25), acetona (ε=21), cloruro de metileno (ε=9) y éter (ε=4). A continuación se muestra la misma reacción realizada en dos disolventes diferentes. La velocidad de reacción relativa en agua (ε=81) es 150,000 veces más rápido que en metanol (ε=33) .
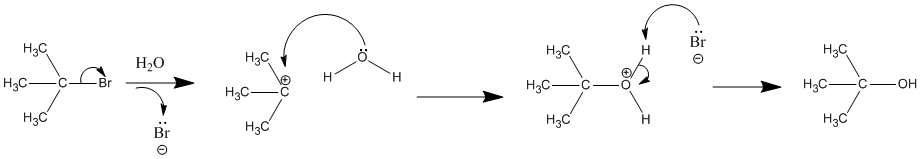
La solvatación se refiere a la capacidad del disolvente para estabilizar iones encerrándolos en una envoltura de moléculas de disolvente débilmente unidas. Los aniones son solvatados por cargas positivas parciales de disolventes de enlace de hidrógeno. Los cationes suelen ser mejor solvatados por los sitios nucleofílicos en una molécula de disolvente (por ejemplo, átomos de oxígeno y nitrógeno). La interacción de los carbocationes con estos disolventes nucleofílicos puede ser lo suficientemente fuerte como para formar enlaces covalentes al carbono, convirtiendo así el intermedio en un producto de sustitución y creando el nombre de reacción “solvolisis”. Cuando ocurre solvolisis con agua, las acciones se denominan “reacciones de hidrólisis” como se muestra en la reacción a continuación.
Solventes polares próticos y polares apróticos
Los solventes próticos contienen hidrógeno polarizado. Mientras que, los solventes apróticos NO contienen hidrógeno polarizado. Para las reacciones de S N 2, la solvatación del nucleófilo por solventes próticos polares ralentiza la velocidad de reacción. Sin embargo, en la reacción de S N 1 el nucleófilo no forma parte del paso determinante de la velocidad por lo que esta preocupación no es relevante. De hecho, los solventes próticos polares realmente aceleran la velocidad de reacciones de S N 1 porque el disolvente polar ayuda a estabilizar el estado de transición y el intermedio de carbocatión. Dado que el carbocatión es inestable, cualquier cosa que pueda estabilizar esto incluso un poco acelerará la reacción. Los solventes apróticos polares tienen un momento dipolar, pero su hidrógeno no está altamente polarizado. Los disolventes apróticos polares no se utilizan en las reacciones de S N 1 porque algunos de ellos pueden reaccionar con el intermedio de carbocatión y dar un producto secundario no deseado. Más bien, los disolventes próticos polares son los preferidos para las reacciones de sustitución unimolecular.
Efectos del Nucleófilo
La fuerza del nucleófilo no afecta la velocidad de reacción de S N 1 debido a que el nucleófilo no está involucrado en la etapa de determinación de la velocidad. Dado que los nucleófilos solo participan en el segundo paso rápido, sus concentraciones molares relativas y no sus nucleofilicidades deberían ser el principal factor determinante del producto. Si se usa un disolvente nucleófilo como el agua, su alta concentración asegurará que los alcoholes sean el producto principal. Sin embargo, si tienes más de un nucleófilo compitiendo por enlazarse al carbocatión, las fuerzas y concentraciones de esos nucleófilos afectan la distribución de los productos. Por ejemplo, si el cloruro de t-butilo reacciona con una mezcla de agua y ácido fórmico donde el agua y el ácido fórmico son nucleófilos competidores, se forman dos productos diferentes: (CH 3) 3 COH y (CH 3) 3 COCOH. Los rendimientos relativos de estos productos dependen de las concentraciones y reactividades relativas de los nucleófilos. Con una mayor densidad de electrones, el agua se considera el nucleófilo más fuerte y el alcohol terciario será el producto principal si hay concentraciones iguales de nucleófilos competidores.
Ejercicios
1. Clasificar lo siguiente aumentando la reactividad en una reacción de S N 1.

2. 3-bromo-1-penteno y 1-bromo-2-penteno experimentan reacción de S N 1 a casi la misma velocidad, pero uno es un haluro secundario mientras que el otro es un haluro primario. Explique por qué es esto.
3. Marcar las siguientes reacciones como las más probables que ocurren por un mecanismo S N 1 o S N 2. Sugerir por qué.
.png)
- RESPUESTAS
-
1. Considerar la estabilidad del intermedio, el carbocatión.
A < D < B < C (más reactivo)
2. Tienen los mismos intermedios cuando miras las formas de resonancia.
.png)
3. A — S N 1 *grupo saliente pobre, disolvente prótico, intermedio de catión secundario
B — S N 2 *buen grupo de salida, disolvente polar, posición primaria.



