8.6: Estabilidad de Alquenos
- Page ID
- 76983
Objetivo de aprendizaje
- usar calores de hidrogenación para comparar las estabilidades de los alquenos
Calores de Hidrogenación
La estabilidad de un alqueno se puede determinar midiendo la cantidad de energía asociada a la hidrogenación de la molécula. Dado que el doble enlace se está rompiendo en esta reacción, la energía liberada en la hidrogenación es proporcional a la energía en el doble enlace de la molécula. Esta es una herramienta útil porque los calores de hidrogenación se pueden medir con mucha precisión. El\(\Delta H^o\) suele ser alrededor de -30 kcal/mol para los alquenos. La estabilidad es simplemente una medida de energía. Las moléculas de menor energía son más estables que las moléculas de mayor energía. Más alquenos sustituidos son más estables que los menos sustituidos debido a la hiperconjugación. Tienen un menor calor de hidrogenación. Lo siguiente ilustra la estabilidad de alquenos con diversos sustituyentes:
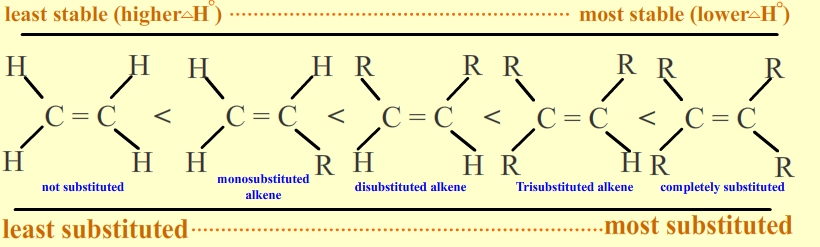
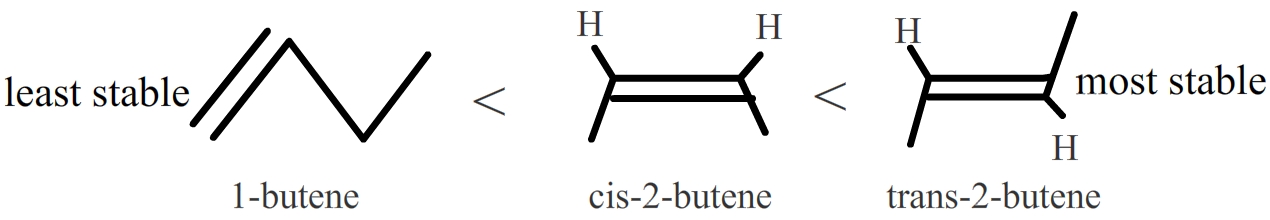
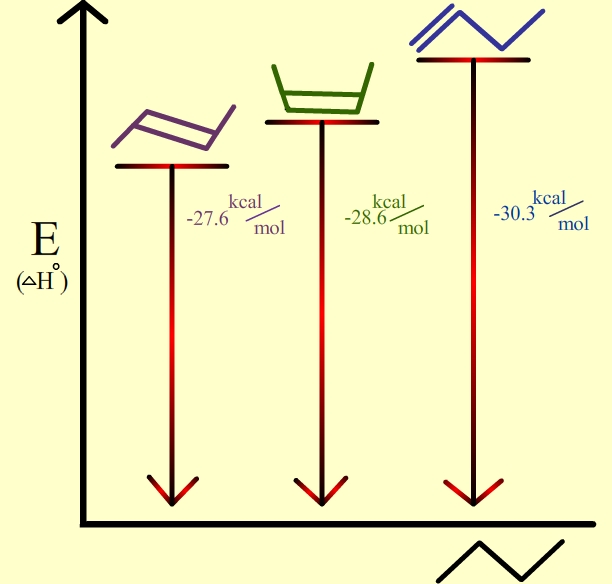
En los alquenos disustituidos, los isómeros trans son más estables que los isómeros cis debido al impedimento estérico. Además, los alquenos internos son más estables que los terminales. Ver los siguientes isómeros de buteno:
En cicloalquenos más pequeños que el cicloocteno, los isómeros cis son más estables que los trans como resultado de la cepa de anillo.
Ejercicios
- Al mirar sus calores de hidrogenación, ¿es generalmente más estable el isómero cis o trans?
- Organizar los siguientes alquenos en orden de estabilidad creciente: 2,3-dimetil-2-buteno; trans-2-hexeno; 2-metil-2-penteno; cis-2-hexeno
- ¿Cuál es el alqueno más estable en cada par?

- Contestar
-
1. Los alquenos trans son más estables como lo demuestran los calores más bajos de hidrogenación en comparación con sus isómeros cis.
2. (menos sustituido y cis) cis-2-hexeno < trans-2-hexeno < 2-metil-2-penteno < 2,3-dimetil-2-buteno (más sustituido)
3. A) 2 b/c trans con la misma sustitución en C=C B) 1 b/c el C=C está más sustituido
Referencias
- Fox, Marye Anne y James K. Whitesell. Química Orgánica. 3ª ed. Sudbury, MA: Janes y Bartlett Publishers, 2004.
- Hanson, James R. Grupo Funcional Química. Bristol, Reino Unido: The Royal Society of Chemistry, 2001.
- Streitwieser, Andrew Jr., y Clayton H. Heathcock. Introducción a la Química Orgánica. 2a ed. Nueva York, NY: Macmillan Publishing Co., Inc., 1981.
- Vollhardt, Peter C. y Neil E. Schore. Química Orgánica: Estructura y Función. 5ta ed. Nueva York, NY: W.H. Freeman and Company, 2007.
- Zlatkis, Albert, Eberhard Breitmaier y Gunther Jung. Una Introducción Concisa a la Química Orgánica. Nueva York: McGraw-Hill Book Company, 1973.
Colaboradores y Atribuciones
- Anna Manis (UCD)
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)

