8.8: Síntesis de alquenos por deshidratación de alcoholes
- Page ID
- 76973
Objetivo de aprendizaje
- interpretar y dibujar diagramas de energía de reacción para reacciones de deshidratación de alcohol
- proponer mecanismos para reacciones de deshidratación
- predecir los productos y especificar los reactivos para la síntesis de alquenos a partir de reacciones de deshidratación de alcohol
- predecir y explicar la estereoquímica de las eliminaciones de E2 para formar alquenos, especialmente a partir de ciclohexanos
Deshidratación de alcoholes para producir alquenos
Una forma de sintetizar alquenos es por deshidratación de alcoholes. Los alcoholes se someten a mecanismos E1 o E2 para perder agua y formar un doble enlace. Este mecanismo es análogo al mecanismo de haluro de alquilo. La única diferencia es que el hidróxido es un grupo de salida muy pobre por lo que se requiere un paso extra. El grupo hidroxilo está protonado de manera que el agua es ahora el grupo lábil. Por lo tanto, la reacción de deshidratación de alcoholes para generar alqueno procede calentando los alcoholes en presencia de un ácido fuerte, como el ácido sulfúrico o fosfórico, a altas temperaturas.
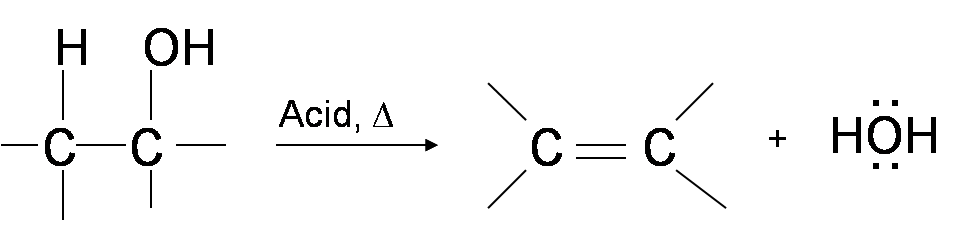
El intervalo de temperatura de reacción requerido disminuye con el aumento de la sustitución del carbono que contiene hidroxi:
- Alcoholes 1°: 170° - 180°C
- 2° alcoholes: 100°— 140 °C
- 3° alcoholes: 25°— 80°C
Si la reacción no se calienta suficientemente, los alcoholes no se deshidratan para formar alquenos, sino que reaccionan entre sí para formar éteres (por ejemplo, la Síntesis de Éter de Williamson).

Mecanismo para la Deshidratación de Alcoholes
Diferentes tipos de alcoholes pueden deshidratarse a través de una vía de mecanismo ligeramente diferente. Sin embargo, la idea general detrás de cada reacción de deshidratación es que el grupo —OH en el alcohol dona dos electrones a H + del reactivo ácido para formar un ion alquiloxonio. Este ion actúa como un grupo de salida muy bueno para el mecanismo E1 o E2. El ácido desprotonado (la base conjugada) reacciona entonces con uno de los beta-hidrógenos para formar un doble enlace.
Alcoholes Primarios y el Mecanismo E2
Los alcoholes primarios se someten a eliminación bimolecular (mecanismo E2) mientras que los alcoholes secundarios y terciarios experimentan eliminación unimolecular (mecanismo E1). La reactividad relativa de los alcoholes en la reacción de deshidratación se clasifica como la siguiente
Metanol < primario < secundario < terciario
El alcohol primario se deshidrata a través del mecanismo E2. El oxígeno dona dos electrones a un protón a partir del ácido sulfúrico H 2 SO 4, formando un ion alquiloxonio. La base conjugada resultante (HSO 4 —) se aproxima en una orientación anticoplanar relativa al grupo lábil y reacciona con un hidrógeno adyacente mientras que el ion alquiloxonio sale simultáneamente en un proceso concertado, formando un doble enlace.

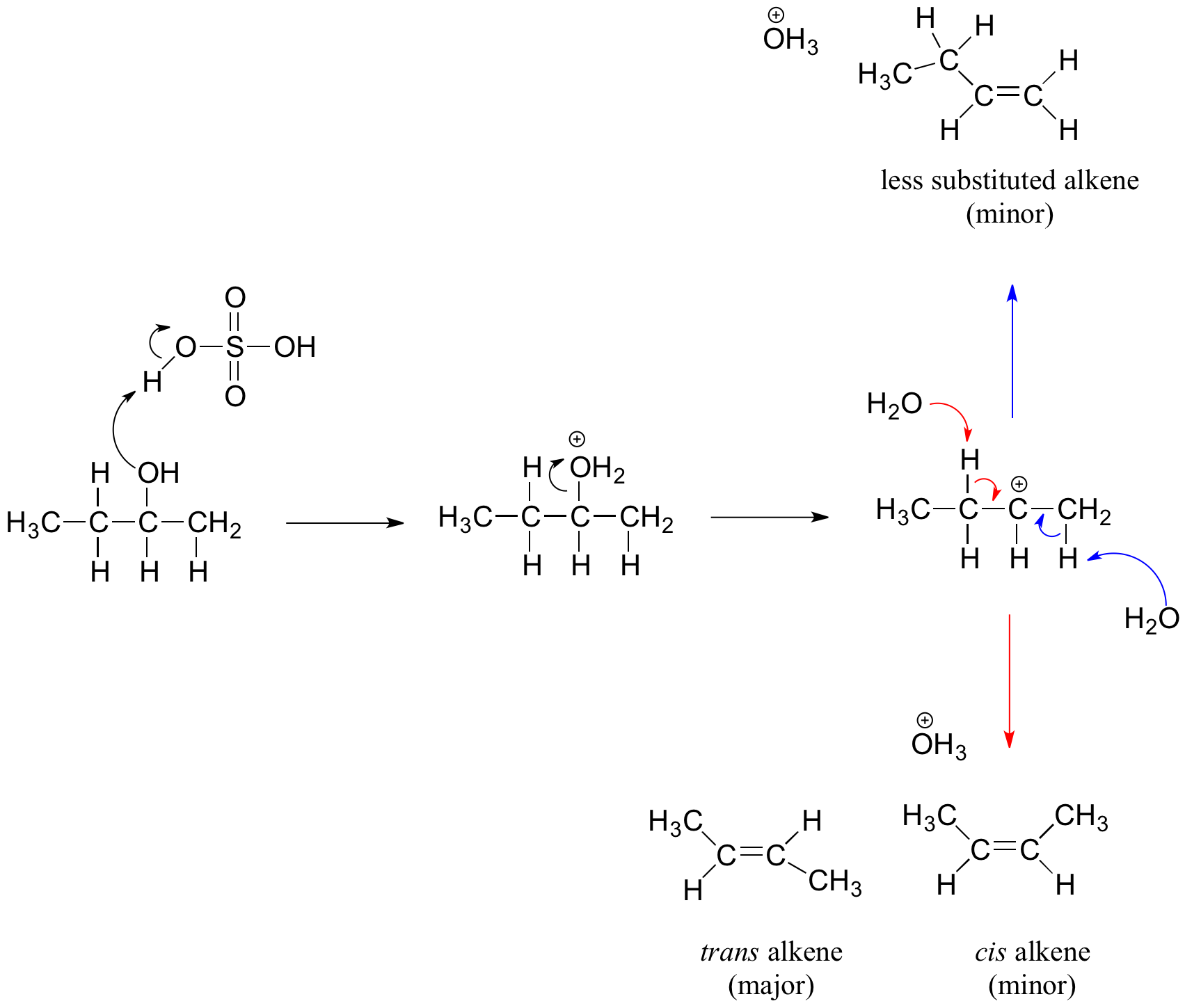
Alcoholes Secundarios y Terciarios y el Mecanismo E1
Los alcoholes secundarios y terciarios se deshidratan a través del mecanismo E1. De manera similar a la reacción anterior, secundario y terciario —OH protonato para formar iones alquiloxonio. Sin embargo, el ion sale primero y forma un carbocatión como intermedio de reacción. La molécula de agua (que es una base más fuerte que el ion HSO 4 -) luego abstrae un protón de un carbono adyacente, formando un doble enlace.
Por ejemplo, en el mecanismo de abajo que el alqueno formado depende de qué protón se abstrae: las flechas rojas muestran la formación del 2-buteno más sustituido, mientras que las flechas azules muestran la formación del 1-buteno menos sustituido. Recordemos la regla general de que más alquenos sustituidos son más estables que los alquenos menos sustituidos, y los alquenos trans son más estables que los alquenos cis. Por lo tanto, el diastereómero trans del producto 2-buteno es más abundante.
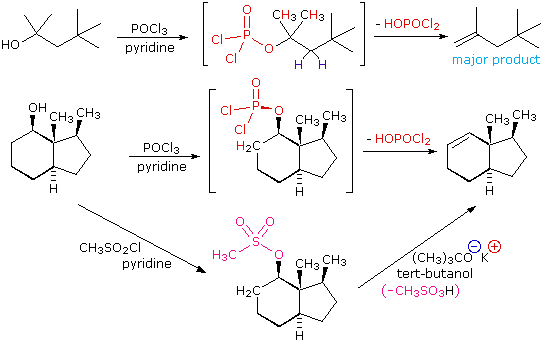
El mecanismo de deshidratación para un alcohol terciario es análogo al mostrado anteriormente para un alcohol secundario. La eliminación E2 de 3º-alcoholes en condiciones relativamente no ácidas se puede lograr mediante el tratamiento con oxicloruro de fósforo (POCl 3) en piridina. Este procedimiento también es efectivo con alcoholes 2º-impedidos, pero para los alcoholes no obstaculizados y 1º-alcoholes una sustitución de iones cloruro S N 2 del intermedio clorofosfato compite con la eliminación. Ejemplos de estas y reacciones relacionadas se dan en la siguiente figura. La primera ecuación muestra la deshidratación de un 3º-alcohol. El predominio del producto no Zaitsev (doble enlace menos sustituido) se presume debido al impedimento estérico de los átomos de hidrógeno del grupo metileno, lo que interfiere con la aproximación de la base en ese sitio. El segundo ejemplo muestra dos procedimientos de eliminación aplicados al mismo 2º-alcohol. El primero utiliza el método PoCl 3 de un solo paso, que funciona bien en este caso porque la sustitución de S N 2 es retardada por impedimento estérico. El segundo método es otro ejemplo en el que un éster sulfonato intermedio confiere reactividad de tipo halógeno a un alcohol. En todos los casos el grupo eliminable aniónico es la base conjugada de un ácido fuerte.
Reordenamientos de Carbocationes y Mecanismo E1
La estabilidad de los carbocationes es siempre una fuerza impulsora en los mecanismos E1. Es importante evaluar la estructura de todos los intermedios de carbocationes para buscar la posibilidad de cambios de 1,2-hidruro o 1,2-metilo para formar intermedios de carbocationes más estables. Los reordenamientos de carbocationes se discuten más completamente en el capítulo 7.
Ejercicio
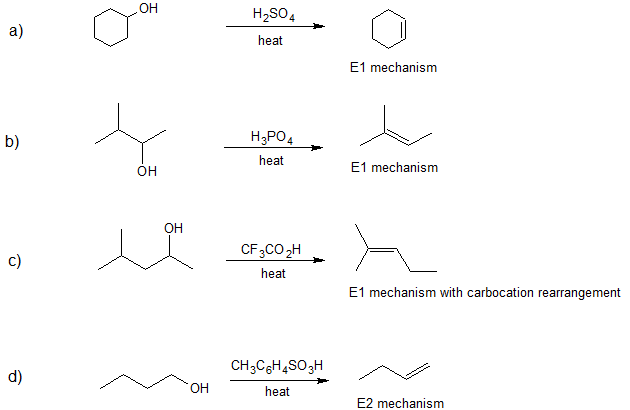
1. Dibuje la (s) estructura (es) de línea de unión para el/los producto (s) formado (s) y especifique el mecanismo (E1 o E2) para cada reacción a continuación.
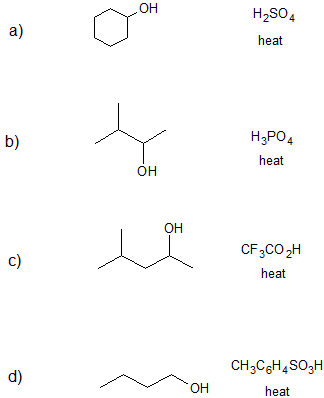
- Responder
-
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry

