9.6: Hidratación - Hidroboración-Oxidación
- Page ID
- 75925
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivos de aprendizaje
- aplicar los principios de regioselectividad y estereoselectividad a las reacciones de adición de alquenos
- predecir los productos, especificar los reactivos y discernir la reacción más eficiente para la hidratación de alquenos (hidratación catalizada por ácido; u oximercuración/desmercura; o hidroboración/oxidación)
La hidroboración-oxidación es una vía de dos pasos utilizada para producir alcoholes. La reacción procede de manera anti-Markovnikov, donde el hidrógeno (de\(\ce{BH3}\) o\(\ce{BHR2}\)) se une al carbono más sustituido y el boro se une al carbono menos sustituido en el doble enlace alqueno. Además, el borano actúa como electrófilo aceptando dos electrones en su orbital p vacío de un alqueno rico en electrones. Este proceso permite que el boro tenga un octeto de electrones. Una característica muy interesante de este proceso es que no requiere ninguna activación por parte de un catalizador. El mecanismo de hidroboración tiene los elementos tanto de hidrogenación como de adición electrófila y es un estereoespecífico (adición sin), lo que significa que la hidroboración tiene lugar en la misma cara del doble enlace, esto conduce a la estereoquímica cis.
El Complejo Borane
Es muy importante entender la estructura y propiedades de la molécula de borano. El borano existe naturalmente como un gas muy tóxico y existe como dímero de fórmula general\(\ce{B2H6}\) (diborano).
\[\ce{BH3→B2H6} \nonumber\]
Dado que el dímero de diborano se enciende espontáneamente en el aire, se distribuye comercialmente en soluciones de éter o tetrahidrofurano (THF). En estas soluciones, el borano puede existir como un complejo ácido-base de Lewis que permite que el boro tenga un octeto de electrones.

El Mecanismo
Paso #1: Hidroboración del alqueno
La adición del borano al alqueno se inicia y procede como una reacción concertada porque la ruptura del enlace y la formación de enlaces ocurren al mismo tiempo. El orbital 2p vacío del boro toma el papel de electrófilo y acepta los electrones pi del alqueno nucleofílico. El boro se suma al carbono menos sustituido del alqueno, que luego coloca el hidrógeno en el carbono más sustituido. Ambos, el boro y el hidrógeno se agregan simultáneamente en la misma cara del doble enlace (adición sin). Con un mecanismo concertado, no hay formación de carbocationes.

Estado de transición
.bmp)
* Tenga en cuenta que no se forma un carbocatión. Por lo tanto, no se lleva a cabo ningún reordenamiento.

Es importante señalar que la reacción continúa dos veces más hasta que los tres hidrógenos del borano han reaccionado con alquenos para crear el trialquilborano intermedio R3B.
Paso #2: Oxidación del Trialquilborano por Peróxido de Hidrógeno
El peróxido de hidrógeno (\(\ce{HOOH}\)) es el nucleófilo en esta reacción porque es el donador de electrones al trialquilborano recién formado que resultó de la hidroboración previa.
\[\ce{HOOH + OH^{-} -> HOO^{-} + HOH}\]
.bmp)
En esta segunda parte del mecanismo, un reordenamiento de un grupo R con su par de electrones de unión a un oxígeno adyacente da como resultado la pérdida de un ion hidróxido.
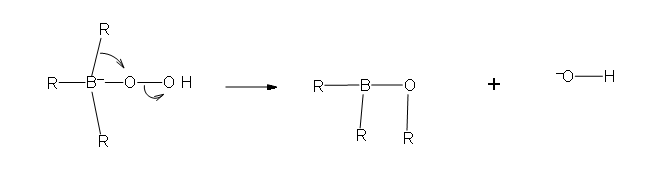
Dos más de estas reacciones con hidroperóxido ocurrirán para dar un trialquilborato

En la etapa final del proceso de oxidación, el trialquilborato reacciona con acuoso\(\ce{NaOH}\) para dar el alcohol y el borato de sodio (\ ce {Na3bO3}\).
\[\ce{(RO3)B + 3NaOH -> 3OH + Na3BO3}\]
Si necesita imágenes adicionales que le ayuden a comprender el mecanismo, haga clic en los enlaces externos proporcionados al final de esta sección.
Estereoquímica de la Etapa de Hidroboración
La reacción de hidroboración se encuentra entre las pocas reacciones de adición simples que proceden limpiamente de manera syn. Como se señaló anteriormente, esta es una reacción de una sola etapa. Dado que la unión de los carbonos de doble enlace al boro y al hidrógeno es concertada, se deduce que la geometría de esta adición debe ser syn. Además, los reordenamientos son improbables en la medida en que nunca se forma un intermedio de carbocatión discreto. Estas características se ilustran para la hidroboración de α-pineno.
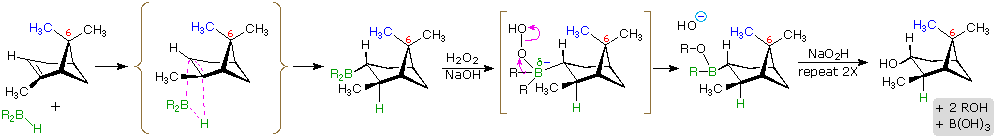
Dado que el procedimiento de hidroboración se usa más comúnmente para hidratar alquenos de manera anti-Markovnikov, también necesitamos conocer la estereoselectividad de la segunda reacción de oxidación, que sustituye un grupo hidroxilo por el átomo de boro. Un estudio independiente ha demostrado que esta reacción se lleva a cabo con retención de configuración por lo que la adición global de agua también es syn.
La hidroboración de α-pineno también proporciona un buen ejemplo de control de obstáculos estéricos en una reacción química. En los alquenos menos complejos utilizados en ejemplos anteriores, el plano del doble enlace era a menudo un plano de simetría, y los reactivos de adición podían acercarse con igual facilidad desde cualquier lado. En este caso, uno de los grupos metilo unidos a C-6 (de color azul en la ecuación) cubre una cara del doble enlace, bloqueando cualquier aproximación desde ese lado. Por lo tanto, todos los reactivos que se suman a este doble enlace deben acercarse desde el lado opuesto a este metilo.
Ejercicios
1. Dibujar la estructura de línea de unión del producto (s) para estas siguientes reacciones?
a)

b)
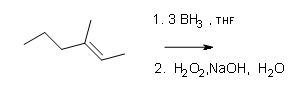
c)

2. Dibujar las fórmulas estructurales para los alcoholes que resultan de la hidroboración-oxidación de los alquenos mostrados.
a)

b) (E) -3-metil-2-penteno
3. Escriba los reactivos o productos (A—D) mostrados en los siguientes esquemas de reacción.

- Contestar
-
1.
a)
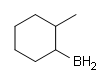
b)

c)

2.
a)

b)

3.
Referencias
- Vollhardt, Peter y Neil Shore. Química Orgánica: Estructura y Función. 5to. Nueva York: W.H. Freeman and Company, 2007.
- Foote, S. Christopher y William H. Brown. Química Orgánica. 5to. Belmont, CA: Brooks/Cole Cengage Learning, 2005.
- Bruice, Paula Yurkanis. Química Orágnica. 5to. CA. Prentice Hall, 2006.
- Bergbreiter E. David, y David P. Rainville. Estereoquímica de la hidroboración-oxidación de alquenos terminales. J. Org. Chem., 1976, 41 (18), pp 3031—3033
- Ilich, Predrag-Peter; Rickertsen, Lucas S., y Becker Erienne. Adición Polar al Grupo C=C: ¿Por qué la Hidroboración-Oxidación de Alquenos Anti-Markovnikov no es “Anti-”? Revista de Educación Química., 2006, v83, n11, pg 1681-1685
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)
Jim Clark (Chemguide.co.uk)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry


