10.8: Acidez de alquinos terminales e iones acetilidos
- Page ID
- 75973
Objetivos de aprendizaje
- explicar por qué los alquinos son más ácidos que los alcanos y alquenos
- predecir los productos y especificar los reactivos para generar iones acetiluro nucleofílicos y acetiluros de metales pesados
Acidez de alquinos terminales y formación de iones acetiluros
Los alquinos terminales son mucho más ácidos que la mayoría de los demás hidrocarburos. La eliminación del protón conduce a la formación de un anión acetiluro, RC = C: -. El origen de la acidez mejorada se puede atribuir a la estabilidad del anión acetiluro, que tiene los electrones desapareados en un orbital hibridado sp. La estabilidad resulta de ocupar una órbita con un alto grado de carácter s-orbital. Existe una fuerte correlación entre el carácter s en el orbital que contiene los electrones no enlazantes en el anión y la acidez de los hidrocarburos. La acidez mejorada con mayor carácter s ocurre a pesar de que el BDE C-H homolítico es mayor.
| Compuesto | Base Conjugada | Hibridación | “s Carácter” | pKa | C-H BDE (kJ/mol) |
|---|---|---|---|---|---|
| CH 3 CH 3 | CH 3 CH 2 - | sp 3 | 25% | 50 | 410 |
| CH 2 CH 2 | CH 2 CH - | sp 2 | 33% | 44 | 473 |
| HCCH | CHC - | sp | 50% | 25 | 523 |
En consecuencia, los aniones acetiluro pueden formarse fácilmente por desprotonación usando una base suficientemente fuerte. El anión amida (NH 2 -), en forma de NaNH 2 se usa comúnmente para la formación de aniones acetiluro.
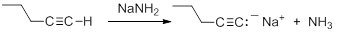
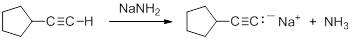
Ejercicio
- Dado que el p K a de agua es 14.00, ¿esperaría que el ion hidróxido sea capaz de eliminar un protón de cada una de las sustancias que se enumeran a continuación? Justifica tus respuestas, brevemente.
- etanol (p K a = 16)
- ácido acético (p K a = 4.72)
- acetileno (p K a = 25)
- Responder
-
Respuestas:
1.
- No, El p K a del etanol es similar al pKa del agua por lo que el intercambio de protones es comparable tanto para la protonación como para la desprotonación entre alcoholes y agua. Los alcoholes pueden considerarse “agua alquilada” y comparten muchas similitudes tanto en las propiedades físicas como en la reactividad química.
- Sí, muy bien. Hay una diferencia de 11 p K a unidades entre la p K a de agua y la p K a de ácido acético. El equilibrio se encuentra bien a la derecha con el acetato como forma predominante del ácido acético original.
- No, apenas en absoluto. El ion hidróxido es una base demasiado débil para eliminar un protón del acetileno. El equilibrio se encuentra hasta el momento a la izquierda que se considera una “No Reacción”.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry

