16.3: Adiciones electrofílicas a dienos conjugados
- Page ID
- 76063
OBJETIVO
- Después de completar esta sección, deberías poder
- escribir una ecuación para la adición de uno o dos equivalentes molares de un halógeno o un haluro de hidrógeno a un dieno no conjugado.
- escribir una ecuación para la adición de uno o dos equivalentes molares de un halógeno o un haluro de hidrógeno a un dieno conjugado.
- escribir el mecanismo para la adición de un equivalente molar de haluro de hidrógeno a un dieno conjugado, y por lo tanto dar cuenta de la formación de productos de adición 1,2 y 1,4.
- explicar la estabilidad de los carbocationes alílicos en términos de resonancia.
- dibujar los contribuyentes de resonancia para un carbocatión alílico dado.
- predecir los productos formados a partir de la reacción de un dieno conjugado dado con un equivalente molar de halógeno o haluro de hidrógeno.
- predecir cuál de los posibles productos de adición 1,2 y 1,4 probablemente predominará cuando se hace reaccionar un equivalente molar de un haluro de hidrógeno con un dieno conjugado dado.
- utilizar el concepto de estabilidad de carbocationes para explicar la relación de los productos obtenidos cuando un dieno conjugado dado reacciona con un equivalente molar de haluro de hidrógeno.
TERMINOS CLAVE
- Cerciórese de que puede definir, y usar en contexto, los términos clave a continuación.
- 1,2-adición
- 1,4-adición
NOTAS DE ESTUDIO
Observe que los números utilizados en las expresiones 1,2-adición y 1,4-adición no se refieren a las posiciones de los átomos de carbono en la molécula de dieno. Aquí, 1,2 indica dos átomos de carbono vecinos, mientras que 1,4 indica dos átomos de carbono que están separados en la cadena de carbono por dos átomos de carbono adicionales. Así, en las adiciones 1,2 y 1,4-al 2,4-hexadieno, las adiciones realmente ocurren en los carbonos 2 y 3, y 2 y 5, respectivamente.
El término “monoaducto” debe interpretarse en el sentido del producto o productos formados cuando un mol de reactivo se añade a un mol de sustrato. En los objetivos anteriores, este proceso se denomina la adición de un equivalente molar (o un equiv mol).
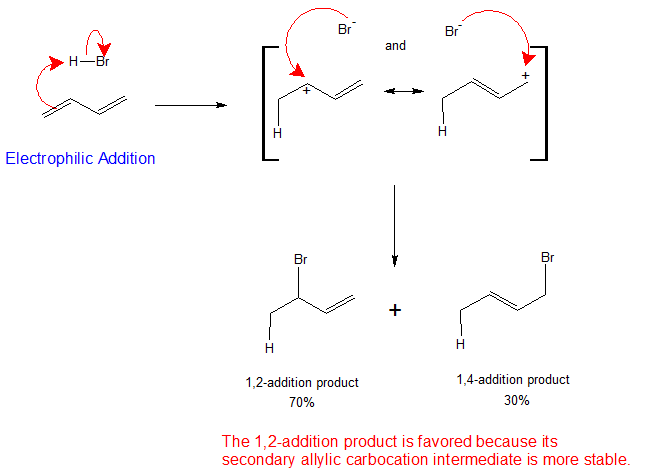
En la Sección 7.9 vimos que la adición electrófila a un alqueno simple seguiría la regla de Markovnikov, donde la estabilidad del carbocatión intermedio aumentaría: primario < secundario < terciario. Con dienos conjugados, el carbocatión alílico generado de manera intermedia tiene diferentes formas de resonancia. El siguiente esquema representa el mecanismo para la adición de HBr a 1,3-butadieno (a 0°C). Tenga en cuenta los contribuyentes de resonancia para el intermedio de carbocatión alílico y que el producto resultante del catión secundario se genera con mayor rendimiento que del catión primario como podría esperar de nuestras discusiones hasta ahora. Sin embargo, en la siguiente sección verá que la relación de producto resultante puede verse drásticamente afectada por una serie de condiciones de reacción, incluida la temperatura.
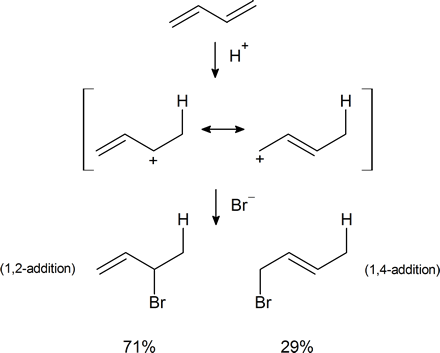
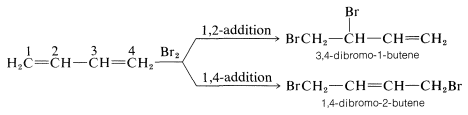
Las reacciones de 1,3-butadieno son razonablemente típicas de los dienos conjugados. El compuesto sufre las reacciones habituales de alquenos, como hidrogenación catalítica o adiciones radicales y polares, pero lo hace más fácilmente que la mayoría de los alquenos o dienos que tienen dobles enlaces aislados. Además, los productos frecuentemente son los de adición 1,2 y 1,4:

La formación de productos de adición 1,2 y 1,4 ocurre no solo con halógenos, sino también con otros electrófilos como los haluros de hidrógeno. El curso mecanicista de la reacción del 1,3-butadieno con cloruro de hidrógeno se muestra en la Ecuación 13-1. El primer paso, como ocurre con los alquenos, es la formación de un carbocatión. Sin embargo, con 1,3-butadieno, si el protón se agrega a C1C1 (pero no a C2C2), el catión resultante tiene una energía de deslocalización sustancial, con la carga distribuida sobre dos carbonos (revise las Secciones 6-5 y 6-5C si esto no es claro para usted). El ataque de ClCl' como nucleófilo en uno u otro de los carbonos positivos produce el producto de adición 1,2 o 1,4:

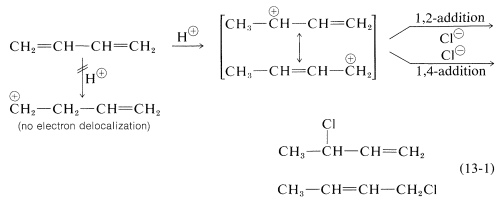
Una característica importante de las reacciones en las que las adiciones 1,2 y 1,4 ocurren en competencia entre sí es que la relación de los productos puede depender de la temperatura, el disolvente, y también del tiempo total de reacción.
Adición directa vs conjugada
La descripción de la adición directa versus conjugada utiliza números localizados dentro del sistema conjugado y no tienen nada que ver con el sistema de numeración utilizado para determinar el nombre de la IUPAC para un dieno conjugado. Las reacciones de 1,3-butadieno son razonablemente típicas de dienos conjugados e ilustran la diferencia en el sistema de numeración para describir la reacción frente a los números de nomenclatura IUPAC.


Mecanismo para la Adición Electrofílica a Dienos Conjugados
El siguiente mecanismo explica la formación y distribución de productos de adición a dienos conjugados usando 1,3-butadieno como ejemplo. El primer paso, como ocurre con los alquenos aislados, es la formación de un carbocatión. Para 1,3-butadieno, se agrega el protón para formar el intermedio de carbocatión alílico estabilizado por resonancia. El catión resultante tiene una energía de deslocalización sustancial, con la carga distribuida en dos carbonos. El nucleófilo reacciona con ambos carbonos, pero favorece al carbono que lleva la mayor carga positiva parcial. La reacción produce tanto los productos de adición 1,2 como 1,4. Cuanto más estable produce el intermedio, mayor es el porcentaje de los productos finales como se muestra en el mecanismo a continuación.

La formación de productos de adición 1,2 y 1,4 ocurre no solo con los ácidos hidrohalogenados, sino con halógenos, hidrogenación catalítica o radical, y otras adiciones polares asociadas con las reacciones de adición electrófila de alquenos aislados.
En un alcohol terciario (3°), el átomo de carbono que contiene el grupo -OH está unido directamente a tres grupos alquilo, que pueden ser cualquier combinación del mismo o diferente. Ejemplos:
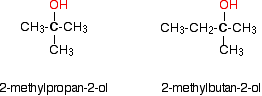
Ejercicio
3. Dar los productos 1,2 y 1,4 de la adición de un equivalente de HBr a 1,3-hexa-dieno.
4. Observa la reacción de adición previa de HBr con un dieno. Considera los estados de transición, predice cuáles de ellos serían los productos principales y cuáles serán los menores.
- Contestar
-
3.

4. Todos los productos i-iii muestran un intermedio de catión secundario el cual es más estable que el primario. Por lo tanto esos serían productos principales y el producto iv sería el producto menor.
.png)
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."

