16.4: Control cinético versus termodinámico
- Page ID
- 76080
Control termodinámico vs cinético
Tras la adición electrófila, el dieno conjugado forma una mezcla de dos productos, el producto cinético y el producto termodinámico, cuya relación está determinada por las condiciones de la reacción. Una reacción que produce más producto termodinámico está bajo control termodinámico, y de la misma manera, una reacción que produce más producto cinético está bajo control cinético. La reacción de un equivalente de bromuro de hidrógeno con 1,3-butadieno da diferentes proporciones de productos bajo diferentes condiciones de reacción para ilustrar la diferencia entre el control termodinámico y cinético.
Las flechas del mecanismo verde muestran la formación del producto de 1,2-adición cinéticamente favorecido. Como se muestra en el diagrama de energía de reacción debajo de la reacción, la reacción de adición 1,2 tiene una energía de activación más pequeña y una velocidad de reacción más rápida. Esta velocidad de reacción más rápida es lo que llevó al término “control cinético”. Esta reacción se ve favorecida por las bajas temperaturas donde la energía de activación se convierte en la principal barrera a la reactividad química.
Las flechas azules del mecanismo muestran la formación del producto 1,4-adición, el producto termodinámicamente favorecido. Como se muestra en el diagrama de energía de reacción debajo de la reacción, el producto de la reacción de adición 1,4-es menor en energía potencial. Su formación se ve favorecida por reacciones a altas temperaturas donde existe una energía termodinámica adecuada para superar todas las barreras de energía de activación. Esta reacción se ve favorecida por temperaturas elevadas que llevaron al término “control termodinámico”.
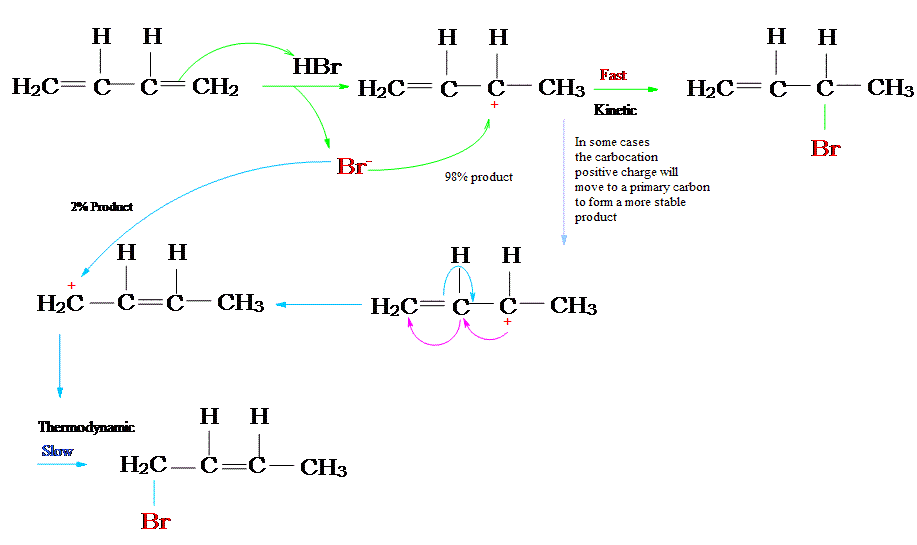
Diagrama de energía de reacción para 1,3-butadieno + HBr
La siguiente tabla resume los patrones de reactividad empíricamente derivados para dienos conjugados en cuatro condiciones de reacción diferentes. Familiarizarse con los datos y patrones de reactividad en esta tabla nos ayuda a construir sabiduría para determinar las condiciones óptimas de reacción cuando son posibles mecanismos competidores.
| Temperatura | Cinético o Termodinámicamente Controlado | Velocidad de reacción | 1,2-aducto: relación de aducto 1,4- |
|---|---|---|---|
| -15 °C | Kinetic | Rápido | 70:30 |
| 0 °C | Kinetic | Rápido | 60:40 |
| 40 °C | Termodinámica | Lento | 15:85 |
| 60 °C | Termodinámica | Lento | 10:90 |
A Advertencia: ¡No todas las reacciones tienen diferentes productos termodinámicos y cinéticos!
Tenga en cuenta que no todas las reacciones tienen un diagrama de perfil energético como Figura\(\PageIndex{1}\), ¡y no todas las reacciones tienen diferentes productos termodinámicos y cinéticos! Si los estados de transición que conducen a la formación de\(\ce{C}\) (por ejemplo, T C1 y T C2) fueran más altos en energía que los que conducen a\(\ce{B}\) (por ejemplo, T B1 y T B2), entonces simultáneamente\(\ce{B}\) serían ambos producto termodinámico y cinético. Hay muchas reacciones en las que el producto más estable (termodinámico) también se forma más rápido (cinético).
Ejercicio
5. Considera la reacción con 1,3-buta-dieno reaccionando con HCl. Proponer un mecanismo para la reacción.
- Contestar
-
5.

Colaboradores y Atribuciones
- Orthocresol (@chemistry StackExchange)
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
- Natasha Singh

