17.3: Resonancia y Orbitales Moleculares del Benceno
- Page ID
- 76519
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Estructura de benceno
Entre las muchas características distintivas del benceno, su aromaticidad es el principal contribuyente a por qué es tan poco reactivo. En esta sección se intentará aclarar la teoría de la aromaticidad y por qué la aromaticidad da cualidades únicas que hacen que estos alquenos conjugados sean inertes a compuestos como el Br 2 e incluso el ácido clorhídrico. También entrará en detalles sobre la energía de resonancia inusualmente grande debida a los seis carbonos conjugados del benceno.
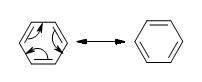
La deslocalización de los carbonos p-orbitales en los carbonos hibridados sp 2 es lo que da las cualidades aromáticas del benceno.
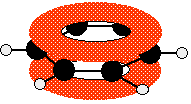
Este diagrama muestra uno de los orbitales moleculares que contiene dos de los electrones deslocalizados, los cuales se pueden encontrar en cualquier parte dentro de las dos “donas”. Los otros orbitales moleculares casi nunca se dibujan.
- El benceno (\(C_6H_6\)) es una molécula plana que contiene un anillo de seis átomos de carbono, cada uno con un átomo de hidrógeno unido.
- Los seis átomos de carbono forman un hexágono perfectamente regular. Todos los enlaces carbono-carbono tienen exactamente las mismas longitudes, en algún lugar entre enlaces simples y dobles.
- Hay electrones deslocalizados por encima y por debajo del plano del anillo, lo que hace que el benceno sea particularmente estable.
- El benceno resiste las reacciones de adición porque esas reacciones implicarían romper la deslocalización y perder esa estabilidad.
Debido a la aromaticidad del benceno, la molécula resultante es de forma plana, siendo cada enlace C-C de 1.39 Å de longitud y cada ángulo de enlace es de 120°. Podrían preguntarse cómo es posible que todos los enlaces tengan la misma longitud si el anillo está conjugado con ambos simples (1.47 Å) y dobles (1.34 Å), pero es importante señalar que no hay enlaces simples o dobles distintos dentro del benceno. Más bien, la deslocalización del anillo hace que cada uno cuente como un enlace y medio entre los carbonos, lo que tiene sentido porque experimentalmente encontramos que la longitud real del enlace está en algún lugar entre un enlace simple y doble. Finalmente, hay un total de seis electrones orbitales p que forman las nubes de electrones estabilizantes por encima y por debajo del anillo aromático.
.bmp)
Si el benceno se ve obligado a reaccionar aumentando la temperatura y/o por adición de un catalizador, se somete a reacciones de sustitución en lugar de las reacciones de adición que son típicas de los alquenos. Esto confirma aún más la indicación previa de que el núcleo de benceno de seis carbonos es inusualmente estable a la modificación química. La contradicción conceptual presentada por un alto grado de instauración (baja relación H:C) y la alta estabilidad química para el benceno y compuestos relacionados siguió siendo un rompecabezas sin resolver durante muchos años. Finalmente, se adoptó la estructura actualmente aceptada de un anillo regular hexagonal, plano de carbonos, y la excepcional estabilidad termodinámica y química de este sistema se atribuyó a la estabilización por resonancia de un trieno cíclico conjugado.
La Alta Estabilidad del Benceno
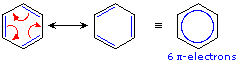
Aquí se escriben dos estructuras electrónicas estructural y energéticamente equivalentes para un compuesto estable, pero ninguna estructura proporciona una representación precisa o incluso adecuada de la molécula verdadera. El anillo de seis miembros en benceno es un hexágono perfecto (todos los enlaces carbono-carbono tienen una longitud idéntica de 1.40 Å). Se esperaría que los contribuyentes de ciclohexatrieno mostraran longitudes de enlace alternas, siendo los dobles enlaces más cortos (1.34 Å) que los enlaces simples (1.54 Å). Una representación alternativa para el benceno (círculo dentro de un hexágono) enfatiza la deslocalización de electrones pi en esta molécula, y tiene la ventaja de ser un solo diagrama. En casos como estos, la deslocalización electrónica descrita por resonancia mejora la estabilidad de las moléculas, y los compuestos compuestos por tales moléculas a menudo muestran una estabilidad excepcional y propiedades relacionadas.
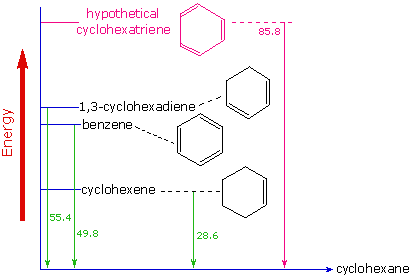
La evidencia de la estabilidad termodinámica mejorada del benceno se obtuvo a partir de mediciones del calor liberado cuando se hidrogenan dobles enlaces en un anillo de seis carbonos (hidrógeno se agrega catalíticamente) para dar ciclohexano como un producto común. En el siguiente diagrama el ciclohexano representa un punto de referencia de baja energía. La adición de hidrógeno al ciclohexeno produce ciclohexano y libera calor que asciende a 28.6 kcal por mol. Si tomamos este valor para representar el costo energético de introducir un doble enlace en un anillo de seis carbonos, esperaríamos que un ciclohexadieno libere 57.2 kcal por mol en la hidrogenación completa, y 1,3,5-ciclohexatrieno para liberar 85.8 kcal por mol. Estos calores de hidrogenación reflejarían la estabilidad termodinámica relativa de los compuestos. En la práctica, el 1,3-ciclohexadieno es ligeramente más estable de lo esperado, en aproximadamente 2 kcal, presumiblemente debido a la conjugación de los dobles enlaces. El benceno, sin embargo, es un extraordinario 36 kcal/mol más estable de lo esperado. Este tipo de mejora de la estabilidad ahora se acepta como una característica de todos los compuestos aromáticos.
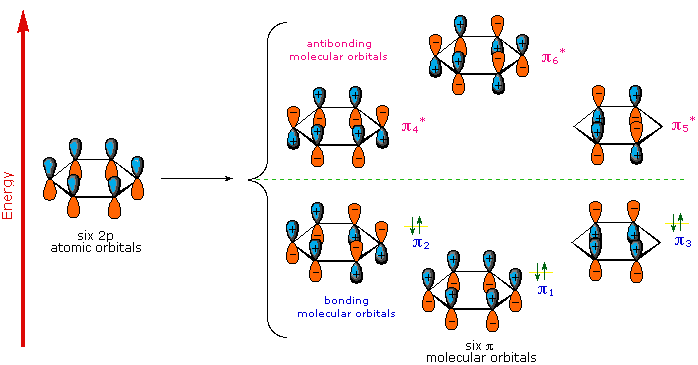
Una descripción orbital molecular del benceno proporciona un tratamiento más satisfactorio y más general de la “aromaticidad”. Sabemos que el benceno tiene una estructura hexagonal plana en la que todos los átomos de carbono están hibridados sp 2, y todos los enlaces carbono-carbono son iguales en longitud. Como se muestra a continuación, la matriz cíclica restante de seis orbitales p (uno en cada carbono) se superponen para generar seis orbitales moleculares, tres enlaces y tres antienlaces. Los signos más y menos mostrados en el diagrama no representan carga electrostática, sino que se refieren a signos de fase en las ecuaciones que describen estos orbitales (en el diagrama las fases también están codificadas por colores). Cuando las fases corresponden, los orbitales se superponen para generar una región común de fase similar, siendo los orbitales que tienen el mayor solapamiento (p. ej. π 1) los más bajos en energía. Los electrones de valencia de carbono restantes luego ocupan estos orbitales moleculares en pares, lo que resulta en un conjunto completamente ocupado (6 electrones) de orbitales moleculares de enlace. Es este conjunto completamente lleno de orbitales de unión, o caparazón cerrado, lo que le da al anillo de benceno su estabilidad termodinámica y química, así como un octeto de concha de valencia llena confiere estabilidad a los gases inertes.
Los orbitales moleculares del benceno
Dado que el benceno tiene seis electrones pi, todos los MO de enlace están llenos, lo que indica una molécula altamente estable.
Ejercicio
2. La molécula mostrada, p-metilpiridina, tiene propiedades similares al benceno (plano, ángulos de enlace de 120°). Dibuja los orbitales pi para este compuesto.

- Contestar
-
2. El nitrógeno tiene un par solitario de electrones perpendiculares al anillo.

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry

