21.2: Acidez de los ácidos carboxílicos
- Page ID
- 76923
Comparando las fortalezas de los ácidos débiles 
Las fuerzas de los ácidos débiles se miden en la escala pK a. Cuanto menor sea el número en esta escala, más fuerte es el ácido. Tres de los compuestos que veremos, junto con sus valores de pK a son:
Recuerda: cuanto más pequeño es el pKa, más fuerte es el ácido. Comparando los otros dos con el ácido etanoico, vemos que el fenol es mucho más débil con un pK a de 10.00, y el etanol es tan débil con un pK a de aproximadamente 16 que ¡apenas cuenta como ácido en absoluto! El pKa del etanol es de aproximadamente 17, mientras que el pKa del ácido acético es de aproximadamente 5: esto es una diferencia de 10 a 12 veces en las dos constantes de acidez. En ambos compuestos, el protón ácido está unido a un átomo de oxígeno. ¿Cómo pueden ser tan diferentes en términos de acidez? Comenzamos considerando las bases conjugadas.
En ambas especies, la carga negativa sobre la base conjugada es retenida por un oxígeno, por lo que no se pueden invocar tendencias periódicas. Para el ácido acético, sin embargo, existe una diferencia clave: se puede dibujar un contribuyente de resonancia en el que la carga negativa se localiza en el segundo oxígeno del grupo. Las dos formas de resonancia para la base conjugada son iguales en energía. Lo que esto significa es que la carga negativa sobre el ion acetato no se localiza en un oxígeno ni en el otro: más bien se comparte entre los dos. Los químicos utilizan el término 'deslocalización de carga' para describir esta situación. En el ion etóxido, por el contrario, la carga negativa está 'bloqueada' en el único oxígeno —no tiene a dónde ir.
Recordemos la idea fundamental de que las cargas electrostáticas, ya sean positivas o negativas, son más estables cuando se 'extienden' que cuando están confinadas a un átomo. Aquí, una carga está siendo 'extendida' (en otras palabras, deslocalizada) por resonancia, más que simplemente por el tamaño del átomo involucrado.
La deslocalización de carga por resonancia tiene un efecto muy potente sobre la reactividad de las moléculas orgánicas, suficiente para explicar la diferencia de más de 12 unidades pK a entre etanol y ácido acético. El ion acetato es mucho más estable que el ion etóxido, todo debido a los efectos de la deslocalización por resonancia.
Efectos de resonancia sobre la acidez de los ácidos carboxílicos
¿Por qué la presencia de un grupo carbonilo adyacente a un grupo hidroxilo debería tener un efecto tan profundo en la acidez del protón hidroxilo? Para responder a esta pregunta debemos volver a la naturaleza de los equilibrios ácido-base y a la definición de pK a, ilustrada por las ecuaciones generales que se dan a continuación.
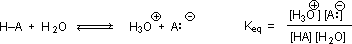
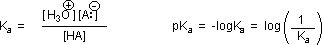
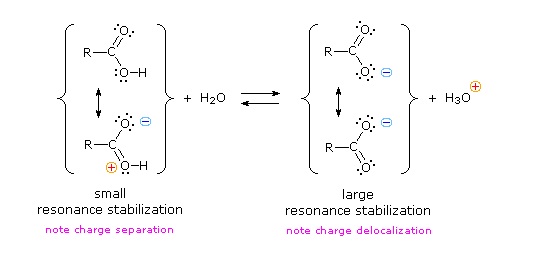
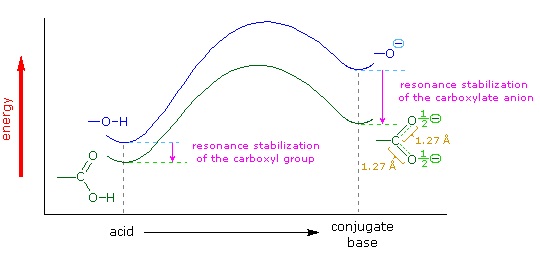
Sabemos que un equilibrio favorece el lado termodinámicamente más estable, y que la magnitud de la constante de equilibrio refleja la diferencia de energía entre los componentes de cada lado. En un equilibrio ácido-base el equilibrio siempre favorece al ácido y base más débiles (estos son los componentes más estables). El agua es la base estándar utilizada para las mediciones de pK a; en consecuencia, cualquier cosa que estabilice la base conjugada (A: (—)) de un ácido necesariamente hará que ese ácido (H-A) sea más fuerte y desplazará el equilibrio hacia la derecha. Tanto el grupo carboxilo como el anión carboxilato se estabilizan por resonancia, pero la estabilización del anión es mucho mayor que la de la función neutra, como se muestra en el siguiente diagrama. En el anión carboxilato las dos estructuras contribuyentes tienen el mismo peso en el híbrido, y los enlaces C-O son de igual longitud (entre un enlace doble y uno sencillo). Esta estabilización conduce a un marcado aumento de la acidez, como lo ilustra el diagrama de energía que se muestra al hacer clic en el botón "Toggle Display"”.
Efectos inductivos sobre la acidez relativa
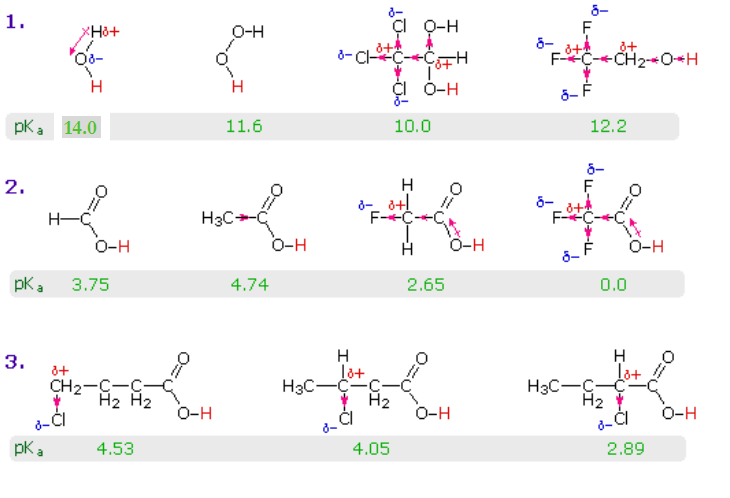
El efecto de resonancia aquí descrito es sin duda el principal contribuyente a la excepcional acidez de los ácidos carboxílicos. Sin embargo, los efectos inductivos también juegan un papel. Por ejemplo, los alcoholes tienen pK a de 16 o más pero su acidez se incrementa por sustituyentes extractores de electrones en el grupo alquilo. El siguiente diagrama ilustra este factor para varios compuestos inorgánicos y orgánicos simples (fila #1), y muestra cómo la extracción inductiva de electrones también puede aumentar la acidez de los ácidos carboxílicos (filas #2 y 3). El hidrógeno ácido es de color rojo en todos los ejemplos. El agua es menos ácida que el peróxido de hidrógeno porque el hidrógeno es menos electronegativo que el oxígeno, y el enlace covalente que une estos átomos se polariza de la manera mostrada. Los alcoholes son ligeramente menos ácidos que el agua, debido a la mala electronegatividad del carbono, pero el hidrato de cloral, Cl 3 CCH (OH) 2 y 2,2,2, -trifluoroetanol son significativamente más ácidos que el agua, debido a la extracción inductiva de electrones por los halógenos electronegativos (y el segundo oxígeno en hidrato de cloral). En el caso de los ácidos carboxílicos, si se disminuye el carácter electrófilo del carbono carbonílico, también disminuirá la acidez del ácido carboxílico. De igual manera, un incremento en su electrofilicidad incrementará la acidez del ácido. El ácido acético es diez veces más débil que el ácido fórmico (las dos primeras entradas en la segunda fila), lo que confirma el carácter donador de electrones de un grupo alquilo en relación con el hidrógeno, como se señaló anteriormente en una discusión sobre la estabilidad de los carbocationes. Los sustituyentes electronegativos aumentan la acidez por extracción inductiva de electrones. Como era de esperar, cuanto mayor sea la electronegatividad del sustituyente mayor será el aumento de la acidez (F > Cl > Br > I), y cuanto más cerca está el sustituyente del grupo carboxilo mayor es su efecto (isómeros en la 3ª fila). Los sustituyentes también influyen en la acidez de los derivados del ácido benzoico, pero los efectos de resonancia compiten con los efectos inductivos. El grupo metoxi es donador de electrones y el grupo nitro es extractor de electrones (últimas tres entradas en la tabla de valores de pK a).
Una mirada más cercana a los efectos de los grupos aceptores de electrones y donantes de electrones sobre la estabilidad de las bases conjugadas se puede observar en los valores de pKa del ácido benzoico como se muestra en la siguiente tabla. La base conjugada del ácido benzoico se estabiliza mediante grupos aceptores de electrones. Esto hace que el ácido sea más ácido
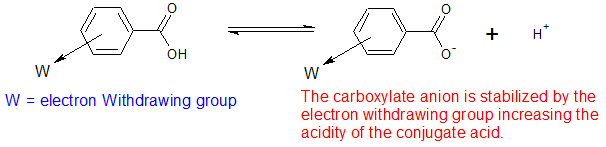
Los grupos aceptores de electrones desactivan el anillo de benceno a reacciones electrofílicas y hacen que los ácidos benzoicos sean más ácidos.
La base conjugada del ácido benzoico es desestabilizada por grupos donadores de electrones. Esto hace que el ácido sea menos ácido
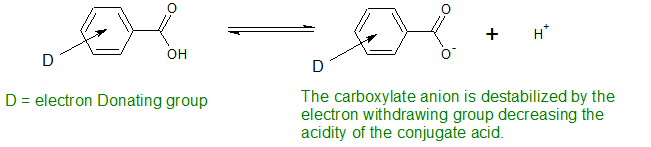
Los grupos donadores de electrones activan el anillo de benceno a reacciones electrofílicas y hacen que los ácidos benzoicos sean menos ácidos.
Ejercicio
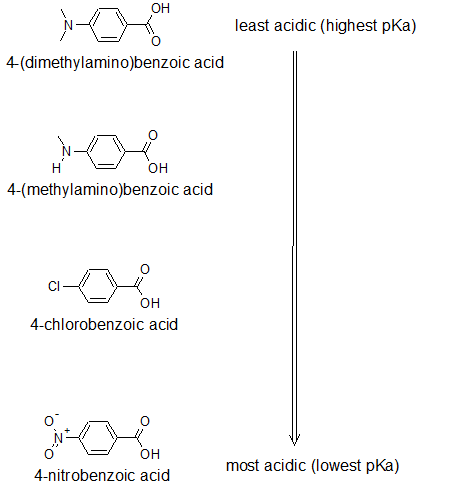
2. Dibuje las estructuras de la línea de unión y organice los siguientes compuestos en orden de acidez creciente: ácido 4-nitrobenzoico; ácido 4- (metilamino) benzoico; ácido p-clorbenzoico; ácido 4- (dimetilamino) benzoico.
- Contestar
-
2.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
- Tom Neils (Grand Rapids Community College)

