23.11: Reacciones de descarboxilación
- Page ID
- 76812
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Los enolatos pueden actuar como nucleófilos en reacciones de tipo S N 2. En general, un hidrógeno α se reemplaza con un grupo alquilo. Esta reacción es una de las más importantes para los enolatos debido a que se forma un enlace carbono-carbono. Estas alquilaciones se ven afectadas por las mismas limitaciones que las reacciones de S N 2 previamente discutidas. Se debe usar un buen grupo saliente, X= cloruro, bromuro, yoduro, tosilato. Además, los grupos secundarios y terciarios no deben ser utilizados debido a la mala reactividad y posible competencia con las reacciones de eliminación. Por último, es importante utilizar una base fuerte, como LDA o amida sódica, para esta reacción. El uso de una base más débil como hidróxido o alcóxido deja la posibilidad de que se produzcan múltiples alquilaciones.
Síntesis de éster malónico
El éster malónico es un reactivo que se usa específicamente en una reacción que convierte haluros de alquilo en ácidos carboxílicos llamados Síntesis de Ésteres Malónicos. La síntesis de éster malónico es un procedimiento sintético utilizado para convertir un compuesto que tiene la fórmula estructural general 1 en un ácido carboxílico que tiene la fórmula estructural general 2.
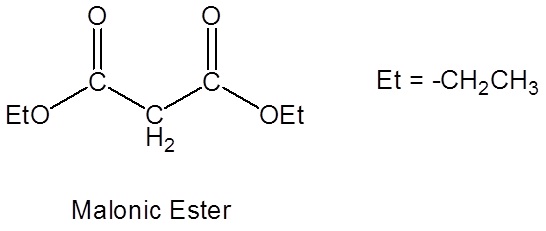
Debido a que los hidrógenos α del éster malónico son adyacentes a dos carbonilos, pueden ser desprotonados por etóxido de sodio (NaOEt) para formar Ester Malónico de Sodio.

Debido a que el éster malónico de sodio es un enolato, entonces se puede alquilar con haluros de alquilo.

Después de la alquilación, el producto se puede convertir en un ácido dicarboxílico mediante saponificación y posteriormente uno de los ácidos carboxílicos se puede eliminar a través de una etapa de descarboxilación.
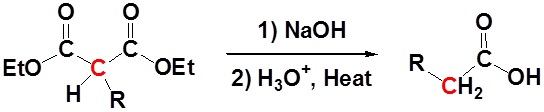
Mecanismo
1) Saponificación

2) Descarboxilación

3) Tautomerización

Todos los pasos juntos forman la síntesis del éster malónico.
\[RX \rightarrow RCH_2CO_2H\]
Ejemplo

La síntesis de ésteres acetoacéticos
La síntesis de éster acetoacético permite la conversión de acetoacetato de etilo en una metil cetona con uno o dos grupos alquilo en el carbono alfa.
Pasos
1) Desprotonación con etóxido
2) Alquilación vía y reacción SN2
3) Hidrólisis y descarboxilación
Adición de un segundo grupo alquico
Después de la primera etapa y se puede añadir un grupo alquilo adicional antes de la etapa de descarboxilación. En general, esto permite la adición de dos grupos alquilo diferentes.
Ejercicio
18. Proponer una síntesis para cada una de las siguientes moléculas a partir de este éster malónico.

(a)
b)
c)
19. ¿Por qué no podemos preparar ácidos acéticos trisustituidos a partir de un éster malónico?
20. Proponer una síntesis para la siguiente molécula a través de un éster malónico.

- Contestar
-
18.
(a) 1) Éter malónico, NaOEt, 2) Bromuro de 4-metilbencilo, 3) Base, 4) Ácido, Calor
(b) 1) Éter malónico, NaOEt, 2) 3-bromohexano, 3) Base, 4) Ácido, Comer
(c) 1) Éter Malónico, NaOEt, 2) 1-Bromo-2,3,3-trimetilbutano, 3) Base, 4) Ácido, Calor
19. Los ésteres malónicos solo contienen dos protones ácidos.
20.

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
Prof. Steven Farmer (Sonoma State University)

