5.1: Reacciones de Alquenos - Adición Electrofílica
( \newcommand{\kernel}{\mathrm{null}\,}\)
Los carbonos de doble enlace de un alqueno son ricos en electrones, es decir, la densidad de electrones es alta en la región del doble enlace. Por lo tanto, la reacción de “firma” de los alquenos implica el ataque inicial a un electrófilo. En lugar de una sustitución, los alquenos experimentan adición electrófila, una reacción en la que un reactivo de dos componentes se agrega a través del doble enlace. La reacción comienza con un ataque electrófilo por el doble enlace sobre el reactivo que produce un carbocatión que luego sufre ataque nucleófilo. En el caso de los alquenos asimétricos (donde los grupos unidos a los carbonos de doble enlace no son exactamente los mismos), se produce el carbocatión más estable. Esta reacción es regioselectiva, es decir, podemos predecir la orientación de la adición de reactivos a través del doble enlace. Si designamos el reactivo comoE (para electrófilo) oN (para nucleófilo), la reacción procedería como se describe a continuación.
| Reactivo | Electrofilo | Nucleófilo | Condiciones Típicas |
| HBr | H+ | Br− | Baja Temp |
| H2O | H+ | H2O(con pérdida deH+ después de la adición) | Ácido Acuoso/Baja Temperatura |
| ROH | H+ | ROH | ROH/H3O+ |
| Br2 | Br+ | Br− | Br2/CCl4 |
| BrOH | Br− | −OH | Br2/H2O |
| BrOR | Br+ | −OR | Br2/ROH |
El carbocatión intermedio es el carbocatión terciario, (más que el carbocatión primario que se produciría por adición al=CH2 final del doble enlace). A este patrón de reacción se le conoce como adición de Markovinkov, después de que la persona [1] que primero descubrió que seHBr suma de esta manera a un doble vínculo. Podemos clasificar muchos reactivos como combinaciones de electrófilo y nucleófilo y, de esta manera, predecir cómo se sumarán a través del doble enlace. Se muestran ejemplos de tales reactivos (↑). En lugar de memorizar el producto de cada tipo de adición a través de un doble enlace, es mucho más productivo escribir un mecanismo determinando qué parte es el electrófilo, agregándolo para dar el carbocatión más estable, seguido del nucleófilo.
Las adiciones a los alquenos son reversibles:
Echemos ahora un vistazo más de cerca a la adición de agua a través de un doble enlace. Tal reacción se puede llevar a cabo haciendo reaccionar el alqueno con ácido sulfúrico diluido a bajas temperaturas. El primer paso es la adición de un protón para producir la carbocatión más estable, que luego es atacada por el agua (el nucleófilo). El producto final es el alcohol que se forma después de que un protón se transfiere al agua. En este caso, podemos considerar el protón (o más exactamenteH3O+) como un catalizador ya que se regenera al final de la secuencia de reacción.
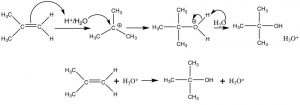
Adición de agua catalizada por ácido a través de un doble enlace
En este punto podrías estar preguntándote: bueno, ¿no acabamos de hablar de la reacción inversa, es decir, la eliminaciónH2O de alcoholes para dar alquenos? ¡Efectivamente lo hicimos! Muchas reacciones orgánicas son reversibles [2], es solo cuestión de manipular las condiciones. Las condiciones exactas de reacción determinarán qué reacción se ve favorecida.
Como es el caso de la mayoría de las reacciones de adición, la adición de agua a través de un alqueno es exotérmica,ΔH es decir, es negativa porque se forman enlaces (sigma) más fuertes durante la reacción y se libera energía al ambiente. A continuación se muestra un diagrama de energía típico.
Diagrama de energía de reacción para adición/eliminación a través de un doble enlace.
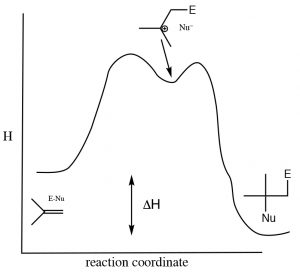
Esto significa queΔH para la eliminación la reacción debe ser positiva (es decir, ir de derecha a izquierda en el diagrama anterior). La pregunta entonces es: ¿por qué ocurre alguna vez una reacción de eliminación? Para responder a eso, hay que recordar que el criterio termodinámico para que una reacción proceda no es simplemente un cambio negativo de entalpía, sino más bien un cambio negativo en el cambio de Gibbs (ΔG). Recordemos esoΔG=ΔH−TΔS. El cambio en la entropía también influye en la favorabilidad termodinámica de una reacción. En la reacción de eliminación, se producen dos moléculas (alqueno y agua) una molécula de alcohol —el cambio de entropía será (Recordemos que la entropía se asocia con el número de posibles arreglos del sistema. Dado que dos moléculas tendrán más arreglos posibles que uno, esta reacción siempre irá acompañada de un aumento en la entropía del sistema). Para fomentar que el equilibrio se desvíe hacia la derecha (la reacción de adición) necesitamos aumentar la temperatura, lo que aumentará la magnitud del término−TΔS\), haciéndoseΔG más negativo (asumiendo que esoΔS es positivo). En general, las adiciones a los dobles enlaces se llevan a cabo a temperaturas más bajas, mientras que las reacciones de eliminación implican calentar la solución de reacción. Otra forma de influir en el estado de equilibrio es cambiar las concentraciones relativas de reactivos o productos. Debido a que el agua es un reactivo, aumentar la concentración de agua desplaza la posición de equilibrio hacia el producto de adición mientras que la disminución de la concentración de agua favorece la reacción de eliminación.

Reactivos específicos para adiciones a través de un doble enlace que reducen el problema de carbocationes
El problema con muchas de estas reacciones simples de adición a un doble enlace es que generan carbocationes, lo que como hemos visto ya puede conducir a reacciones adicionales, dando como resultado reordenamientos esqueléticos y la producción de mezclas racémicas (en lugar de un solo estereoisómero). Para abordar este tema, se han desarrollado una serie de reactivos que minimizan este problema. Por ejemplo, un reactivo que involucra acetato mercúrico (Hg(OAc)2) y borohidruro de sodio (NaBH4) como intermedio se puede usar para agregarH2O, (o alcohol) a través de un doble enlace (↓).
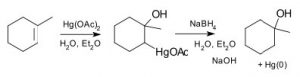
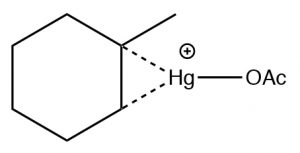
La reacción involucra un catión estabilizado con mercurio (→) que evita reordenamientos no deseados. El producto sigue siendo un producto Markovnikov (ver arriba) pero a menudo se forma de manera más limpia, es decir, sin alternativas no deseadas.
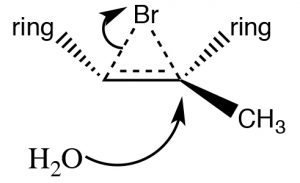
Otro conjunto de reacciones que pueden usarse para limitar los reordenamientos moleculares y conducir a productos estereoespecíficos son las que comienzan con la adición de bromo a través del doble enlace. La más simple de estas co-reacciones es la adición deBr2 sí misma; dado queBr es un átomo polarizable grande, la molécula de bromo puede polarizarse e interactuar con el doble enlace como se muestra (↓) para formar un ion bromo (en lugar de un carbocatión).
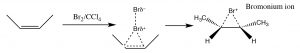
El ion bromonio ahora puede sufrir ataque nucleofílico en cualquiera de los dos carbonos (ya que en este ejemplo son iguales, es decir, están unidos a grupos idénticos), para producir el producto de adición de trans-dibromo. El producto trans se forma porque la segunda etapa es unaSN2 reacción con el bromuro nucleófilo atacando el carbono desde la parte posterior.
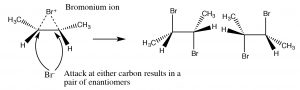
La adición deBr2 se logra usando un disolvente de reacción tal como tetracloruro de carbono que no interfiere con la reacción. Si se usa agua o un alcohol como disolvente, entonces el ataque al ion bromonio proviene del disolvente que actúa como nucleófilo en la segunda etapa.
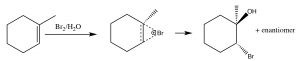
Nuevamente, la adición es trans, pero ahora un nucleófilo entrante (H2O) atacará al carbono que es más parecido a carbocatión, es decir, es el más estabilizado, como se muestra aquí→. La reacción es tanto regioespecífica como estereoespecífica.