1.1: Preludio a átomos, configuraciones de electrones y estructuras de Lewis
- Page ID
- 72381
Es una calurosa tarde de agosto en un parque en el centro de North Hudson, Wisconsin, un pueblo de poco menos de 4000 personas en el río St. Croix en el extremo occidental del estado. Una fila de personas está sentada en mesas instaladas dentro de una carpa de lona. Frente a una multitud animadora de amigos, familiares y vecinos, estas valientes almas están a punto de hacer batalla. .con un plato de frutas.

Desafortunadamente para los concursantes, la fruta en cuestión es el habanero, una de las variedades más calientes de chile que se encuentran comúnmente en los mercados de Norteamérica. En este evento en particular, equipos de cinco personas correrán para ser los primeros en comer una libra llena de pimientos. A medida que comienza la comida, todo parece bien al principio. Dentro de treinta segundos, sin embargo, lo que comienza a suceder es completamente predecible y comprensible para cualquiera que alguna vez haya vertido por error un poco o mucha salsa picante en el plato. Las caras se vuelven rojas, el sudor y las lágrimas comienzan a fluir, y se traga una copiosa cantidad de agua fría.
Si bien técnicamente los concursantes están compitiendo entre sí, el verdadero oponente en esta contienda -la causa de todo el dolor y sufrimiento- es el compuesto químico 'capsaicina', la fuente del calor en los chiles picantes.

Compuesto por los cuatro elementos carbono, hidrógeno, oxígeno y nitrógeno, la capsaicina es producida por la planta de chile con el propósito de proteger a los mamíferos hambrientos. La molécula se une y activa a una proteína receptora de mamífero llamada TrpV1, que en circunstancias normales tiene el trabajo de detectar altas temperaturas y enviar una señal al cerebro - 'hace calor, ¡mantente alejado! 'Esta estrategia funciona bastante bien en todas las especies de mamíferos excepto en una: nosotros los humanos (algunos de nosotros, al menos) parecemos estar solos en nuestra tendencia a buscar realmente la quemadura del pimiento picante en nuestra comida.
Curiosamente, las aves también tienen una proteína receptora de calor que es muy similar al receptor TrpV1 en los mamíferos, pero las aves no son en absoluto sensibles a la capsaicina. Hay una lógica evolutiva en esto: es en beneficio del pimiento ser comido por un ave en lugar de un mamífero, porque un ave puede esparcir las semillas de pimiento sobre un área mucho más amplia. La región del receptor que es responsable de la sensibilidad a la capsaicina parece ser bastante específica: en 2002, los científicos pudieron insertar un pequeño segmento del gen del receptor trpV1 de rata (sensible a la capsaicina) en la versión de pollo no sensible del gen, y el quimérico resultante (especie mixta) fue sensible a la capsaicina (Cell 2002, 108, 421).
De vuelta en el North Hudson Pepperfest, aquellos con un poco más de sentido común están dejando de lado los dolorosos efectos de la sobrecarga de capsaicina y, en cambio, se están entregando a fenómenos químicos más agradables. Una niña que disfruta de un cono de helado está respondiendo en parte a la acción química de otro compuesto orgánico llamado vainillina.
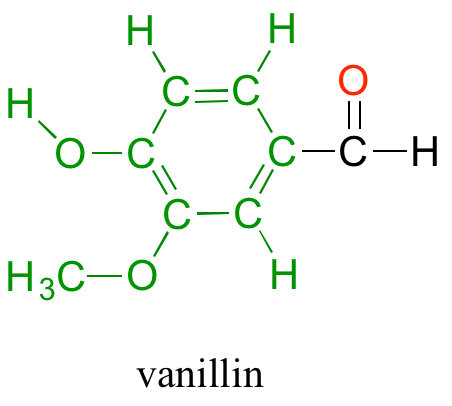
¿Qué tiene la capsaicina y la vainillina que hacen que estos dos compuestos tengan efectos tan dramáticamente diferentes en nuestras percepciones sensoriales? Ambos son producidos por plantas, y ambos están compuestos por los elementos carbono, hidrógeno, oxígeno y (en el caso de la capsaicina) nitrógeno. Desde el nacimiento de la química como ciencia, los químicos han quedado fascinados -y durante gran parte de esa historia, desconcertado- por las innumerables propiedades de los compuestos que provienen de los seres vivos. El término 'orgánico', del griego organikos, se aplicó a estos compuestos, y se pensó que contenían algún tipo de 'fuerza vital' que los diferenciaba de compuestos 'inorgánicos' como minerales, sales y metales, y que les permitía operar por un conjunto completamente diferente de principios químicos. ¿De qué otra manera sino a través de la acción de una 'fuerza vital' podría combinarse un subgrupo tan pequeño de los elementos para formar compuestos con tantas propiedades diferentes?
Hoy, como probablemente ya sabrás, el término 'orgánico', -cuando se aplica a la química- se refiere no sólo a las moléculas de los seres vivos, sino a todos los compuestos que contienen el elemento carbono, independientemente de su origen. A principios del siglo XIX, cuando los químicos aprendieron a través de una cuidadosa experimentación sobre la composición y propiedades de compuestos 'orgánicos' como los ácidos grasos, el ácido acético y la urea, e incluso descubrieron cómo sintetizar algunos de ellos comenzando con componentes exclusivamente 'inorgánicos', comenzaron a darse cuenta de que el concepto de 'fuerza vital' no era válido, y que las propiedades de las moléculas tanto orgánicas como inorgánicas podrían de hecho entenderse utilizando los mismos principios químicos fundamentales.
También comenzaron a apreciar más plenamente las características únicas del elemento carbono que lo hace tan central para la química de los seres vivos, en la medida en que justifica su propio subcampo de la química. El carbono forma cuatro enlaces estables, ya sea con otros átomos de carbono o con hidrógeno, oxígeno, nitrógeno, azufre, fósforo o un halógeno. Los modos de unión característicos del carbono le permiten servir como esqueleto, o marco, para construir moléculas grandes y complejas que incorporan cadenas, ramas y estructuras de anillo.
Aunque 'química orgánica' ya no significa exclusivamente el estudio de compuestos de seres vivos, es sin embargo el deseo de comprender e influir en la química de la vida lo que impulsa gran parte del trabajo de los químicos orgánicos, si el objetivo es aprender algo fundamentalmente nuevo sobre la reactividad de un enlace carbono-oxígeno, para descubrir un nuevo método de laboratorio que podría usarse para sintetizar un medicamento que salve vidas, o para comprender mejor la intrincada danza química que ocurre en el sitio activo de una enzima o proteína receptora. Aunque los humanos llevan siglos comiendo pimientos picantes y alimentos con sabor a vainilla, justo ahora, en las últimas décadas, estamos empezando a entender cómo y por qué uno causa dolor abrasador, y el otro puro placer gustativo. Entendemos que la disposición geométrica precisa de los cuatro elementos en la capsaicina le permite encajar dentro del bolsillo de unión del receptor de calor TrpV1, pero, a día de hoy, aún no tenemos una imagen tridimensional detallada de la proteína TrpVI unida a la capsaicina. También sabemos que la diferente disposición de los átomos de carbono, hidrógeno y oxígeno en la vainillina le permite unirse a receptores olfativos específicos, pero nuevamente, todavía hay mucho por descubrir sobre cómo sucede exactamente esto.
En este capítulo, se te presentará algunos de los principios más fundamentales de la química orgánica. Con los conceptos que aprendemos, podemos comenzar a entender cómo el carbono y un número muy reducido de otros elementos de la tabla periódica pueden combinarse de manera predecible para producir un repertorio químico prácticamente ilimitado.
A medida que leas, reconocerás que el capítulo contiene mucha revisión de temas que probablemente ya hayas aprendido en un curso introductorio de química, pero probablemente también habrá algunos conceptos que son nuevos para ti, así como algunos temas que ya te son familiares pero cubiertos en un mayor profundidad y con mayor énfasis en compuestos orgánicos biológicamente relevantes.
Comenzaremos con un recordatorio de cómo los químicos representan la unión en moléculas orgánicas con la convención de dibujo 'Estructura de Leis', centrándonos en el concepto de 'carga formal'. Revisaremos los patrones de unión comunes de los seis elementos necesarios para todas las formas de vida en la tierra -carbono, hidrógeno, nitrógeno, oxígeno, azufre y fósforo- más los halógenos (flúor, cloro, bromo y yodo). Luego continuaremos con algunas de las habilidades básicas involucradas en dibujar y hablar de moléculas orgánicas: comprender la convención de dibujo de 'estructura linea' y otras formas útiles de abreviar y simplificar dibujos estructurales, aprender sobre grupos funcionales e isómeros, y ver cómo nombrar sistemáticamente moléculas orgánicas simples. Por último, lo reuniremos todo junto con una revisión de las estructuras de las clases más importantes de moléculas biológicas -lípidos, carbohidratos, proteínas y ácidos nucleicos- a las que nos referiremos constantemente a lo largo del resto del libro.
Antes de comenzar su estudio de química orgánica, es posible que deba hacer alguna revisión de Química General porque se asumirá que ya comprende algunos conceptos básicos de química. Una excelente manera de revisar es ver la siguiente serie de tutoriales de Khan Academy:
Tutoriales de revisión
- Átomos, compuestos e iones
- Estructura electrónica de los átomos
- Enlaces químicos y dibujo de estructuras de Lewis
Aquí hay algunos ejercicios de práctica para probar antes de seguir adelante:
¿Cuántos protones y neutrones tienen los siguientes isótopos?
- 31 P, el isótopo más común de fósforo
- 32 P, un isótopo radiactivo de fósforo utilizado a menudo en el estudio del ADN y ARN.
- 37 Cl, uno de los dos isótopos comunes del cloro.
- tritio (3 H), un isótopo radiactivo de hidrógeno, utilizado a menudo por los bioquímicos como átomo 'trazador'.
- 14 C, un isótopo radiactivo de carbono, también utilizado como trazador en bioquímica.
Ejercicio 1.2
La configuración electrónica de un átomo de carbono es 1s 2 2s 2 2p 2, y la de un catión sodio (Na +) es 1s 2 2s 2 2p 6. Mostrar la configuración de electrones para:
- un átomo de nitrógeno
- un átomo de oxígeno
- un átomo de flúor
- un átomo de magnesio
- un catión de magnesio (Mg 2+)
- un átomo de potasio
- un ion potasio (K +)
- un anión cloruro (Cl -)
- un átomo de azufre
- un catión de litio (Li +)
- un catión de calcio (Ca 2+)
Ejercicio 1.3
Dibuje estructuras de Lewis para las siguientes especies (use líneas para denotar enlaces, puntos para electrones de par solitario). Todos los átomos deben tener una completa capa de valencia de electrones.
- amoníaco, NH 3
- ion amonio, NH 4 +
- ion amida, NH 2 -
- formaldehído, HCOH
- ion acetato, CH 3 COO -
- metilamina, CH 3 NH 2
- etanol, CH 3 CH 2 OH
- éter dietílico, CH 3 CH 2 OCH 2 CH 3
- ciclohexanol (fórmula molecular C 6 H 12 O, con seis carbonos unidos en un anillo y un grupo OH)
- propeno, CH 2 CHCH 3
- piruvato, CH 3 COCO 2 H
Soluciones para ejercicios


