1.2: Dibujo de Estructuras Orgánicas
- Page ID
- 72423
Cargos Formales
Ahora que ha tenido la oportunidad de volver a su libro de texto introductorio de química para revisar alguna información básica sobre átomos, orbitales, enlaces y moléculas, dirijamos nuestra atención un poco más de cerca a la idea de especies cargadas. Se sabe que un ion es una molécula o átomo que tiene asociada una carga positiva o negativa. El cobre, por ejemplo, se puede encontrar tanto en su estado neutro (Cu 0, que es el metal), como en su estado Cu +2, como componente de un compuesto iónico como el carbonato de cobre (CuCo 3), la sustancia verde llamada 'pátina' que se forma en la superficie de los objetos de cobre.
Las moléculas orgánicas también pueden tener cargas positivas o negativas asociadas con ellas. Considera la estructura Lewis del metanol, CH 3 OH (el metanol es el llamado 'alcohol de madera' que los contrapuntas sin escrúpulos a veces vendían durante los días de prohibición en la década de 1920, haciendo que muchas veces las personas que lo bebían quedaran ciegas). El metanol en sí es una molécula neutra, pero puede perder un protón para convertirse en un anión molecular (CH 3 O -), o ganar un protón para convertirse en un catión molecular (CH 3 OH 2 +).

El anión molecular y el catión tienen cargas globales de -1 y +1, respectivamente. Pero podemos ser más específicos que eso -también podemos afirmar para cada ion molecular que una carga formal se localiza específicamente en el átomo de oxígeno, más que en el carbono o cualquiera de los átomos de hidrógeno.
Averiguar la carga formal en diferentes átomos de una molécula es un proceso sencillo, es simplemente una cuestión de sumar electrones de valencia.
Un átomo de oxígeno no unido tiene 6 electrones de valencia. Sin embargo, cuando se une como parte de una molécula de metanol, un átomo de oxígeno está rodeado por 8 electrones de valencia: 4 electrones no enlazantes (dos 'pares solitarios') y 2 electrones en cada uno de sus dos enlaces covalentes (uno al carbono, uno al hidrógeno). En la convención formal de carga, decimos que el oxígeno 'posee' los 4 electrones no enlazantes. Sin embargo, solo 'posee' un electrón de cada uno de los dos enlaces covalentes, porque los enlaces covalentes implican la compartición de electrones entre átomos. Por lo tanto, el átomo de oxígeno en metanol posee 2 + 2 + (½ x 4) = 6 electrones de valencia.
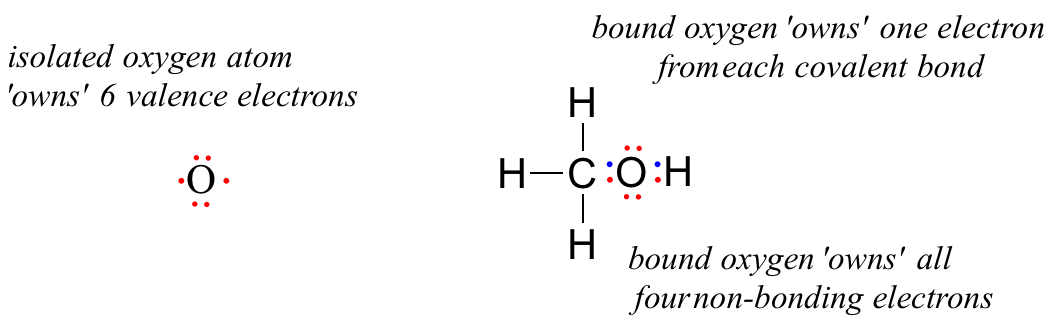
La carga formal sobre un átomo se calcula como el número de electrones de valencia propiedad del átomo aislado menos el número de electrones de valencia propiedad del átomo unido en la molécula:
cargo formal =
(número de electrones de valencia propiedad del átomo aislado)
- (número de electrones de valencia propiedad del átomo unido)
o..
cargo formal =
(número de electrones de valencia propiedad del átomo aislado)
- (número de electrones no enlazantes en el átomo unido)
- (½ el número de electrones de unión en el átomo unido)
Usando esta fórmula para el átomo de oxígeno del metanol, tenemos:
carga formal sobre oxígeno =
(6 electrones de valencia en átomo aislado)
- (4 electrones no unibles)
- (½ x 4 electrones de unión)
= 6 - 4 - 2 = 0. Así, el oxígeno en metanol tiene una carga formal de cero (es decir, no tiene carga formal).
¿Qué tal el átomo de carbono en metanol? Un carbono aislado posee 4 electrones de valencia. El carbono unido en metanol posee (½ x 8) = 4 electrones de valencia:
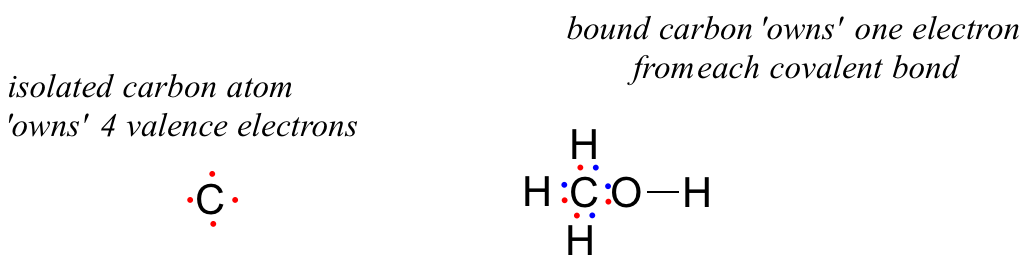
carga formal sobre carbono =
(4 electrones de valencia sobre átomo aislado)
- (0 electrones no unibles)
- (½ x 8 electrones de unión)
= 4 - 0 - 4 = 0. Por lo que la carga formal sobre el carbono es cero.
Por cada uno de los hidrógenos en metanol, también obtenemos una carga formal de cero:
carga formal sobre hidrógeno =
(1 electrón de valencia sobre átomo aislado)
- (0 electrones no unibles)
- (½ x 2 electrones de unión)
= 1 - 0 - 1 = 0
Ahora, veamos la forma catiónica del metanol, CH 3 OH 2 +. El panorama de unión no ha cambiado para el carbono ni para ninguno de los átomos de hidrógeno, por lo que nos centraremos en el átomo de oxígeno.
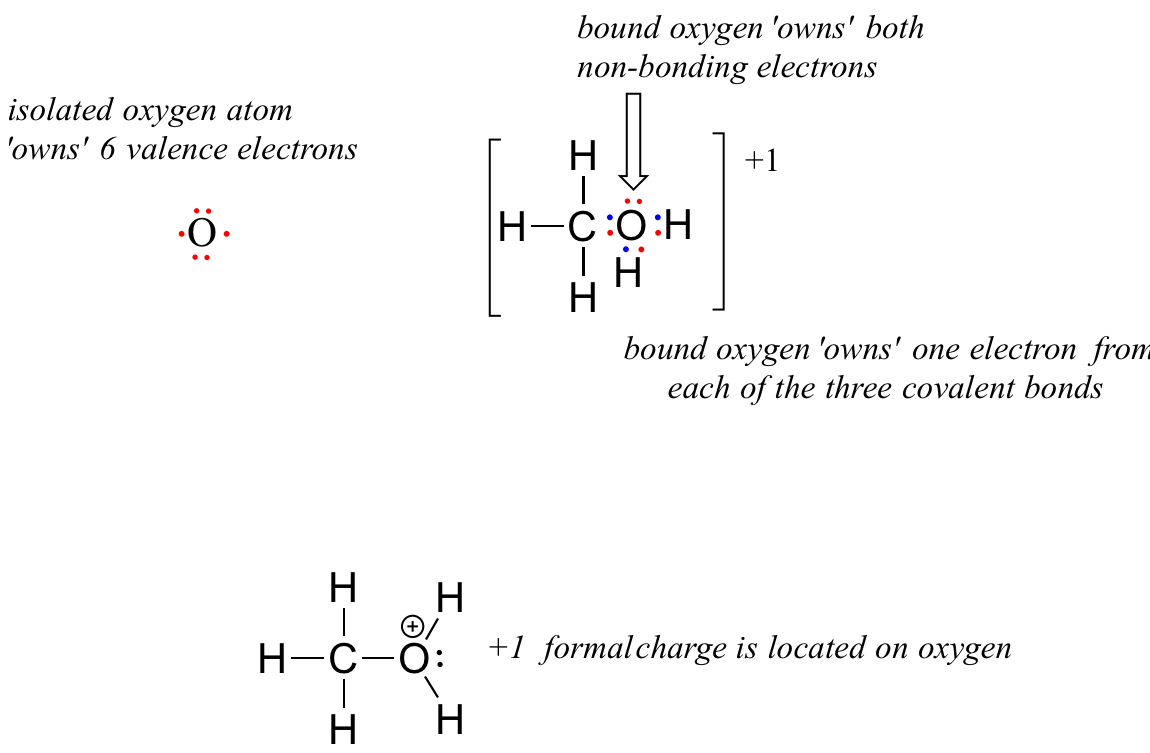
El oxígeno posee 2 electrones no enlazantes y 3 elecciones de unión, por lo que los cálculos formales de carga se convierten en:
carga formal sobre oxígeno =
(6 electrones de valencia en átomo aislado)
- (2 electrones no unibles)
- (½ x 6 electrones de unión)
= 6 - 2 - 3 = 1. Una carga formal de +1 se localiza en el átomo de oxígeno.
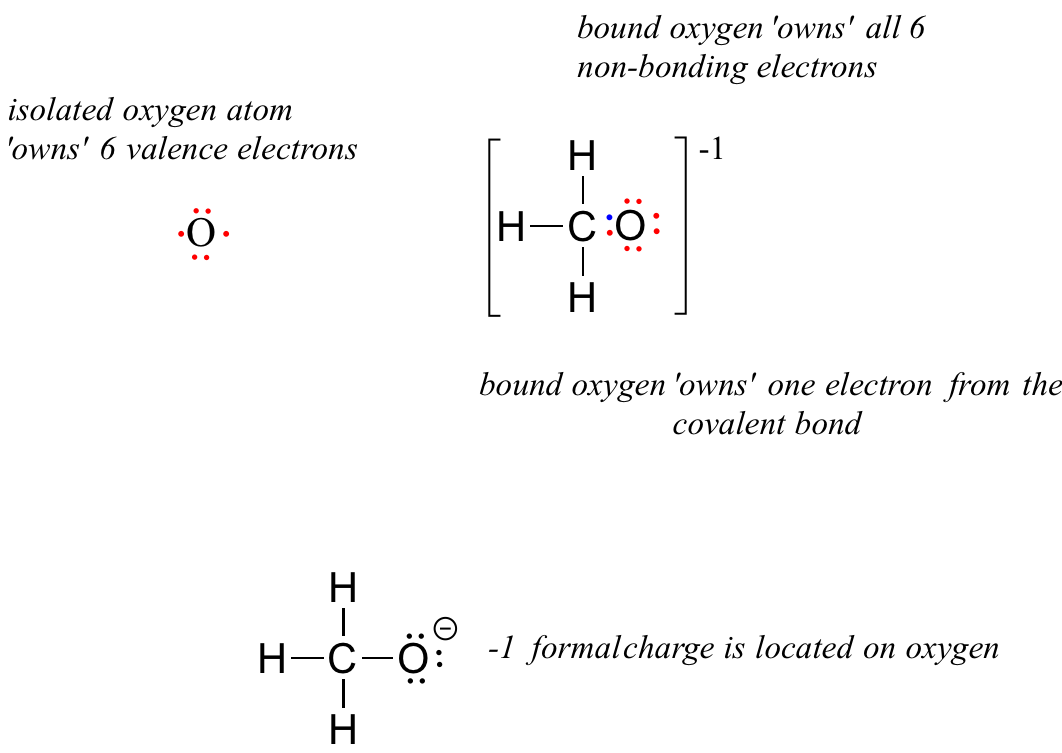
Para metóxido, la forma aniónica del metanol, el cálculo para el átomo de oxígeno es:
carga formal sobre oxígeno =
(6 electrones de valencia en átomo aislado)
- (6 electrones no unibles)
- (½ x 2 electrones de unión)
= 6 - 6 - 1 = -1. Una carga formal de -1 se localiza en el átomo de oxígeno.
Una regla muy importante a tener en cuenta es que la suma de las cargas formales sobre todos los átomos de una molécula debe ser igual a la carga neta en toda la molécula.
Al dibujar las estructuras de las moléculas orgánicas, es muy importante mostrar todos los cargos formales distintos de cero, teniendo claro dónde se encuentran las cargas. Una estructura a la que le faltan cargos formales distintos de cero no se dibuja correctamente, ¡y probablemente se marcará como tal en un examen!
En este punto, pensando en lo que aprendiste en química general, probablemente te estés preguntando “¿Qué pasa con los dipolos? ¿Un átomo de oxígeno en un enlace O-H no 'posee' más de la densidad de electrones que del hidrógeno, debido a su mayor electronegatividad?” Esto es absolutamente correcto, y posteriormente estaremos revisando el concepto de dipolos de enlace. Con el propósito de calcular las cargas formales, sin embargo, los dipolos de enlace no importan; siempre consideramos que los dos electrones en un enlace se comparten por igual, aunque eso no sea un reflejo exacto de la realidad química. Los cargos formales son solo eso: una formalidad, un método de contabilidad electrónica que está ligado al sistema Lewis para dibujar las estructuras de compuestos orgánicos e iones. Posteriormente, veremos cómo el concepto de carga formal puede ayudarnos a visualizar cómo reaccionan las moléculas orgánicas.
Por último, no se deje llevar a pensar que solo porque la carga neta en una estructura es cero no hay átomos con cargas formales: un átomo podría tener una carga formal positiva y otro una carga formal negativa, y la carga neta seguiría siendo cero. Los zwitteriones, como los aminoácidos, tienen cargas formales tanto positivas como negativas en diferentes átomos:

A pesar de que la carga neta sobre glicina es cero, sigue siendo necesario mostrar la ubicación de los cargos formales positivos y negativos.
Rellene todos los electrones de pares solitarios y cargas formales que faltan en las estructuras a continuación. Supongamos que todos los átomos tienen una completa capa de valencia de electrones. Los cargos netos se muestran fuera de los corchetes.
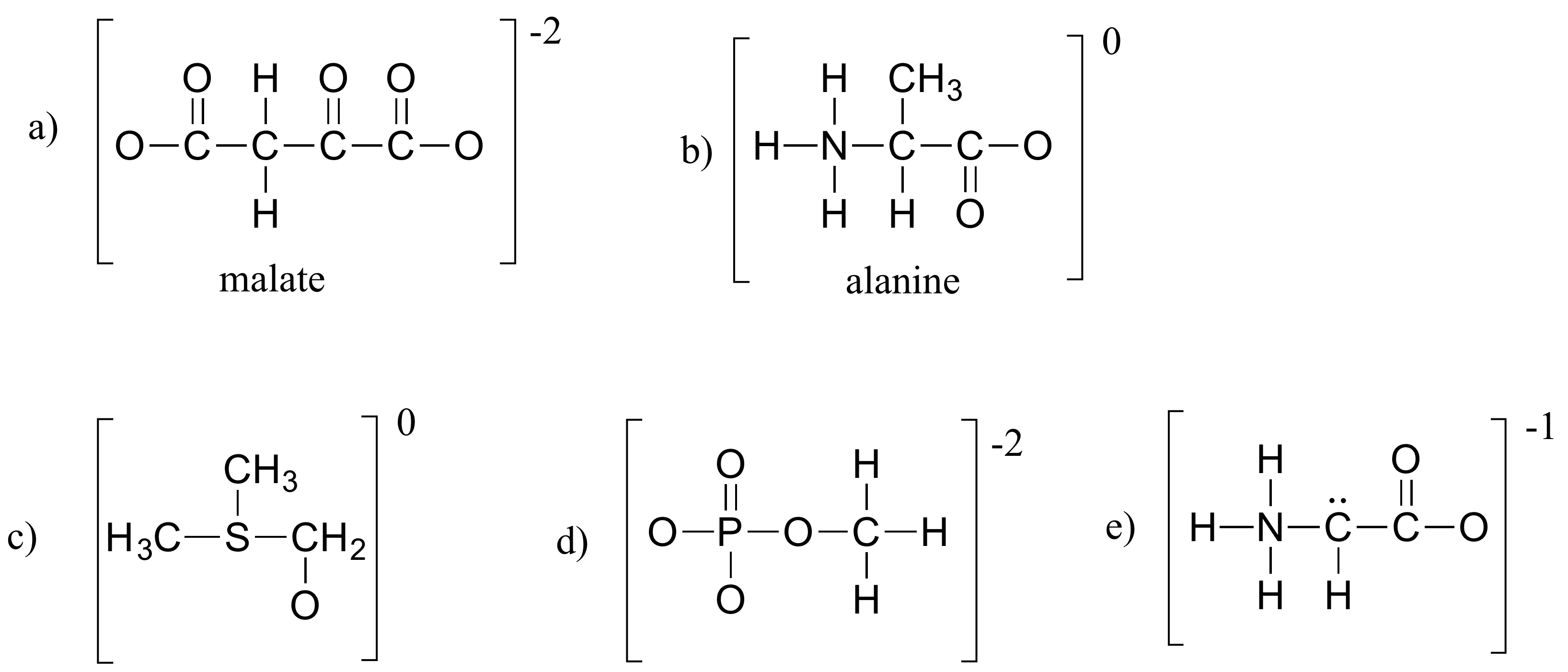
Soluciones a ejercicios
Patrones de unión comunes en estructuras orgánicas
Los métodos revisados anteriormente para dibujar estructuras de Lewis y determinar cargas formales sobre los átomos son un punto de partida esencial para un químico orgánico novato, y funcionan bastante voluntad cuando se trata de estructuras pequeñas y simples. Pero como puedes imaginar, estos métodos se vuelven irrazonablemente tediosos y consumen mucho tiempo cuando comienzas a lidiar con estructuras más grandes. Sería poco realista, por ejemplo, pedirte que dibujes la estructura de Lewis a continuación (de uno de los cuatro bloques de construcción de nucleósidos que componen el ADN) y determines todas las cargas formales sumando, sobre una base átomo por átomo, los electrones de valencia.
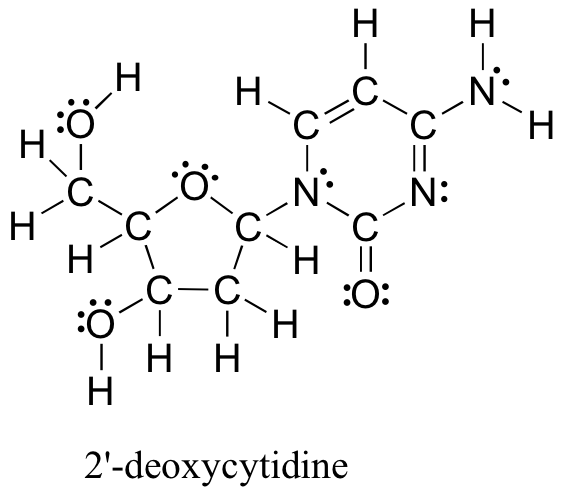
Y sin embargo, como químicos orgánicos, y especialmente como químicos orgánicos que se ocupan de moléculas biológicas, se espera que pronto dibujen la estructura de moléculas grandes como esta de manera regular. Claramente, es necesario desarrollar la capacidad de dibujar estructuras grandes de manera rápida y eficiente y determinar los cargos formales. Afortunadamente, esta habilidad no es terriblemente difícil de conseguir; todo lo que se necesita son algunos atajos y algo de práctica para reconocer patrones de unión comunes.
Empecemos por el carbono, el elemento más importante para los químicos orgánicos. Se dice que el carbono es tetravalente, es decir, tiende a formar cuatro enlaces. Si observas las estructuras simples del metano, metanol, etano, eteno y etino en las cifras de la sección anterior, deberías reconocer rápidamente que en cada molécula, el átomo de carbono tiene cuatro enlaces, y una carga formal de cero.
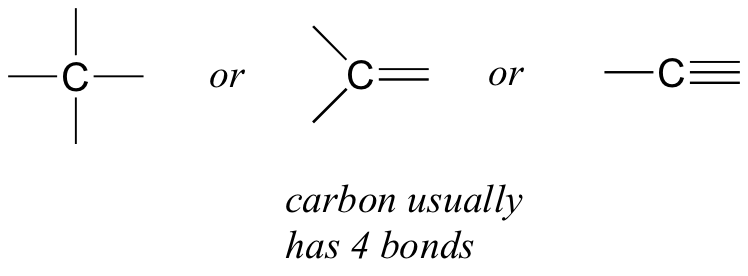
Este es un patrón que sostiene a lo largo de la mayoría de las moléculas orgánicas que veremos, pero también hay excepciones.
En el dióxido de carbono, el átomo de carbono tiene dobles enlaces al oxígeno en ambos lados (O=C=O). Más adelante en este capítulo y a lo largo de este libro veremos ejemplos de iones orgánicos llamados 'carbocationes' y carbaniones ', en los que un átomo de carbono lleva una carga formal positiva o negativa, respectivamente. Si un carbono tiene sólo tres bonos y una concha de valencia sin llenar (es decir, si no cumple con la regla del octeto), tendrá una carga formal positiva.
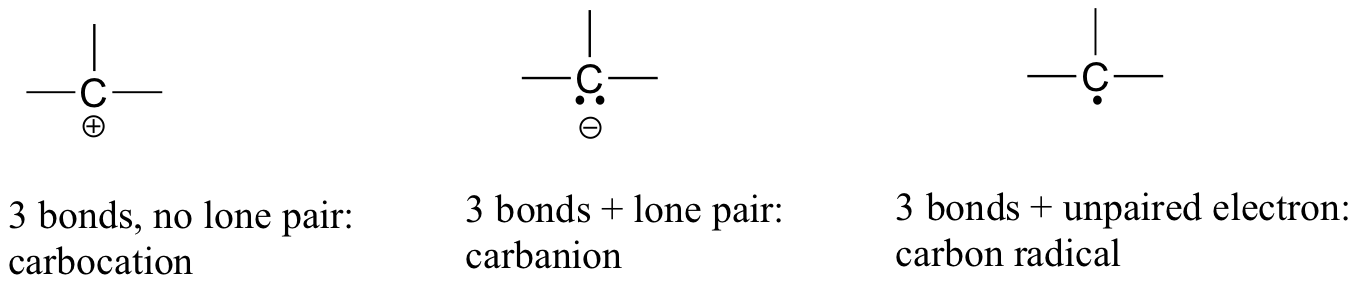
Si, por otro lado, tiene tres enlaces más un par solitario de electrones, tendrá una carga formal de -1. Otra posibilidad es un carbono con tres enlaces y un solo electrón desapareado (radical libre): en este caso, el carbono tiene una carga formal de cero. (Una última posibilidad es una especie altamente reactiva llamada 'carbeno', en la que un carbono tiene dos enlaces y un par solitario de electrones, dándole una carga formal de cero. Es posible que encuentres carbenos en cursos de química más avanzados, pero no se discutirán más en este libro).
Sin duda debe utilizar los métodos que ha aprendido para verificar que estos cargos formales sean correctos para los ejemplos dados anteriormente. Más importante aún, necesitará, antes de avanzar mucho más en su estudio de la química orgánica, simplemente reconocer estos patrones (y los patrones descritos a continuación para otros átomos) y poder identificar por inspección rápida los carbonos que llevan cargas formales positivas y negativas.
El patrón para los hidrógenos es fácil: los átomos de hidrógeno tienen un solo enlace, y ninguna carga formal. Las excepciones a esta regla son el protón, H +, y el ion hidruro, H -, que es un protón más dos electrones. Debido a que nos estamos concentrando en este libro sobre la química orgánica aplicada a los seres vivos, sin embargo, no vamos a estar viendo protones e hidruros 'desnudos' como tales, porque son demasiado reactivos para estar presentes en esa forma en solución acuosa. Sin embargo, la idea de un protón será muy importante cuando discutamos la química ácido-base, y la idea de un ion hidruro será muy importante mucho más adelante en el libro cuando discutamos las reacciones de oxidación y reducción orgánicas. Sin embargo, como regla general, todos los átomos de hidrógeno en las moléculas orgánicas tienen un enlace, y ninguna carga formal.
Pasemos a continuación a los átomos de oxígeno. Por lo general, verá un enlace de oxígeno de tres maneras, todas las cuales cumplen con la regla del octeto.
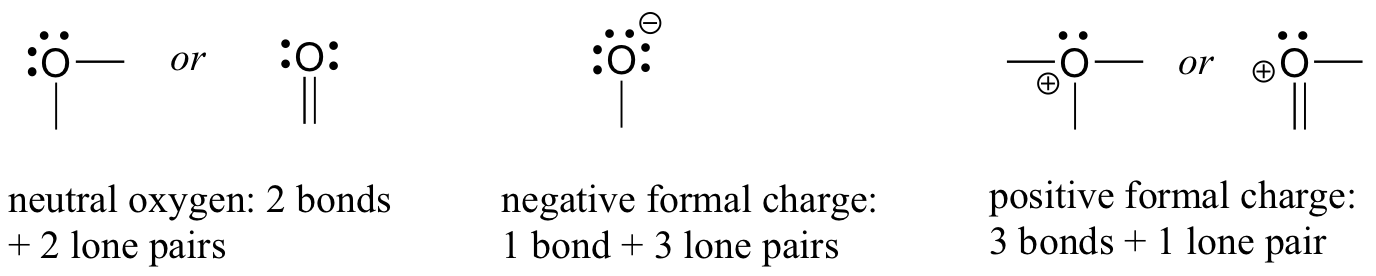
Si un átomo de oxígeno t tiene dos enlaces y dos pares solitarios, como en el agua, tendrá una carga formal de cero. Si tiene un enlace y tres pares solitarios, como en el ion hidróxido, tendrá una carga formal de-1. Si tiene tres enlaces y un par solitario, como en el ion hidronio, tendrá una carga formal de +1.
Cuando lleguemos a nuestra discusión sobre la química de los radicales libres en el capítulo 17, veremos otras posibilidades, como donde un átomo de oxígeno tiene un enlace, un par solitario y un electrón desapareado (radical libre), dándole una carga formal de cero. Por ahora, sin embargo, concéntrese en los tres principales ejemplos no radicales, ya que estos darán cuenta de prácticamente todo lo que vemos hasta el capítulo 17.
El nitrógeno tiene dos patrones de unión principales, los cuales cumplen con la regla del octeto:
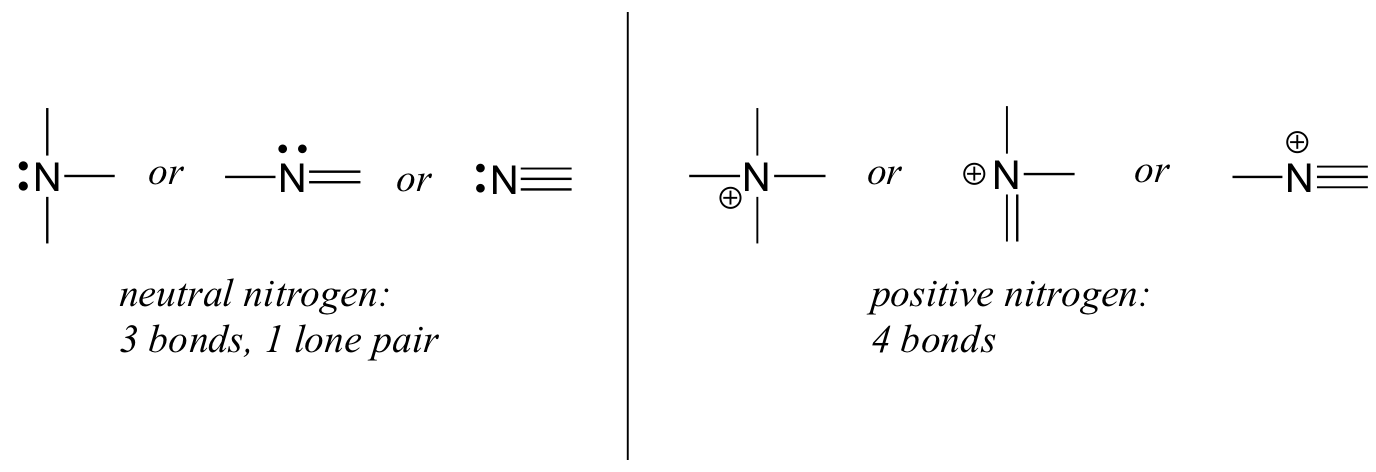
Si un nitrógeno tiene tres enlaces y un par solitario, tiene una carga formal de cero. Si tiene cuatro bonos (y ningún par solitario), tiene un cargo formal de +1. En un patrón de unión bastante poco común, el nitrógeno cargado negativamente tiene dos enlaces y dos pares solitarios.
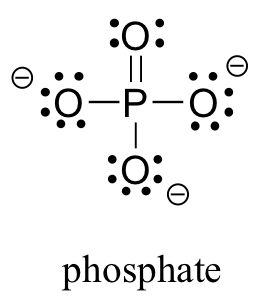
Dos elementos de la tercera fila se encuentran comúnmente en moléculas orgánicas biológicas: azufre y fósforo. Aunque ambos elementos tienen otros patrones de unión que son relevantes en la química de laboratorio, en un contexto biológico el azufre casi siempre sigue el mismo patrón de unión/carga formal que el oxígeno, mientras que el fósforo está presente en forma de ion fosfato (PO 4 3-), donde tiene cinco enlaces (casi siempre al oxígeno), sin pares solitarios, y una carga formal de cero. Recuerde que los átomos de los elementos en la tercera fila y abajo en la tabla periódica tienen 'conchas de valencia expandidas' con d orbitales disponibles para la unión, y la regla del octeto no aplica.
Finalmente, los halógenos (flúor, cloro, bromo y yodo) son muy importantes en la química orgánica de laboratorio y medicinal, pero menos comunes en las moléculas orgánicas naturales. Los halógenos en los compuestos orgánicos generalmente se ven con un enlace, tres pares solitarios y una carga formal de cero. En ocasiones, especialmente en el caso del bromo, nos encontraremos con especies reactivas en las que el halógeno tiene dos enlaces (generalmente en un anillo de tres miembros), dos pares solitarios, y una carga formal de +1.
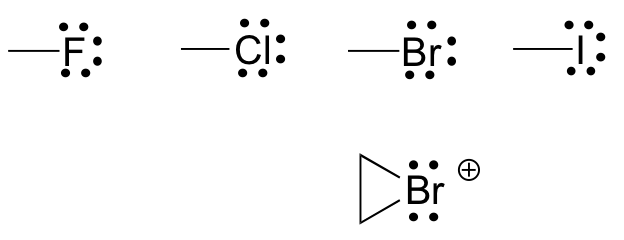
Estas reglas, si se aprenden e internalizan para que ni siquiera necesites pensar en ellas, te permitirán dibujar grandes estructuras orgánicas, completas con cargos formales, con bastante rapidez.
Una vez que hayas captado la idea de dibujar estructuras de Lewis, no siempre es necesario dibujar pares solitarios sobre heteroátomos, ya que puedes suponer que el número adecuado de electrones está presente alrededor de cada átomo para que coincida con la carga formal indicada (o la falta de ella). Ocasionalmente, sin embargo, se dibujan parejas solitarias si hacerlo ayuda a que una explicación sea más clara.
Dibuje una estructura que corresponda a cada una de las siguientes fórmulas moleculares, utilizando los patrones de unión comunes cubiertos anteriormente. Asegúrese de incluir todos los pares solitarios y cargas formales cuando corresponda, y asuma que todos los átomos tienen una capa de valencia completa de electrones. Es posible más de una respuesta correcta para cada uno, por lo que querrás consultar tus respuestas con tu instructor o tutor.
a) C 5 H 10 O b) C 5 H 8 O c) C 6 H 8 NO + d) C 4 H 3 O 2 -
Soluciones a ejercicios
Uso de la convención de 'estructura linea'
Si miras hacia el futuro en este y otros libros la forma en que se dibujan los compuestos orgánicos, verás que las cifras son algo diferentes de las estructuras de Lewis a las que estás acostumbrado a ver en tu libro de química general. En algunas fuentes, verá estructuras condensadas para moléculas más pequeñas en lugar de estructuras completas de Lewis:
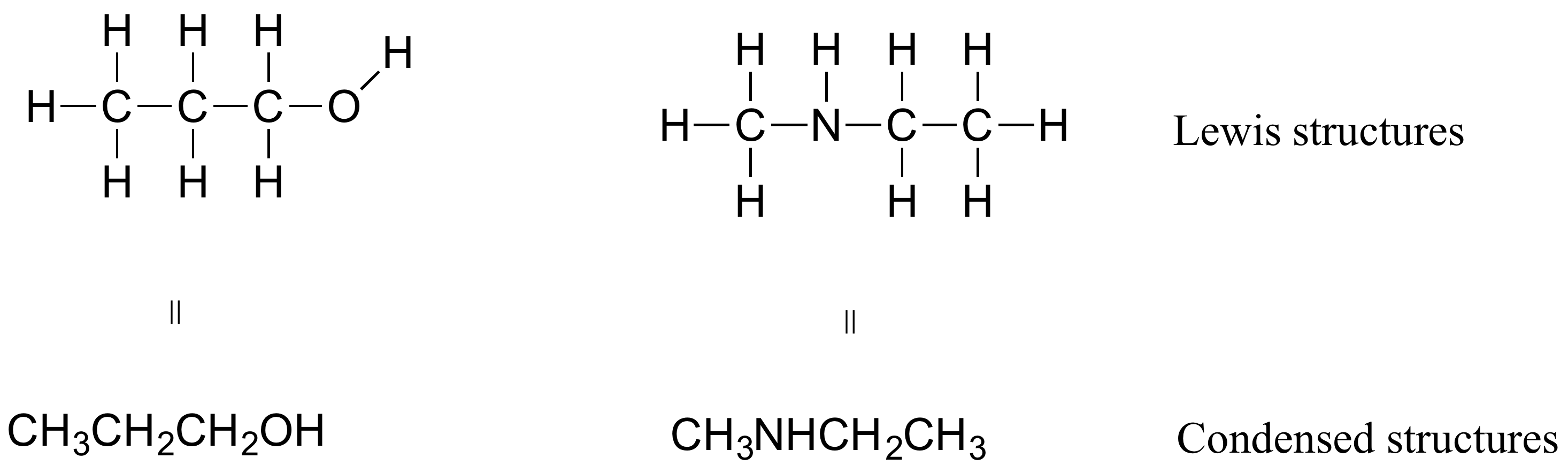
Más comúnmente, los químicos orgánicos y biológicos utilizan una convención de dibujo abreviada llamada estructuras de líneas. La convención es bastante simple y hace que sea más fácil dibujar moléculas, pero las estructuras de líneas requieren un poco de acostumbrarse. Los átomos de carbono no están representados por una C mayúscula, sino por una 'esquina' entre dos enlaces, o un extremo libre de un enlace. Las moléculas de cadena abierta generalmente se dibujan en forma de 'zig-zig'. Los hidrógenos unidos a los carbonos generalmente no se muestran: más bien, como los pares solitarios, simplemente están implícitos (a menos que se muestre una carga formal positiva, se supone que todos los carbonos tienen un octeto completo de electrones de valencia). Se muestran los hidrógenos unidos a nitrógeno, oxígeno, azufre o cualquier otra cosa que no sea carbono, pero generalmente se dibujan sin mostrar el enlace. Los siguientes ejemplos ilustran la convención.
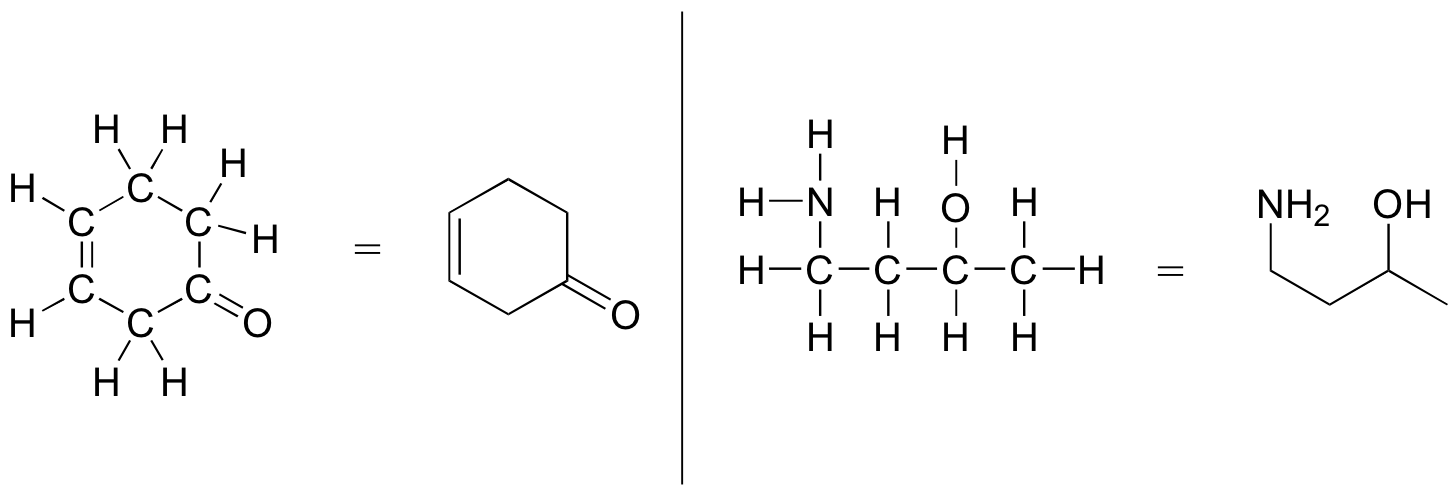
Como puede ver, la estructura de líneas 'recortadas hacia abajo' hace que sea mucho más fácil ver la estructura básica de la molécula y las ubicaciones donde hay algo más que los enlaces simples C-C y C-H. Para moléculas biológicas más grandes y complejas, resulta poco práctico usar estructuras completas de Lewis. Por el contrario, las moléculas muy pequeñas como el etano deben ser dibujadas con sus estructuras completas de Lewis o condensadas.
En ocasiones, uno o más átomos de carbono en una estructura lineal se representarán con una C mayúscula, si hacerlo hace que una explicación sea más fácil de seguir. Si etiquetas un carbono con una C, también debes extraer los hidrógenos para ese carbono.
Una buena manera de probar su comprensión de la convención de estructura de líneas es determinar el número de átomos de hidrógeno en una molécula a partir de su estructura de línea. Haga esto para las estructuras a continuación.

Ejercicio 1.7
a) Dibujar una estructura lineal para la base de ADN 2-desoxicitidina (la estructura completa se mostró anteriormente)
b) Dibujar estructuras lineales para histidina (un aminoácido) y piridoxina (Vitamina B 6).
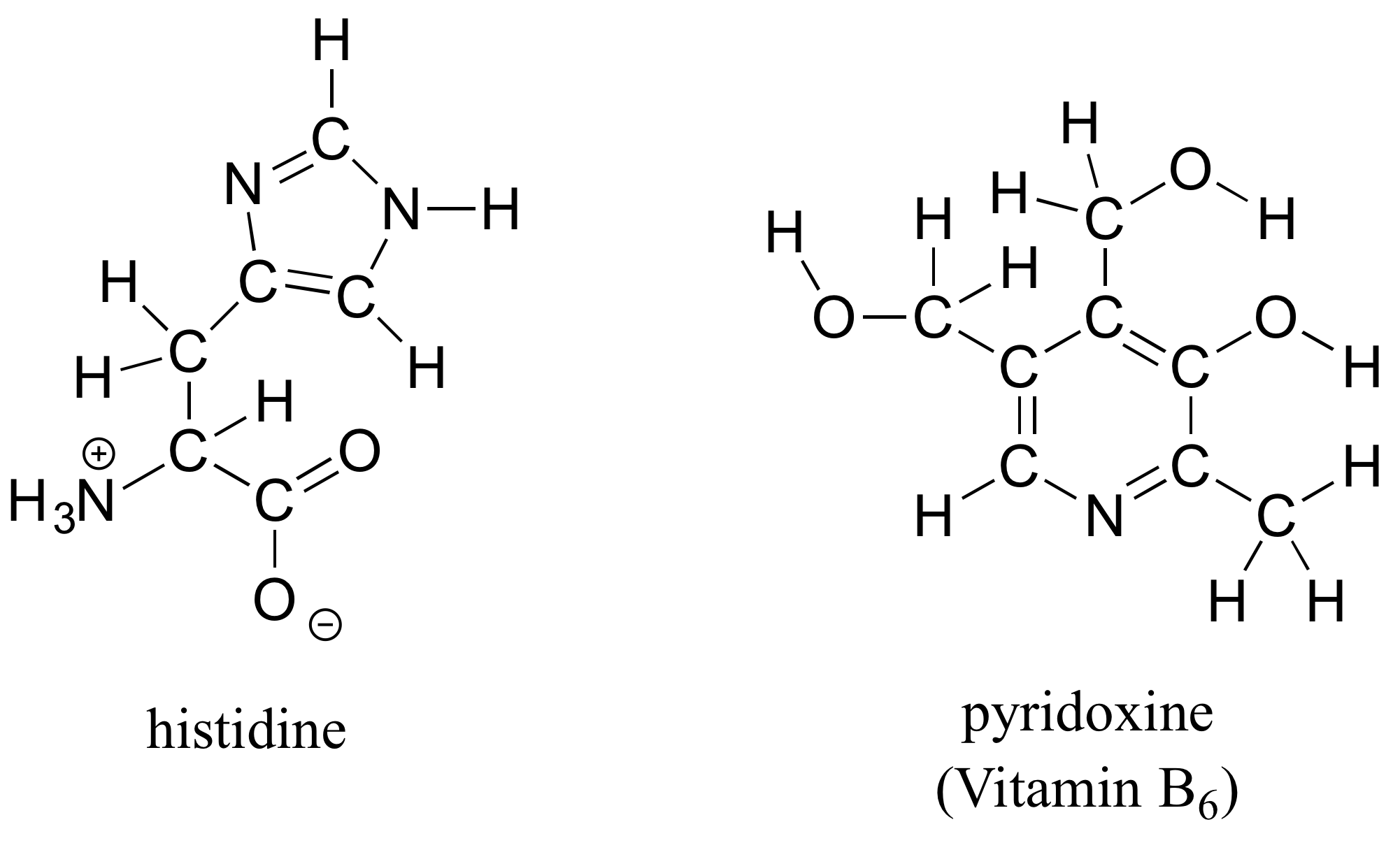
Ejercicio 1.8
Agregue cargos formales distintos de cero al dibujo estructural a continuación. El cargo neto es -2.

Ejercicio 1.9
Encuentre, en cualquier parte de los capítulos 2-17 de este libro de texto, un ejemplo de cada uno de los patrones de unión comunes que se especifican a continuación. Consulta tus respuestas con tu instructor o tutor.
a) carbono con un doble enlace, dos enlaces simples, sin pares solitarios y cero carga formal
b) oxígeno con dos enlaces simples, dos pares solitarios y carga formal cero
c) oxígeno con un doble enlace, dos pares solitarios y carga formal cero
d) nitrógeno con un doble enlace, dos enlaces simples y una carga formal +1
e) oxígeno con un enlace sencillo, tres pares solitarios y una carga formal negativa
Soluciones a ejercicios
Isómeros constitucionales
Ahora que hemos revisado cómo dibujar estructuras de Lewis y aprendimos el atajo de estructura de líneas, es un buen momento para aprender sobre el concepto de isómeros constitucionales. Imagínese si se le pidiera dibujar una estructura (Lewis o línea) para un compuesto con la fórmula molecular C 4 H 10. Esto no sería difícil, simplemente podrías dibujar:
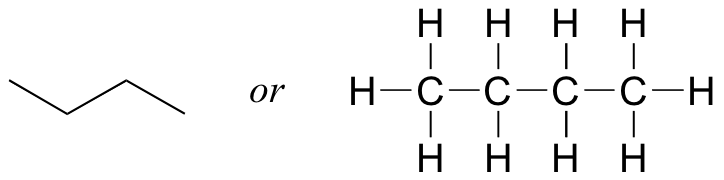
Pero cuando comparaste tu respuesta con la de una compañera de clase, ella pudo haber dibujado esta estructura:
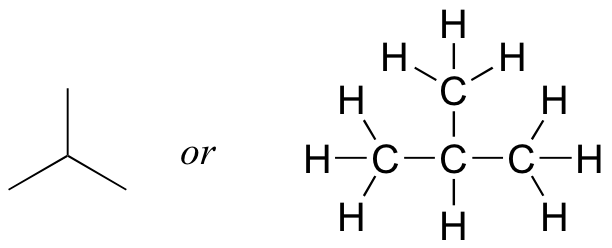
¿Quién es correcto? La respuesta, por supuesto, es que los dos lo son. Una fórmula molecular solo te dice cuántos átomos de cada elemento están presentes en el compuesto, no cuál es la conectividad real de átomo a átomo. A menudo hay muchas estructuras posibles diferentes para una fórmula molecular. Los compuestos que tienen la misma fórmula molecular pero diferente conectividad se denominan isómeros constitucionales (a veces también se usa el término 'isómero estructural'). El término griego 'iso' significa 'misma'.
La fructosa y la glucosa, dos tipos de moléculas de azúcar, son isómeros constitucionales con la fórmula molecular C 6 H 12 O 6.
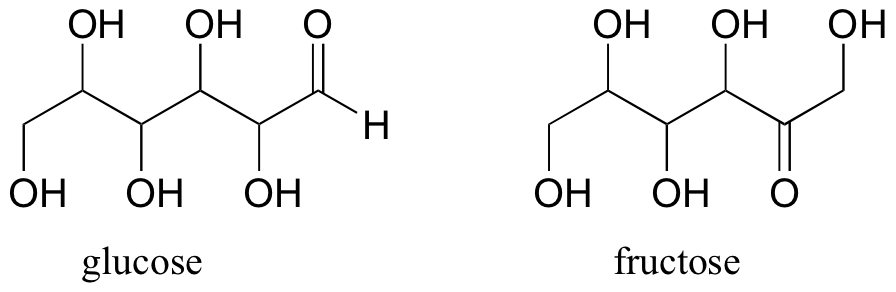
Posteriormente, veremos otros tipos de isómeros que tienen la misma fórmula molecular y la misma conectividad, pero son diferentes en otros aspectos.
Dibujar un isómero constitucional de etanol, CH 3 CH 2 OH.
Ejercicio 1.11
Dibujar todos los posibles isómeros constitucionales con la fórmula molecular dada.
a) C 5 H 12
b) C 4 H 10 O
c) C 3 H 9 N
Soluciones a ejercicios
Tutoriales en video de Khan Academy:
Representando estructuras de moléculas orgánicas
Dibujar estructuras de Lewis Dot y determinar cargos formales


