3.2: Conformaciones de moléculas orgánicas de cadena abierta
- Page ID
- 72639
Antes de comenzar nuestra exploración de la estereoquímica y la quiralidad, primero debemos considerar el tema del isomerismo conformacional, que tiene que ver con la rotación sobre los enlaces simples.
Aprendimos en la sección 2.1 que los enlaces simples en las moléculas orgánicas son libres de rotar, debido a la naturaleza 'de extremo a extremo' (sigma) de su superposición orbital. Considere el enlace carbono-oxígeno en etanol, por ejemplo: con una rotación de 180 o alrededor de este enlace, la forma de la molécula se vería bastante diferente:
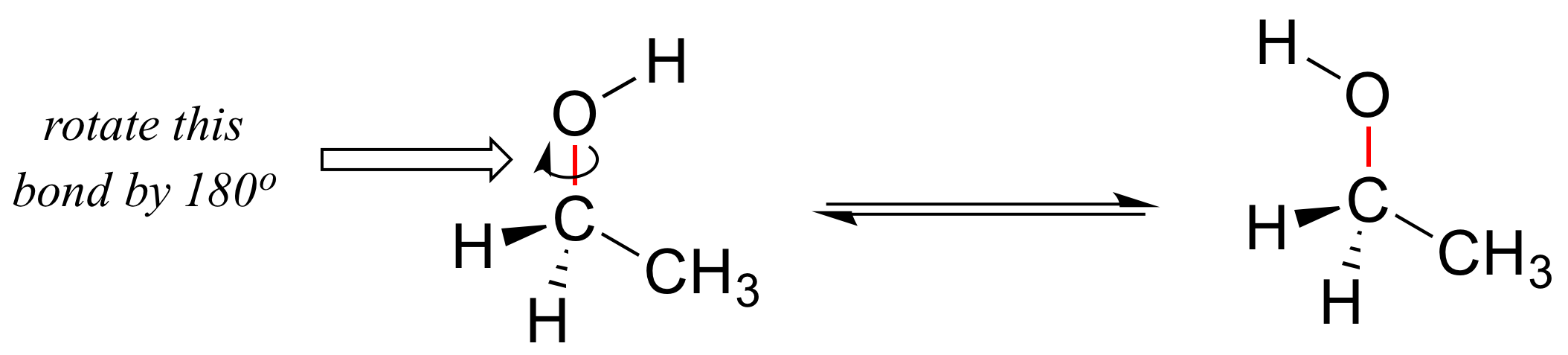
O etano: la rotación sobre el enlace sigma carbono-carbono da como resultado muchas disposiciones tridimensionales diferentes de los átomos.
Estas diferentes disposiciones, resultantes de la rotación del enlace sigma, se denominan en la química orgánica como conformaciones. Cualquier conformación específica se llama isómero conformacional, o conformador.
Para visualizar mejor las diferentes conformaciones de una molécula, es conveniente utilizar una convención de dibujo llamada la proyección Newman. En una proyección de Newman, miramos longitudinalmente hacia abajo un enlace específico de interés, en este caso, el enlace carbono-carbono en etano. Se representa el átomo 'frontal' como un punto, y el átomo 'posterior' como un círculo más grande.

Modo interactivo de las conformaciones de etanosl
Los seis enlaces carbono-hidrógeno se muestran como líneas continuas que sobresalen de los dos carbonos. Tenga en cuenta que no dibujamos enlaces como cuñas sólidas o discontinuas en una proyección de Newman.
Mirando hacia abajo el enlace C-C de esta manera, el ángulo formado entre un enlace C-H en el carbono frontal y un enlace C-H en el carbono posterior se conoce como ángulo diedro. (El ángulo diedro entre la manecilla de horas y la manecilla de minutos en un reloj es de 0 o al mediodía, 90 o a las 3:00, y así sucesivamente).
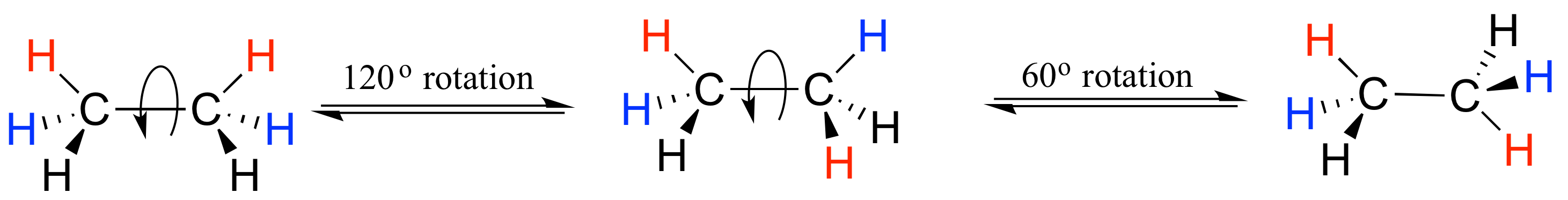
La conformación de menor energía del etano, mostrada en la figura anterior, se denomina conformación 'escalonada': todos los ángulos diedros son de 60 o, y se maximiza la distancia entre los enlaces C-H frontal y posterior.
Si ahora giramos el grupo CH 3 frontal 60° en el sentido de las agujas del reloj, la molécula se encuentra en la conformación 'eclipsada' de mayor energía, donde los ángulos diedros son todos 0 o (escalonamos ligeramente los enlaces en nuestro dibujo de proyección de Newman para que podamos verlos todos).
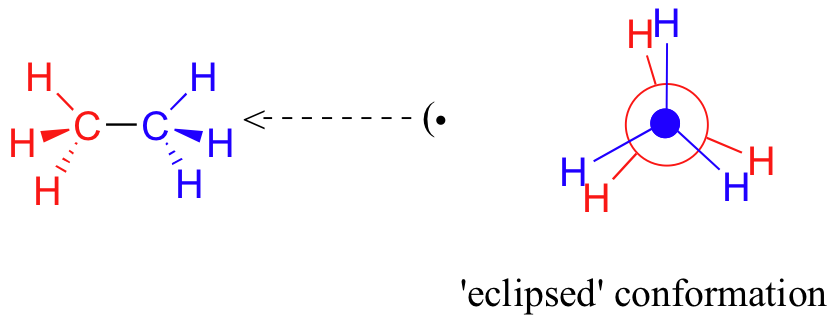
La energía de la conformación eclipsada, donde los electrones en los enlaces C-H frontal y posterior están más cerca entre sí, es aproximadamente 12 kJ/mol mayor que la de la conformación escalonada.
Otra rotación de 60 ° devuelve la molécula a una segunda conformación escalonada. Este proceso se puede continuar alrededor del círculo de 360 °, con tres conformaciones eclipsadas posibles y tres conformaciones escalonadas, además de un número infinito de conformaciones entre estos dos extremos.
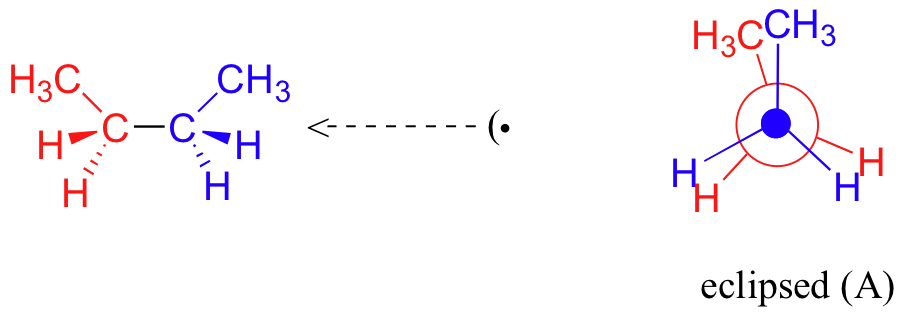
Ahora consideremos el butano, con su cadena de cuatro carbonos. Ahora hay tres enlaces giratorios carbono-carbono a considerar, pero nos centraremos en el enlace medio entre C 2 y C 3. A continuación se presentan dos representaciones de butano en una conformación que pone a los dos grupos CH 3 (C1 y C 4) en la posición eclipsada, con los dos enlaces C-C en un ángulo diedro de 0 o.
Modelo interactivo de conformaciones de butano
Si giramos el carbono frontal, (azul) 60 ° en el sentido de las agujas del reloj, la molécula de butano se encuentra ahora en una conformación escalonada.
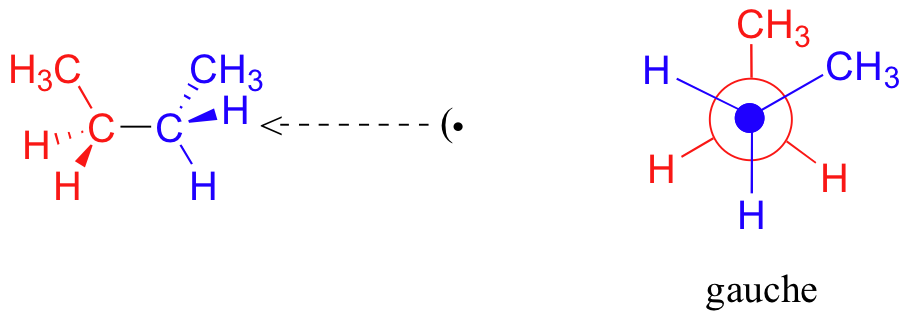
Esto se conoce más específicamente como la conformación gauche del butano. Observe que aunque están escalonados, los dos grupos metilo no están tan separados como podrían estar.
Una rotación adicional de 60° nos da una segunda conformación eclipsada (B) en la que ambos grupos metilo se alinean con átomos de hidrógeno.
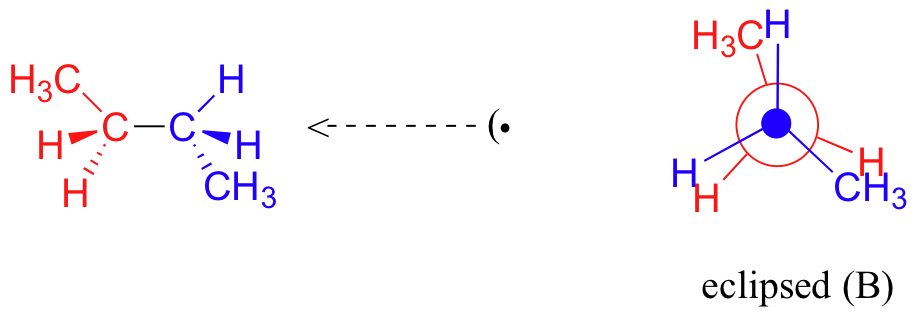
Una rotación más de 60 produce otra conformación escalonada llamada anti conformación, donde los dos grupos metilo se posicionan uno frente al otro (un ángulo diedro de 180 o).
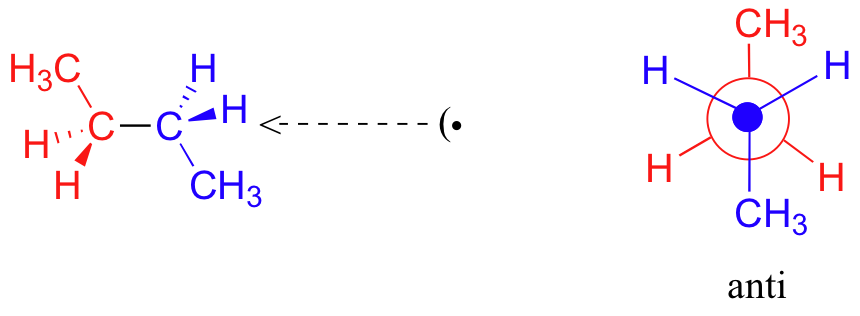
Al igual que con el etano, las conformaciones escalonadas del butano son “valles” energéticos, y las conformaciones eclipsadas son “picos” energéticos. Sin embargo, en el caso del butano hay dos valles diferentes, y dos picos diferentes. La conformación gauche es un valle de energía mayor que la anti conformación debido a la deformación estérica, que es la interacción repulsiva causada por los dos grupos metilo voluminosos que se ven forzados demasiado cerca entre sí. Claramente, la deformación estérica es menor en la anti conformación. De la misma manera, la cepa estérica provoca que la conformación A eclipsada -donde los dos grupos metilo están lo más cerca posible- sea mayor en energía que las dos conformaciones B eclipsadas.
El siguiente diagrama resume las energías relativas para las diversas conformaciones eclipsadas, escalonadas y gauches.
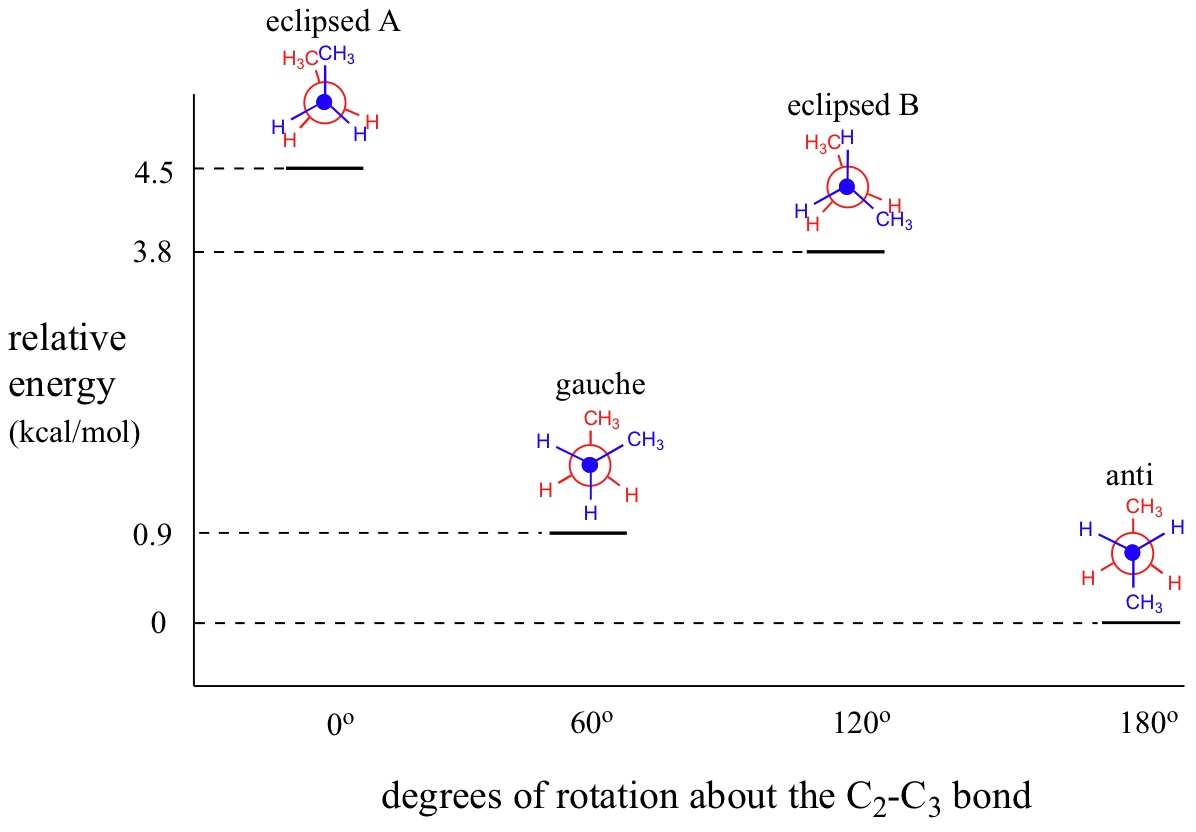
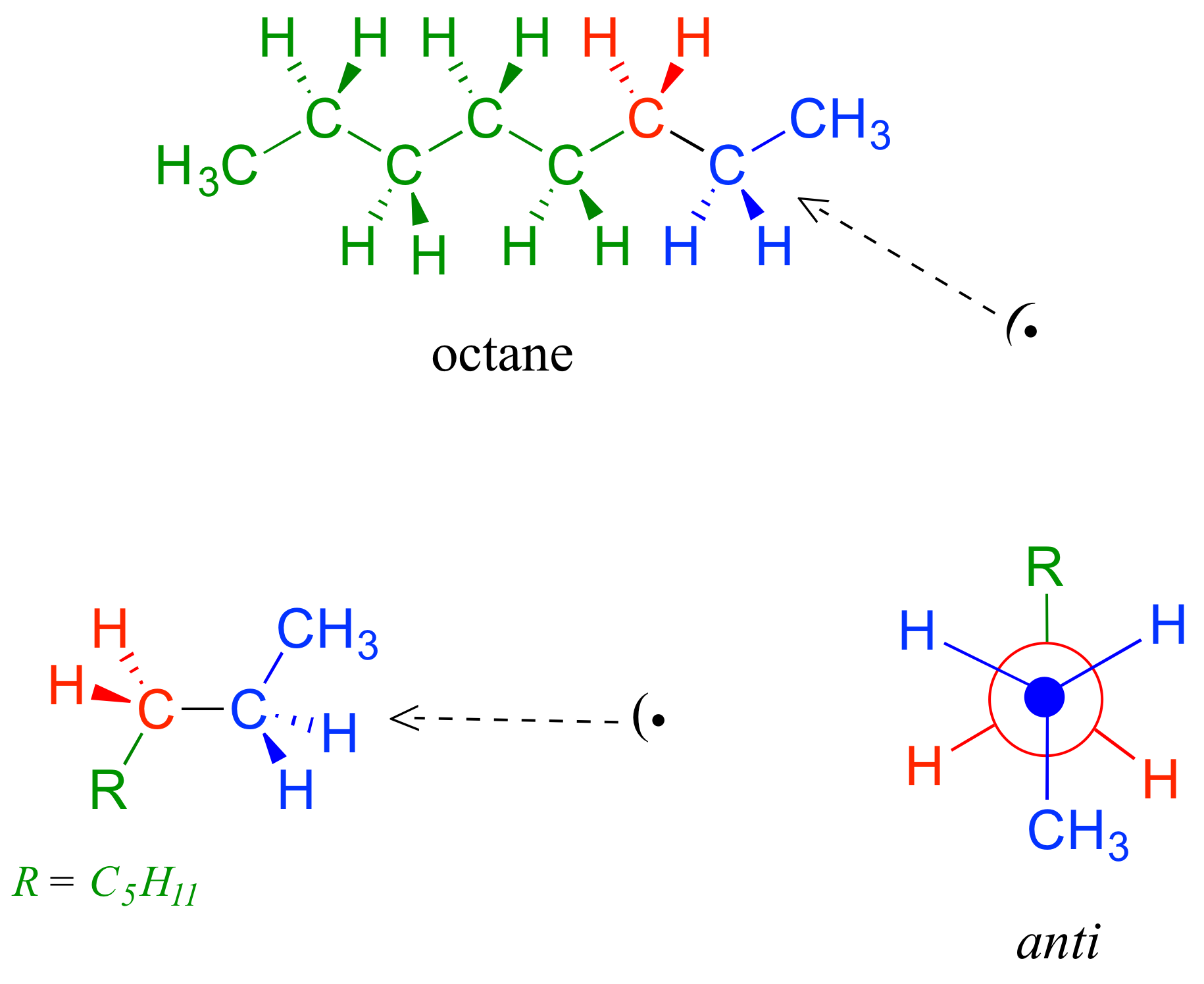
Debido a que la anti conformación es la más baja en energía (y también simplemente para facilitar el estirado), es convencional dibujar alcanos de cadena abierta en forma de 'zigzag', lo que implica anti conformación en todos los enlaces carbono-carbono. La siguiente figura muestra, como ejemplo, una proyección de Newman mirando hacia abajo el enlace C2-C3 de octano.
Usando la rotación libre alrededor de los enlaces simples C-C, muestran que (R, S) y (S, R) -ácido tartárico son moléculas idénticas.
Ejercicio 3.2
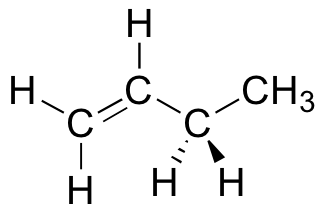
Dibuja una proyección Newman, mirando hacia abajo el enlace C 2 -C 3, de 1-buteno en la conformación que se muestra a continuación (C 2 debe ser tu carbono frontal).
Soluciones a los ejercicios
Conferencias en línea de Khan Academy Proyecciones de
Newman parte I Proyecciones de
Newman parte II
Colaboradores y Atribuciones
- Template:ContribOCBESoderberg
- Layne Morsch (University of Illinois Springfield)


