3.3: Conformaciones de moléculas orgánicas cíclicas
- Page ID
- 72573
Navega por un libro de texto de bioquímica y verás cualquier cantidad de moléculas con estructuras cíclicas. Muchas de estas estructuras cíclicas son aromáticas, y por lo tanto planas. Muchos otros, sin embargo, están compuestos por átomos hibridados sp 3, y son estas estructuras cíclicas las que son el tema de discusión en esta sección.
Al discutir moléculas orgánicas cíclicas, a menudo usaremos azúcares como ejemplos, porque son moléculas tan importantes en la química biológica. Es importante recordar que muchos azúcares existen en solución acuosa como formas cíclicas y de cadena abierta. No es necesario preocuparse en este punto por entender cómo se nombra la forma cíclica, o la reacción por la que ocurre la ciclación, esto se cubrirá en el capítulo 10.
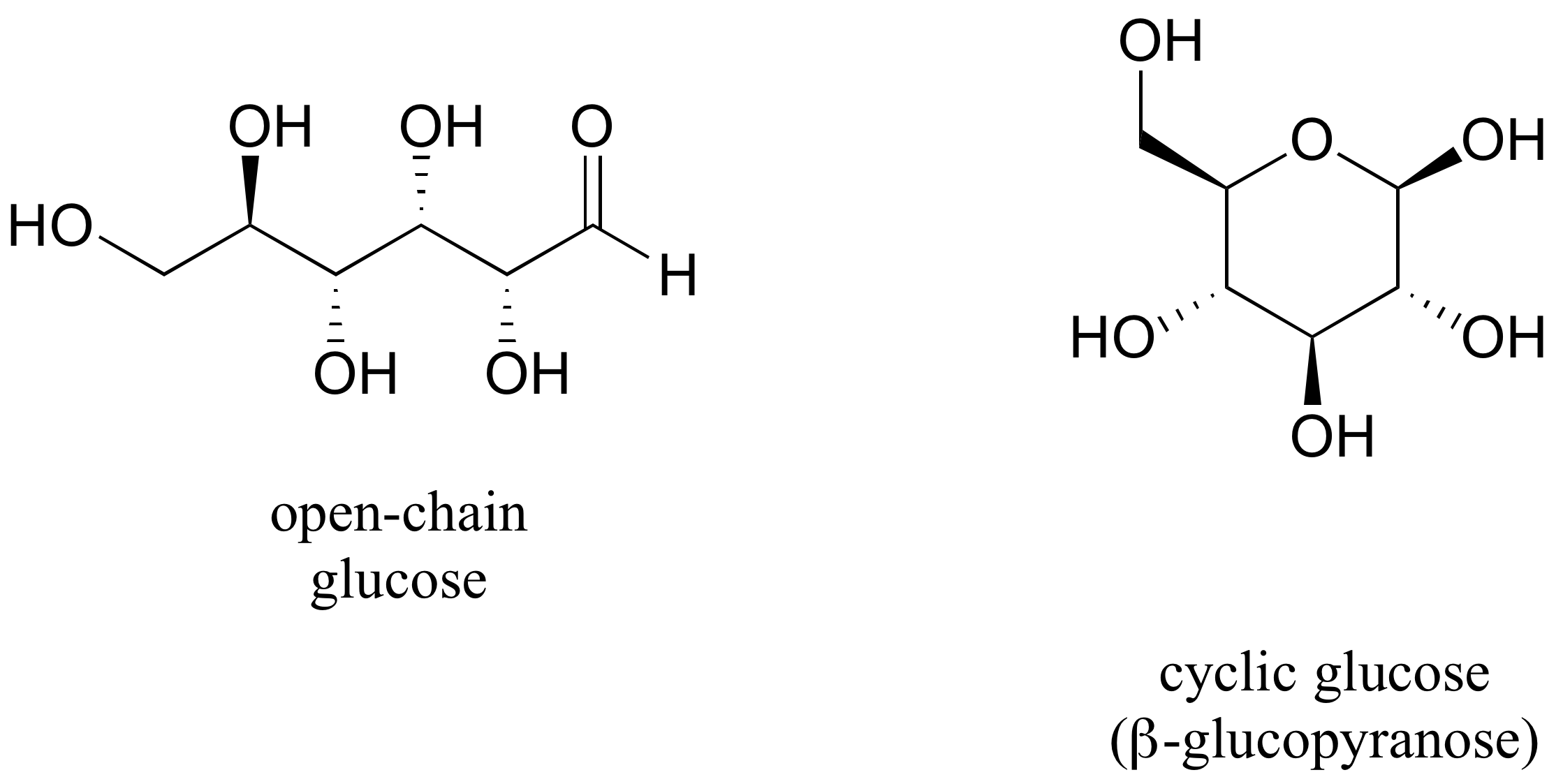
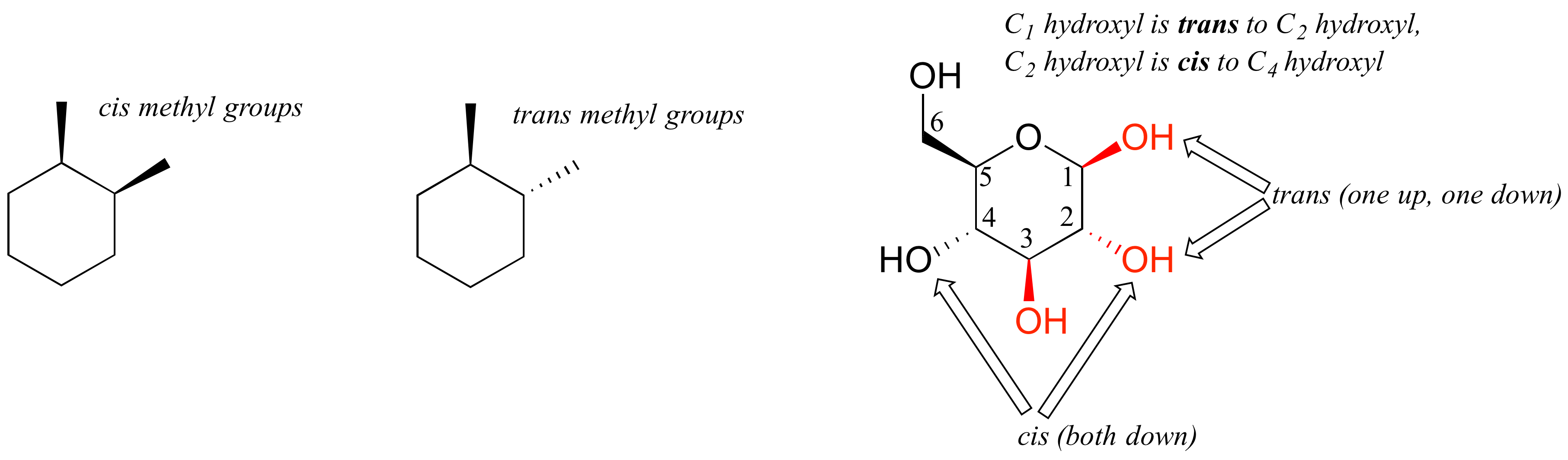
Una cosa que debes notar en la estructura cíclica que se muestra arriba es que los átomos o grupos unidos a los carbonos del anillo tetraédrico están apuntando hacia arriba (fuera del plano de la página) o hacia abajo (en el plano de la página), como lo indica el uso de enlaces punteados o sólidos en cuña. Cuando dos sustituyentes en el mismo anillo están ambos apuntando hacia el mismo lado del anillo, se dice que son cis entre sí. Cuando se señalan a lados opuestos, se dice que son trans entre sí.
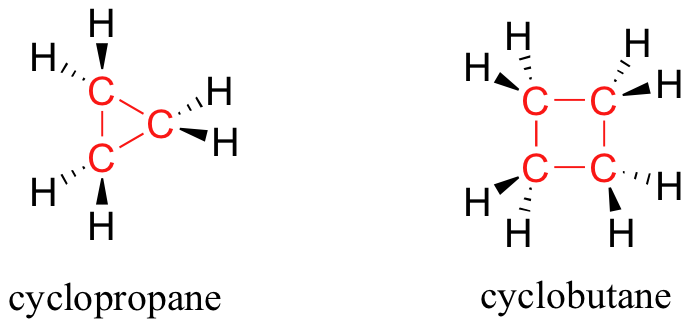
Las estructuras de anillo en moléculas orgánicas suelen ser de cinco o seis miembros. Los anillos de tres y cuatro miembros se encuentran ocasionalmente en la naturaleza, pero son significativamente más altos en energía. La inestabilidad relativa de estas estructuras anulares más pequeñas puede explicarse por un concepto llamado deformación angular, en el que los cuatro enlaces alrededor de los carbonos hibridados sp 3 son forzados a salir de sus ángulos tetraédricos preferidos.
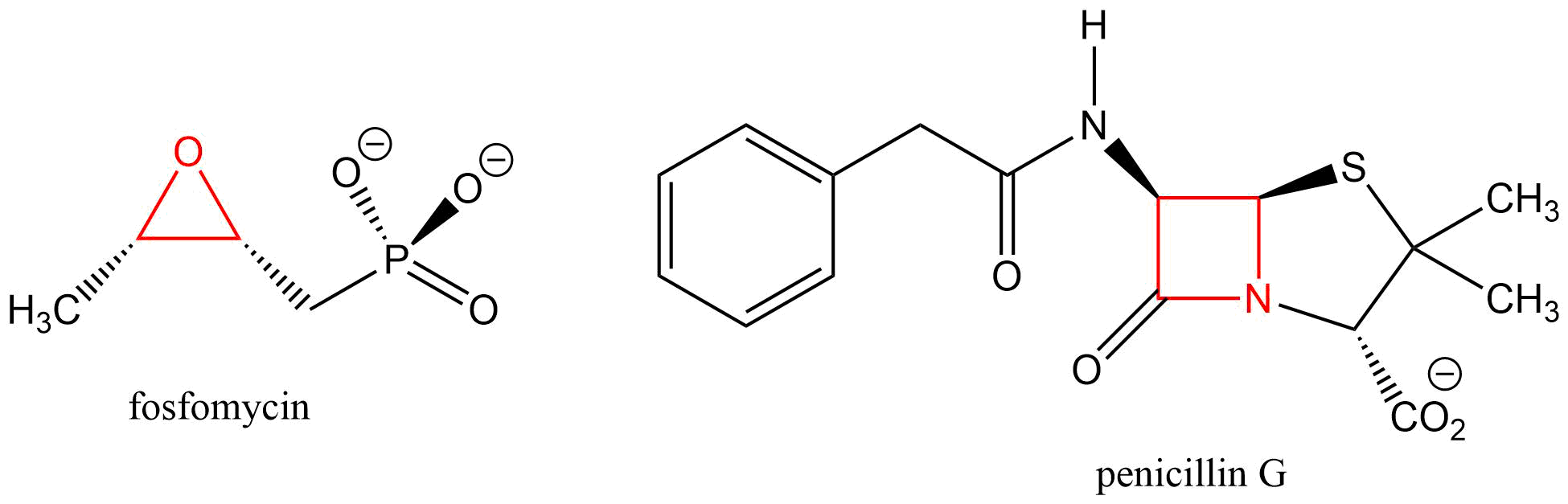
Si uno de los enlaces carbono-carbono se rompe, el anillo se abrirá por resorte, liberando energía a medida que los enlaces reafirman su geometría tetraédrica preferida. La efectividad de dos antibióticos, fosfomicina y penicilina, se debe en gran parte a la alta reactividad de los anillos de tres y cuatro miembros en sus estructuras.
En las estructuras de cicloalcanos de seis miembros, los ángulos de unión son cercanos al tetraédrico y, por lo tanto, la deformación del anillo no es un factor; estos anillos son de hecho muy estables. Sin embargo, los dibujos 'planos' que hemos estado usando hasta ahora no muestran con precisión la forma tridimensional real de un anillo de cinco o seis miembros. Si el ciclohexano fuera realmente plano, los ángulos de enlace tendrían que distorsionarse de 109.5 ° a 120 °. Sin embargo, si construyes un modelo, encontrarás que cuando rotas los enlaces carbono-carbono para poner el anillo en una forma que se asemeja a una silla de playa reclinable, todos los enlaces carbono-carbono pueden asumir ángulos de unión tetraédricos.
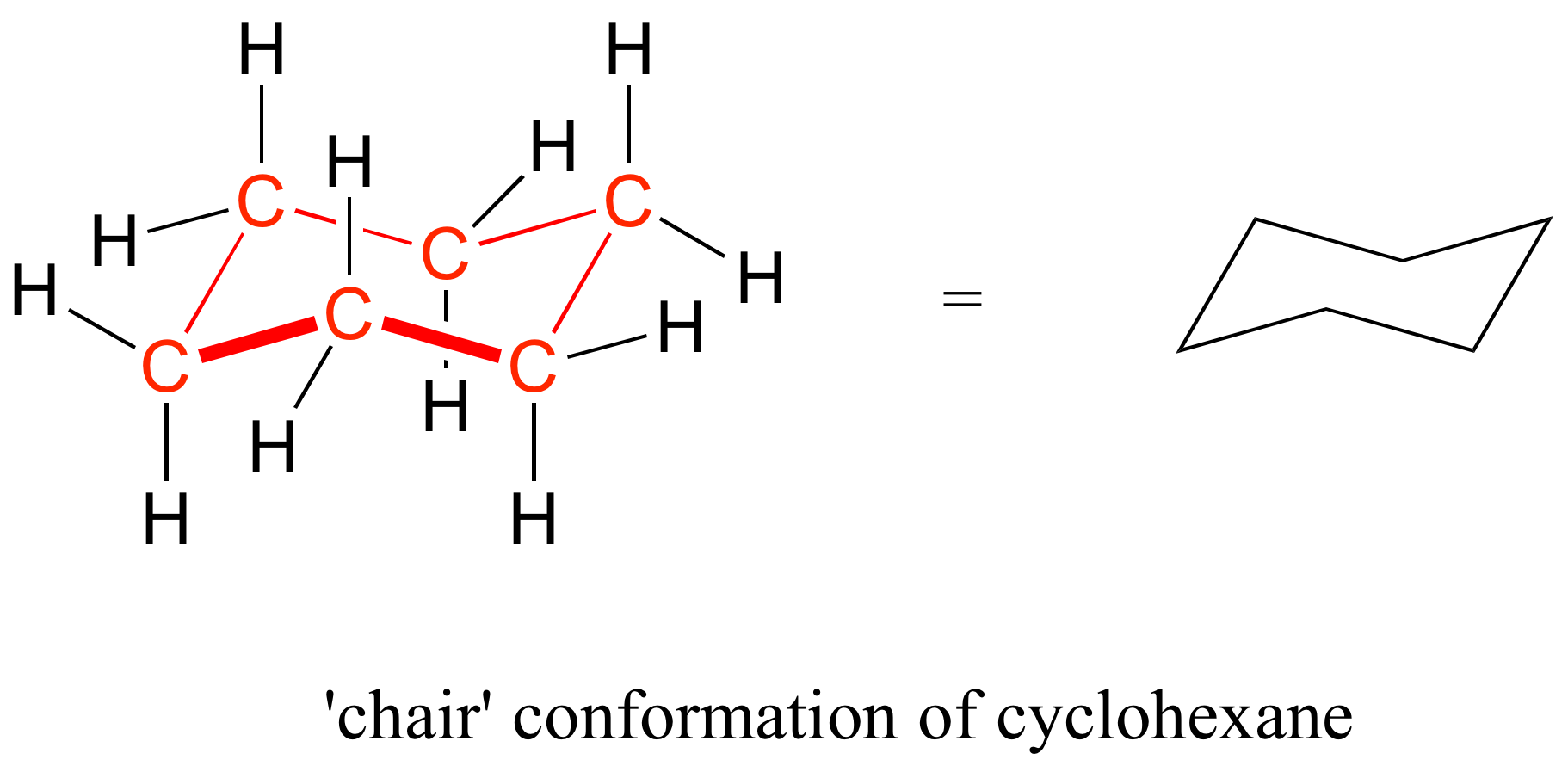
Esta conformación de silla es la conformación de energía más baja para el ciclohexano y otros anillos de seis miembros.
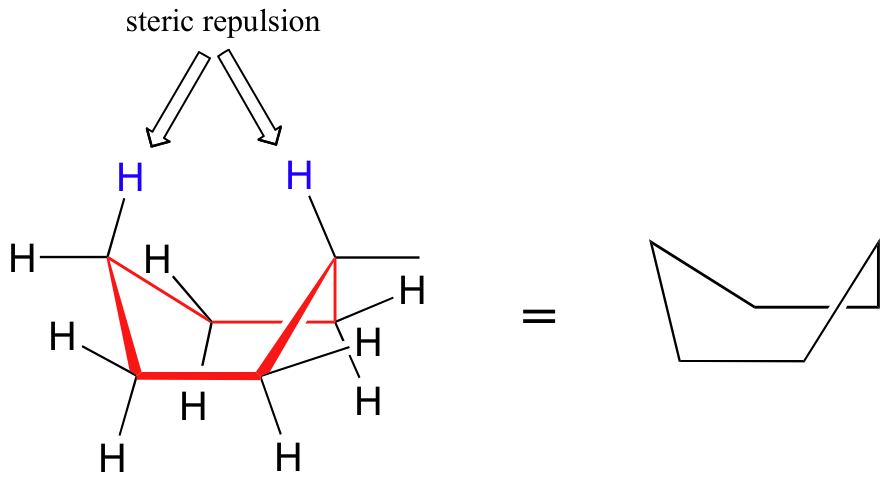
Una conformación alternativa para un anillo de seis miembros se llama el 'barco':
Modelo interactivo de conformaciones de ciclohexano
En la conformación de la embarcación, dos de los sustituyentes —los de la 'proa' y la 'popa' si se quiere— se acercan lo suficiente entre sí como para causar tensión estérica. Una causa adicional de la mayor energía de la conformación de la embarcación es que los átomos de hidrógeno adyacentes en el 'fondo del barco' son forzados a posiciones eclipsadas. Por estas razones, la conformación de la embarcación es una conformación de ciclohexano de alta energía, aproximadamente 30 kJ/mol menos estable que la conformación de la silla.
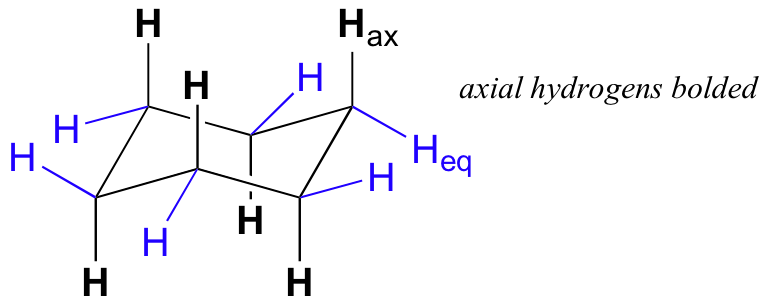
Si miras detenidamente tu modelo de ciclohexano en la conformación de la silla, verás que los doce hidrógenos no son equivalentes en términos de su disposición tridimensional en el espacio. Seis hidrógenos son axiales, es decir, están apuntando recto hacia arriba o hacia abajo con relación al anillo. Los otros seis hidrógenos son ecuatoriales, es decir, están apuntando lejos del perímetro del anillo, ya sea ligeramente hacia arriba o ligeramente hacia abajo. (La distinción ecuatorial vs axial suele ser difícil de ver al principio; en este momento sería una muy buena idea sentarse con su instructor o tutor y trabajar con un kit de modelaje).
Esta no es la única conformación de silla posible para el ciclohexano. En su modelo, gire uno de los carbonos 'arriba' hacia abajo, y uno de los carbonos 'abajo' hacia arriba. Ahora se tiene una nueva conformación de silla alternativa —este proceso se llama inversión de anillos.
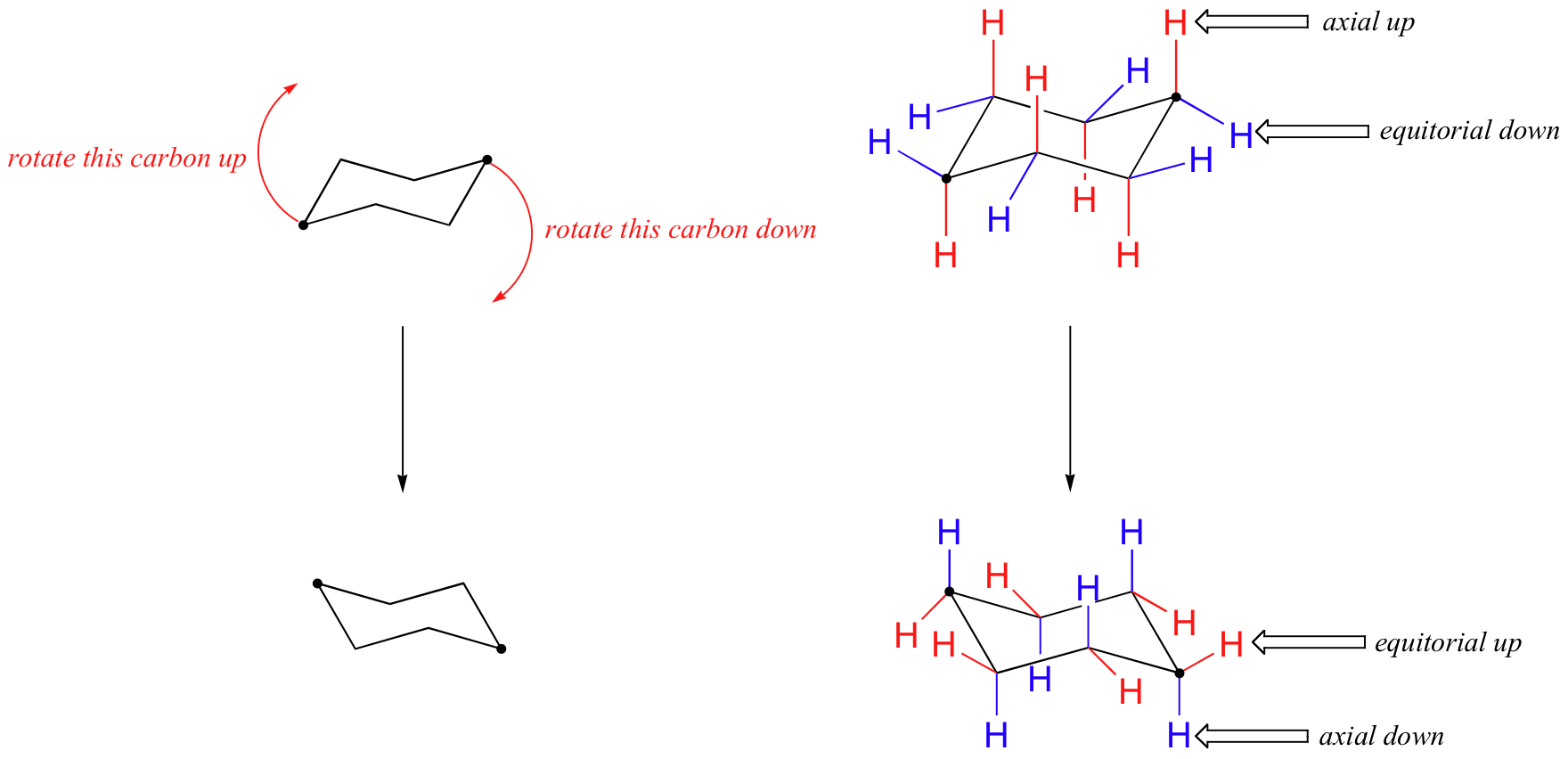
Lo que hay que reconocer aquí es que, como resultado del proceso de inversión del anillo, todos los hidrógenos axiales y ecuatoriales han negociado posiciones —los hidrógenos axiales se han vuelto ecuatoriales, y viceversa. Observe, sin embargo, que los hidrógenos 'abajo' siguen apuntando hacia abajo, y los hidrógenos 'arriba' siguen apuntando hacia arriba independientemente de que sean axiales o ecuatoriales. A temperatura ambiente, el ciclohexano se invierte constantemente entre dos formas de silla de igual energía, es una situación de equilibrio rápido. Así, salvo a temperaturas muy bajas, no somos capaces de distinguir entre hidrógenos axiales y ecuatoriales, ya que constantemente cambian de un lado a otro.
axial/ecuatorial vs cis/trans
Un error muy común que cometen los estudiantes de química orgánica al comenzar a aprender sobre las conformaciones de las cátedras es confundir los términos axial y ecuatorial con los términos cis y trans. ¡Estas son cosas completamente diferentes! Por ejemplo, cuando dos sustituyentes en un anillo son cis en relación entre sí, significa que están apuntados al mismo lado del anillo (ambos hacia arriba o ambos hacia abajo). Dependiendo de sus posiciones en el anillo, ambos podrían ser axiales, ambos ecuatoriales, o uno de cada uno.
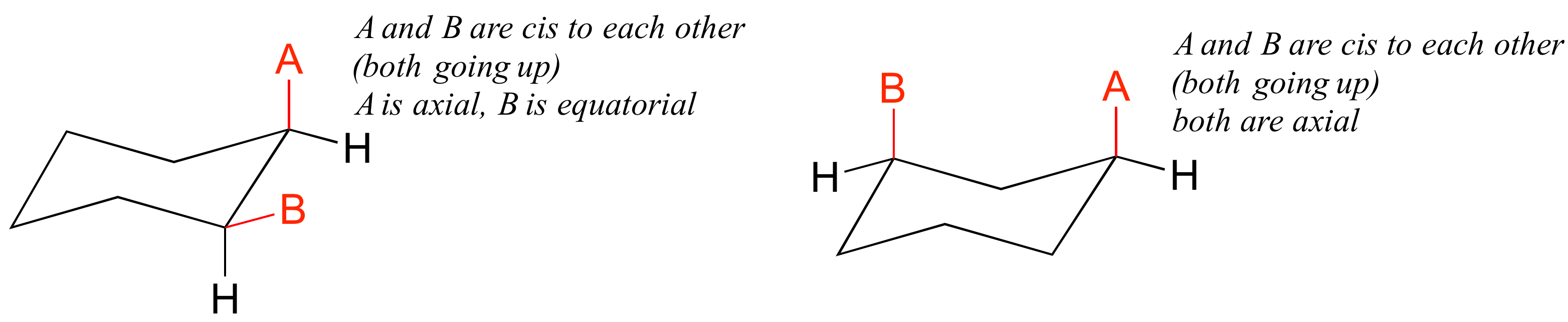
No cometas el error de llamar a dos sustituyentes trans entre sí simplemente porque uno es ecuatorial y otro es axial, o cis porque ambos son axiales o ambos ecuatoriales.
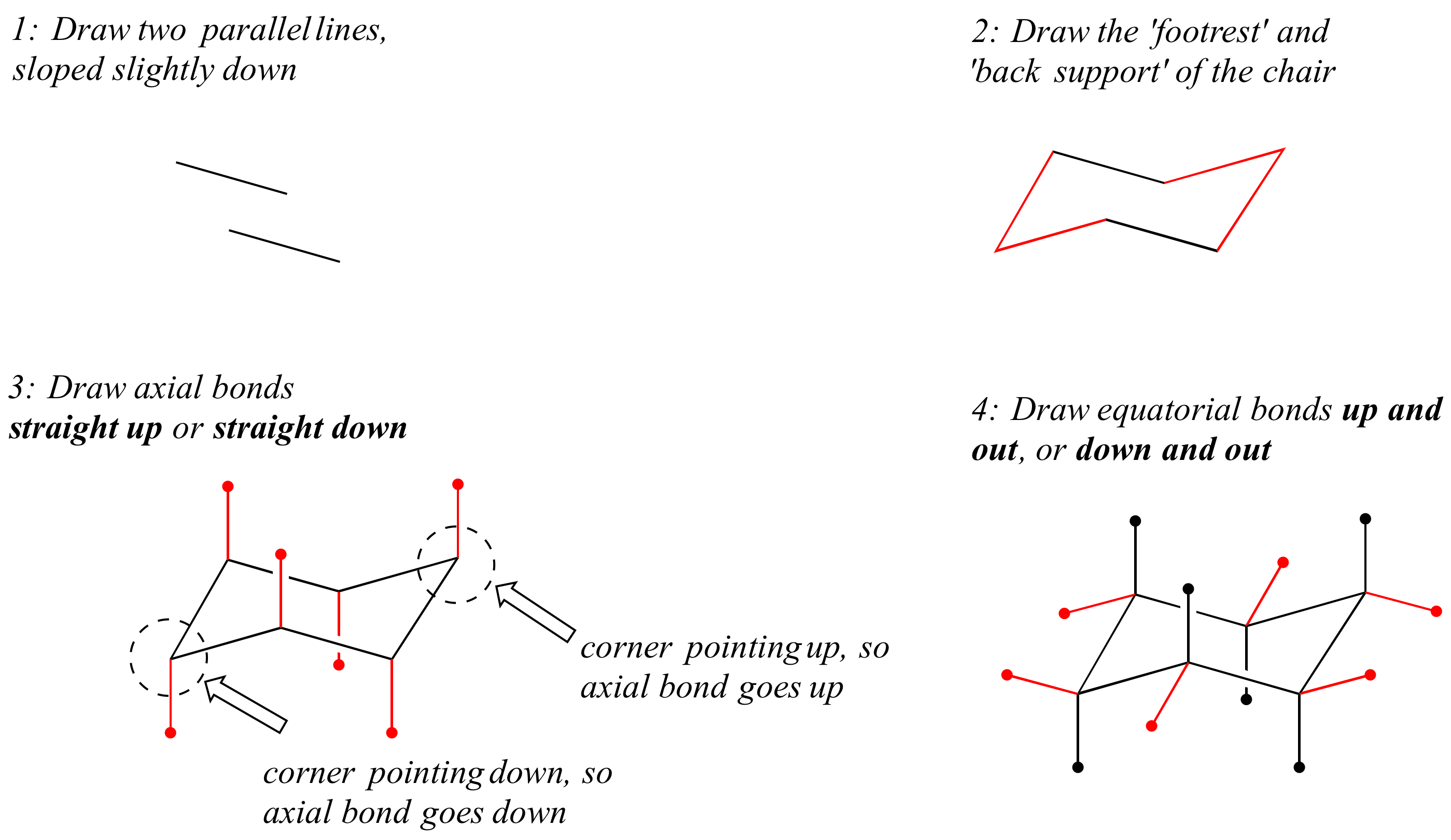
Cómo dibujar la conformación de la silla de ciclohexano
Como estudiante de química orgánica, se esperará que pueda dibujar una representación precisa de las conformaciones de la silla de los cicloalcanos de seis miembros, lo que incluye poder dibujar sustituyentes axiales y ecuatoriales con sus orientaciones correctas. Aquí, entonces, hay algunas pautas a seguir:
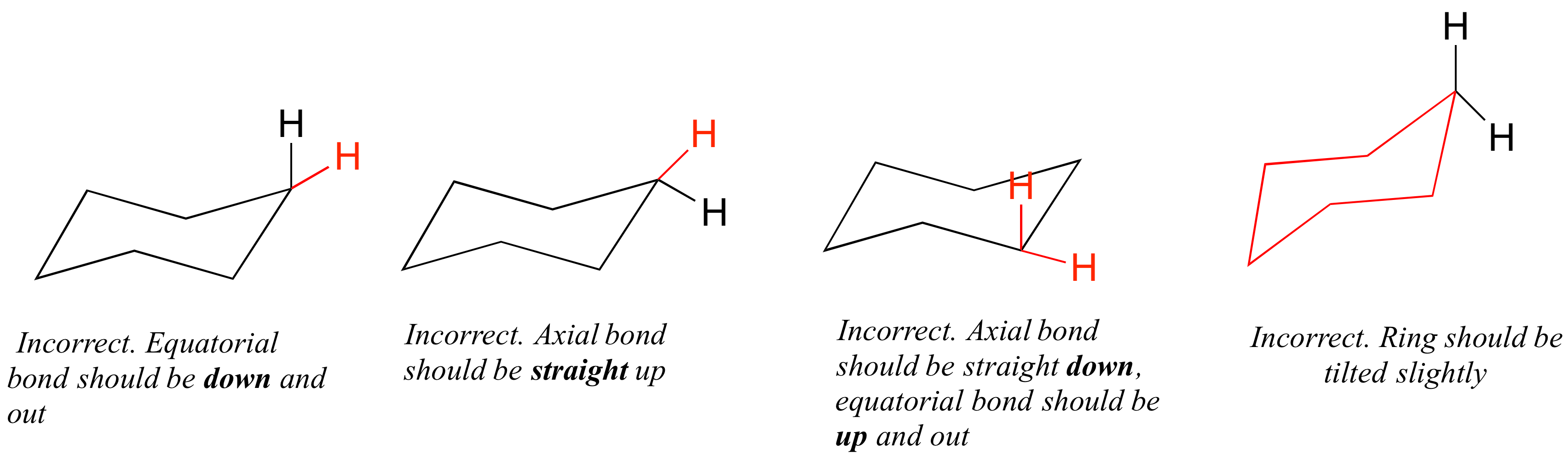
Cómo no dibujar la silla:
¿Qué sucede con las energías relativas de las conformaciones de silla cuando el anillo tiene un sustituyente grande, como un grupo metilo? Ahora bien, las dos conformaciones de silla son bastante diferentes: en una, el grupo metilo es ecuatorial y en la otra es axial.
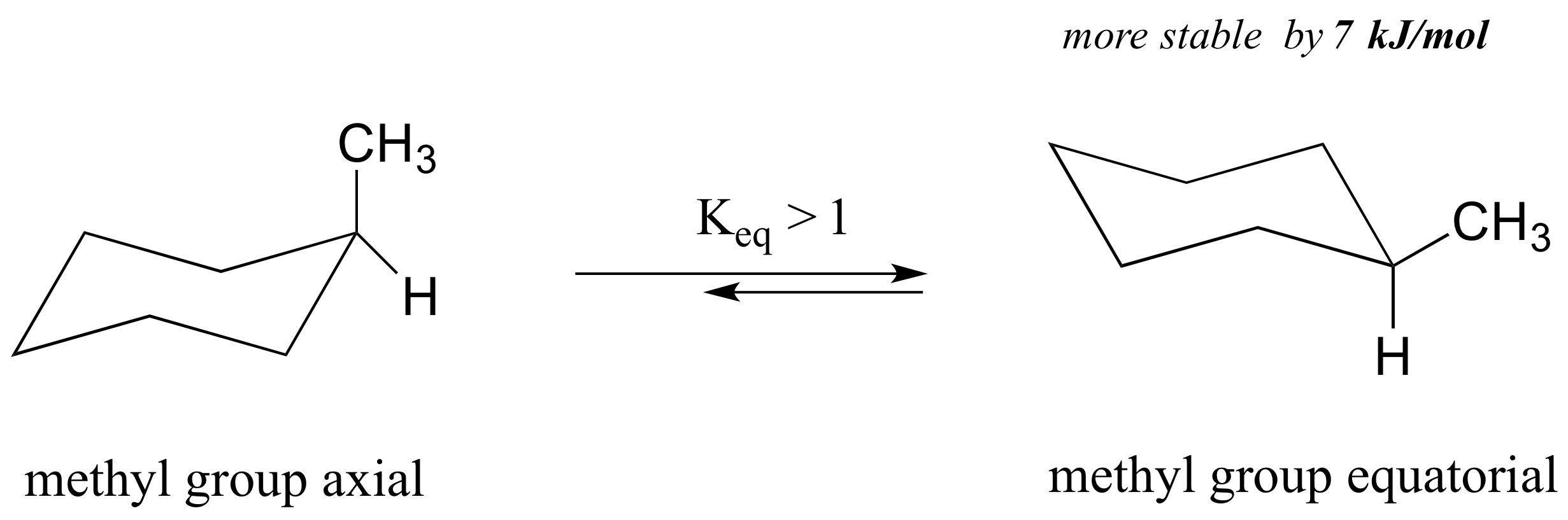
Cuando el grupo metilo está en la posición axial, se acerca lo suficientemente a los hidrógenos axiales en los carbonos a dos enlaces para causar repulsión estérica desestabilizadora: esto se conoce como repulsión 1,3-diaxial.

Cuando está en la posición ecuatorial, el grupo metilo apunta hacia arriba y lejos del resto del anillo, eliminando la desfavorable interacción 1,3-diaxial. Como consecuencia, la conformación en la que el grupo metilo se encuentra en la posición ecuatorial es más estable, en aproximadamente 7 kJ/mol. A temperatura ambiente, el metilciclohexano existe como un rápido equilibrio entre las dos formas silla (y muchas otras conformaciones intermedias), pero la constante de equilibrio (K eq) favorece la conformación donde el grupo metilo es ecuatorial.
La importancia del factor de cepa estérica aumenta con el aumento del tamaño de un sustituyente. Por ejemplo, la diferencia de energía entre las dos conformaciones silla del terc - butil ciclohexano (24 kJ/mol) es mucho mayor que para el metilciclohexano (7 kJ/mol), porque un grupo terc- butilo es mayor que un grupo metilo y resulta en 1,3-diaxial más energéticamente desfavorable interacciones.
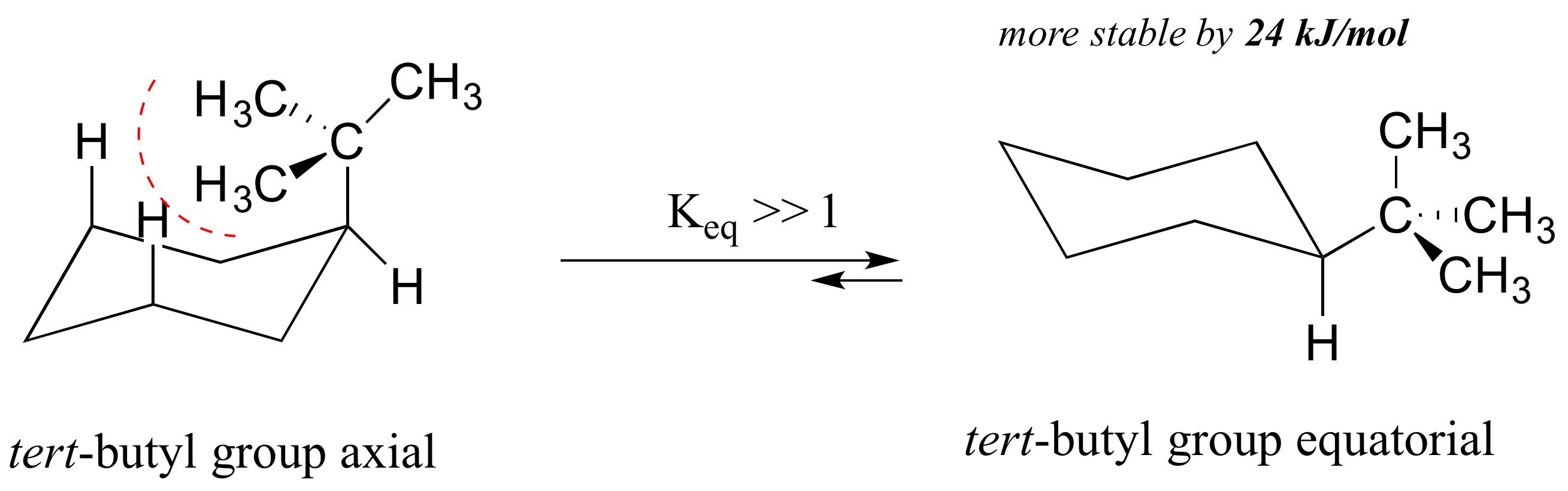
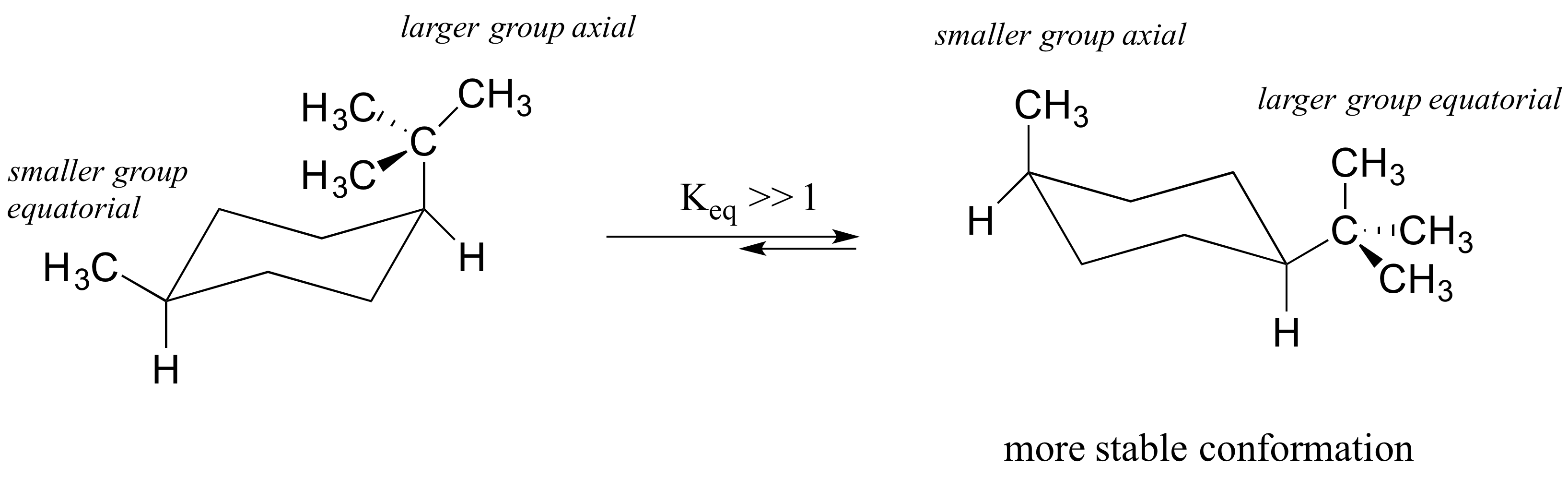
En el caso de un anillo de ciclohexano disustituido en el que ambos sustituyentes no pueden ser ecuatoriales, la conformación de menor energía generalmente coloca al sustituyente más voluminoso en la posición ecuatorial.
Dibujar las conformaciones de silla de menor energía de a) trans-1,2-dimetilciclohexano y b) trans -1-isopropil-3-metilciclohexano. Dibuje todos los sustituyentes en todos los carbonos (incluidos los hidrógenos), asegurándose de que la orientación axial o ecuatorial sea clara. Asegúrate de revisar tu dibujo con tu instructor o tutor.
Ejercicio 3.5
Prediga cuál de los siguientes hexanos disustituidos tiene una mayor diferencia de energía entre sus dos conformaciones de silla y exponga sus razones para sus elecciones.
a) cis-1,3-dimetilciclohexano o cis-1,4-dimetilciclohexano
b) cis-1,2-dimetilciclohexano o trans-1,2-dimetilciclohexano
c) trans-1,2-dimetilciclohexano o trans-1-isopropil-2-metilciclohexano
Ejercicio 3.6
¿Puede una 'inversión de anillo' cambiar un ciclohexano cis-disustituido a trans? Explique.
Soluciones a los ejercicios
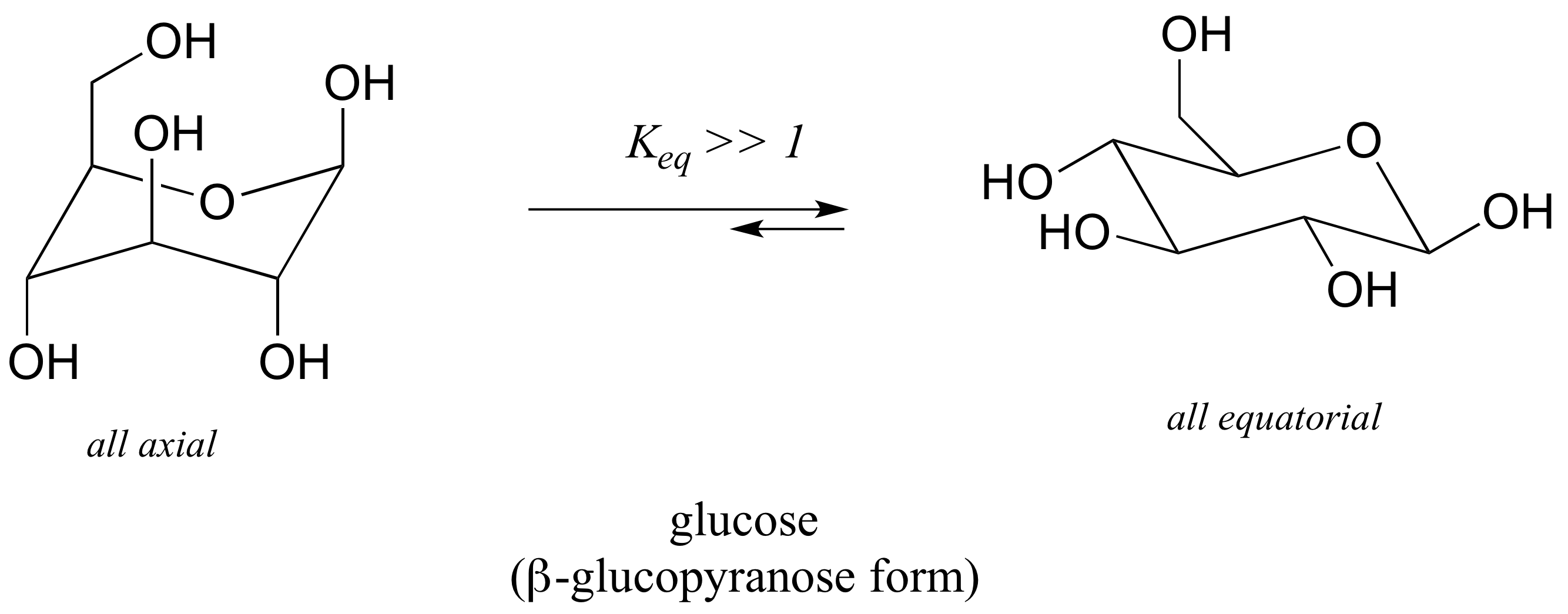
Recordemos que los azúcares de cinco y seis carbonos como la glucosa y la fructosa existen en solución en formas cíclicas y de cadena abierta. La glucosa, en su forma más abundante en solución, es un anillo de seis miembros que adopta una conformación silla con todos los sustituyentes ecuatoriales.
La forma más abundante de fructosa en solución acuosa es también un anillo de seis miembros.
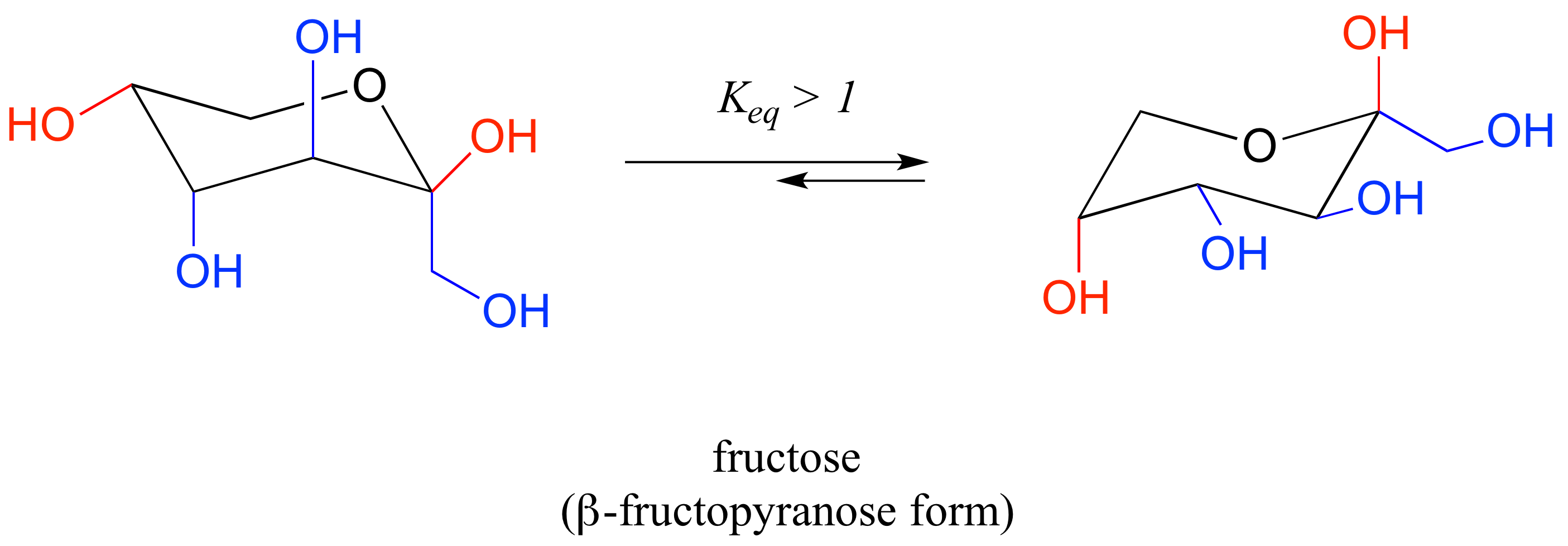
La conformación de la silla de menor energía es la que tiene tres de los cinco sustituyentes (incluyendo el grupo voluminoso —CH 2 OH) en la posición ecuatorial.
Dibuje las dos conformaciones de silla de la manosa de azúcar de seis carbonos, asegurándose de mostrar claramente cada sustituyente no hidrógeno como axial o ecuatorial. Predecir qué conformación es probable que sea más estable y explique por qué.
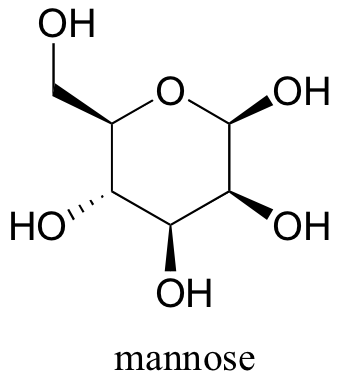
Soluciones a los ejercicios
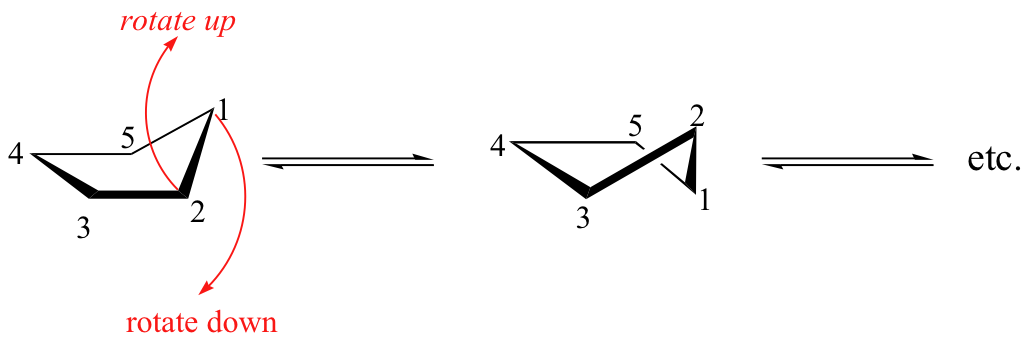
La conformación de energía más baja del ciclopentano y otros anillos de cinco miembros se conoce como la 'envoltura', con cuatro de los átomos del anillo en el mismo plano y uno fuera de plano (observe que esta forma se asemeja a una envoltura con la solapa abierta). Se dice que el carbono fuera del plano está en la posición endo ('endo' significa 'dentro').

La distinción 'ecuatorial' vs 'axial' discutida en el contexto de los anillos de 6 miembros no se aplica a los anillos de cinco miembros.
A temperatura ambiente, el ciclopentano se somete a un rápido proceso de pseudorrotación en el que cada uno de los cinco carbonos se turna para estar en la posición endo.
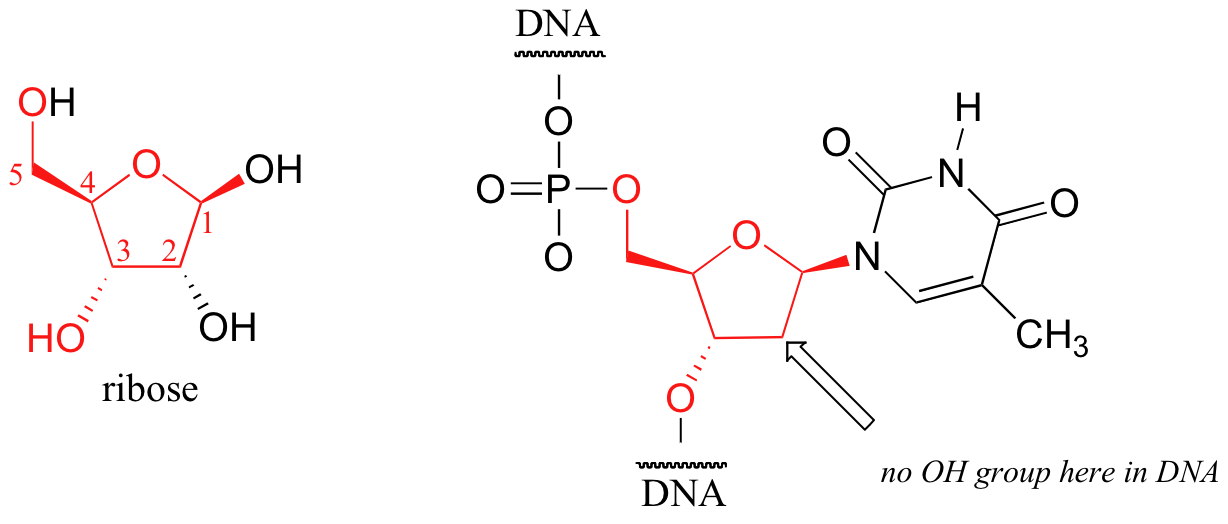
Uno de los anillos de cinco miembros más importantes en la naturaleza es un azúcar llamado ribosa; recuerda de la sección 1.3E que tanto el ADN como el ARN se construyen sobre 'cadenas principales' derivadas de la ribosa. A continuación se muestra un desoxinucleótido de timidina (T) de un tramo de ADN:
Las conformaciones de menor energía para la ribosa son formas de envoltura en las que C 3 o C 2 son endo, en el mismo lado que el sustituyente C5.
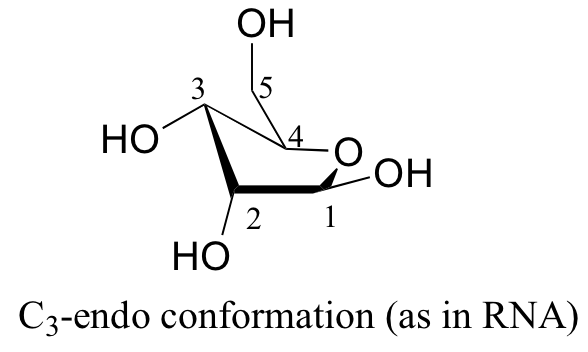
Esto tiene implicaciones muy importantes para la estructura del oligonucleótido —en el ADN, es C 2 el que está en la posición endo, mientras que en el ARN es C 3.
Video tutorial de Khan Academy sobre conformación de cicloalcanos


