3.P: Problemas para el Capítulo 3
- Page ID
- 72659
Soluciones a problemas seleccionados
P3.1: Dibujar una gráfica de energía vs ángulo diedro para rotaciones sobre el enlace C 2 -C 3 de 2-metilbutano. Comience con la conformación de mayor energía como el punto 0 o. Para cada pico de energía y valle, dibuje una proyección correspondiente de Newman.
P3.2:
a) ¿Cuál tiene la conformación de silla diaxial de mayor energía: trans-1,2-dimetilciclohexano, cis -1,3-dimetilciclohexano o trans -1,4-dimetilciclohexano? Explique.
b) ¿Cuáles de los siguientes son ciclohexanos trans disustituidos?
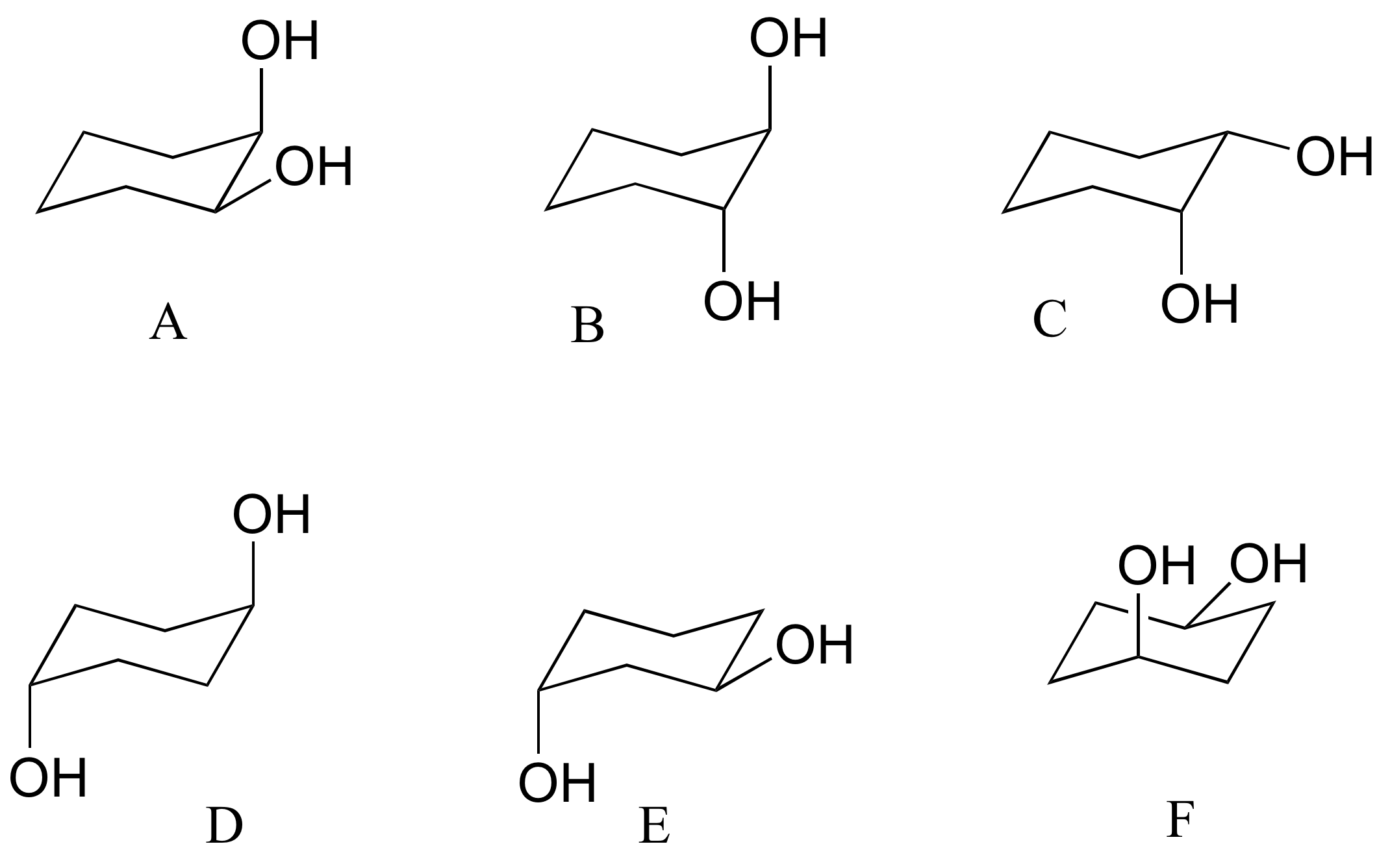
c) Dibuje A-F arriba en dos dimensiones (anillos en el plano de la página, sustituyentes dibujados como cuñas sólidas o discontinuas).
d) La estructura D no tiene ningún centro quiral. Explique.
e) Dibujar un diastereómero de estructura D (en dos dimensiones, como en la parte c).
f) ¿La estructura D y su diastereómero son quirales?
g) Asignar designaciones R/S a los dos centros quirales en la estructura B (pista: ¡hacer un modelo será muy útil!)
P 3.3: Las siguientes son estructuras, dibujadas en dos dimensiones, de medicamentos que figuran en la página web de productos de Merck Pharmaceutical. Uno de los compuestos es aquiral.
a) Circular todos los centros quirales. (Pista: ¡No entres en pánico! Recuerde: está buscando carbonos hibridados sp 3 con cuatro sustituyentes diferentes.)
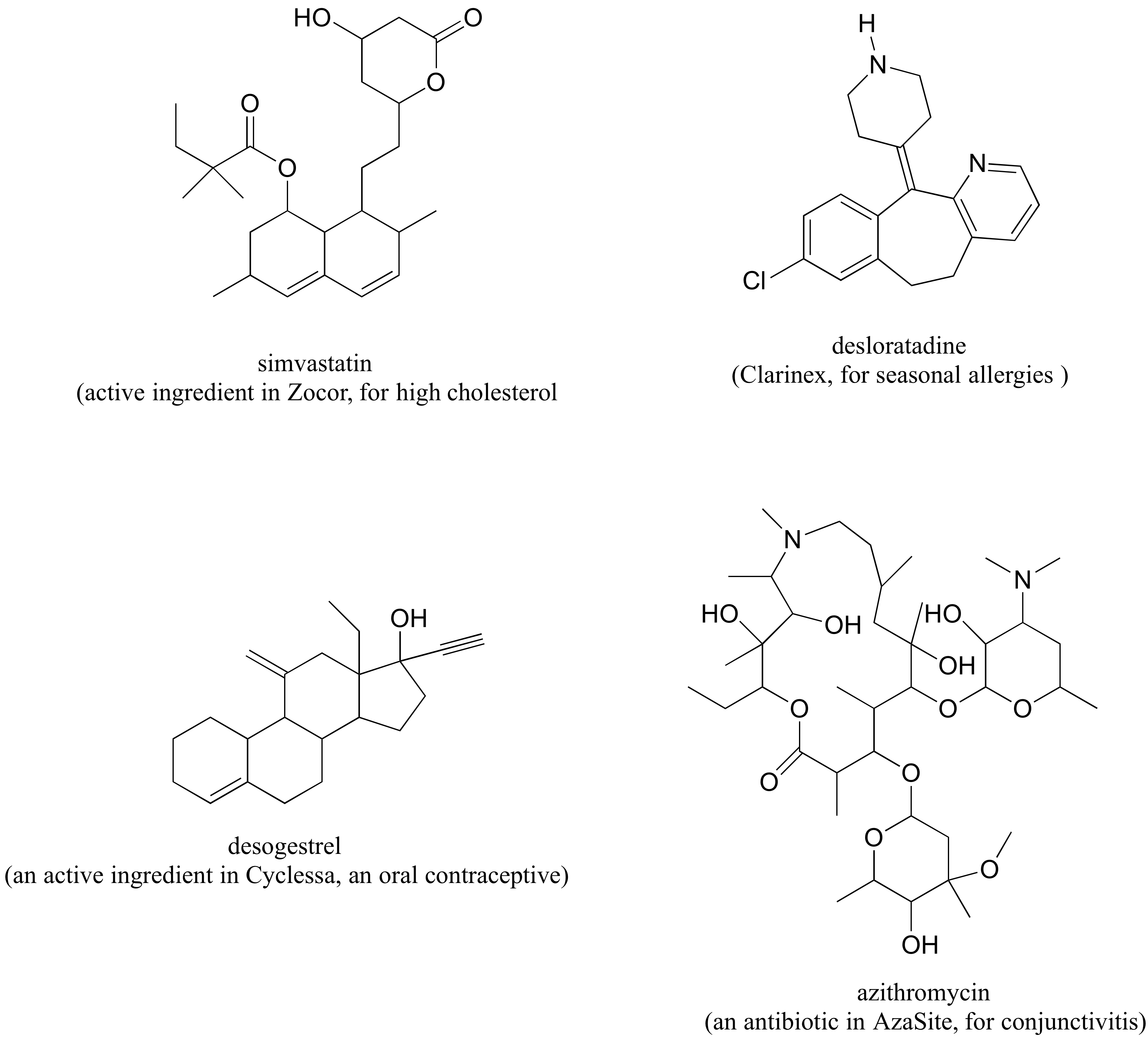
b) ¿Cuántos diastereómeros son posibles para el desogestrel?
c) Dibujar dos formas epiméricas de simvastatina
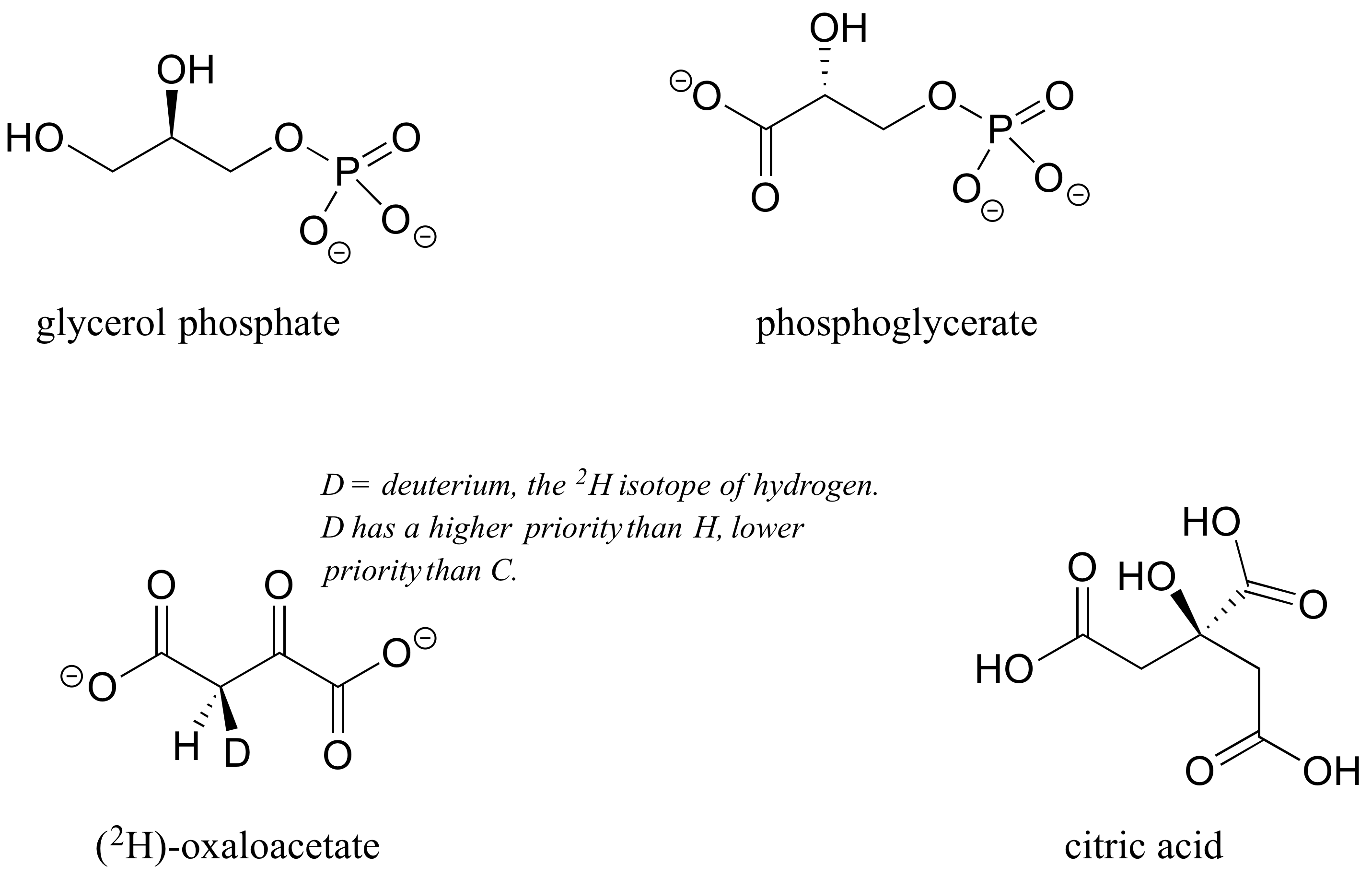
P3.4: Tres de las cuatro estructuras siguientes son quirales. Asignar designaciones R/S a todos los centros quirales e identificar la molécula aquiral.
P3.5: Dibujar los estereoisómeros R, R de las siguientes estructuras.
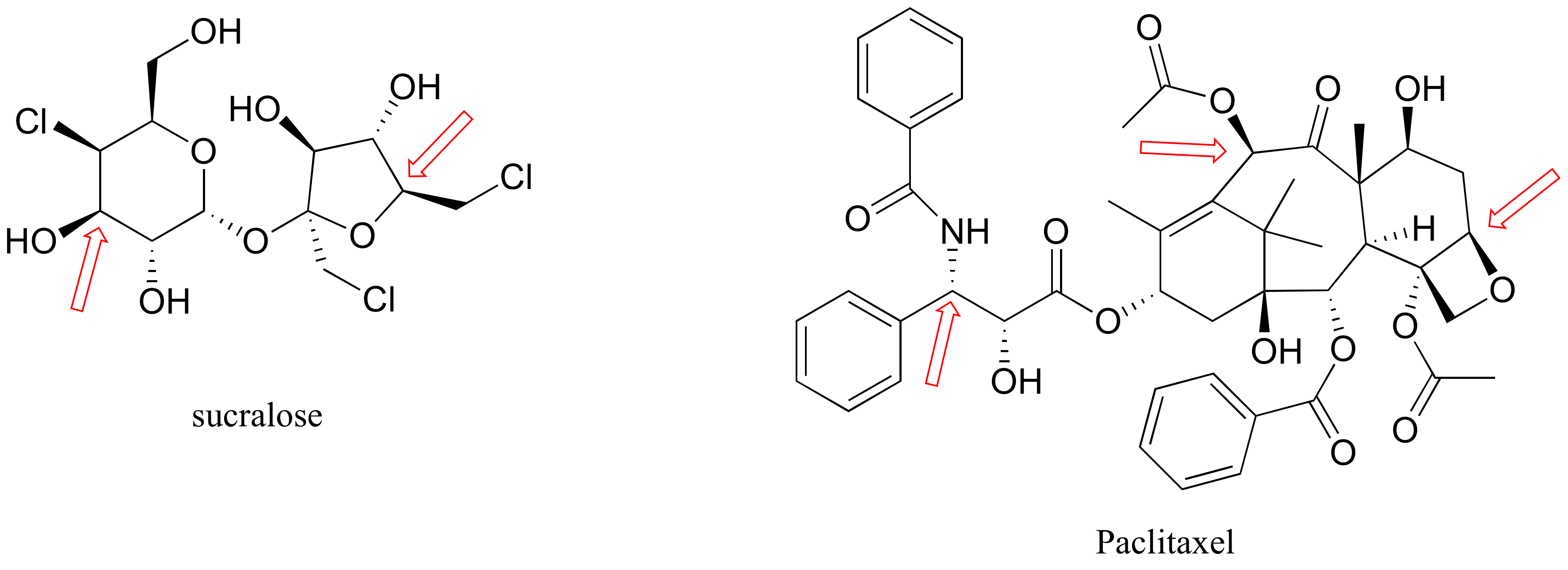
P3.6: A continuación se muestran las estructuras de la sucralosa, el edulcorante artificial con la marca Splenda (TM) y el medicamento contra el cáncer Paclitaxel. Dar una designación R o S a los centros quirales indicados con una flecha.
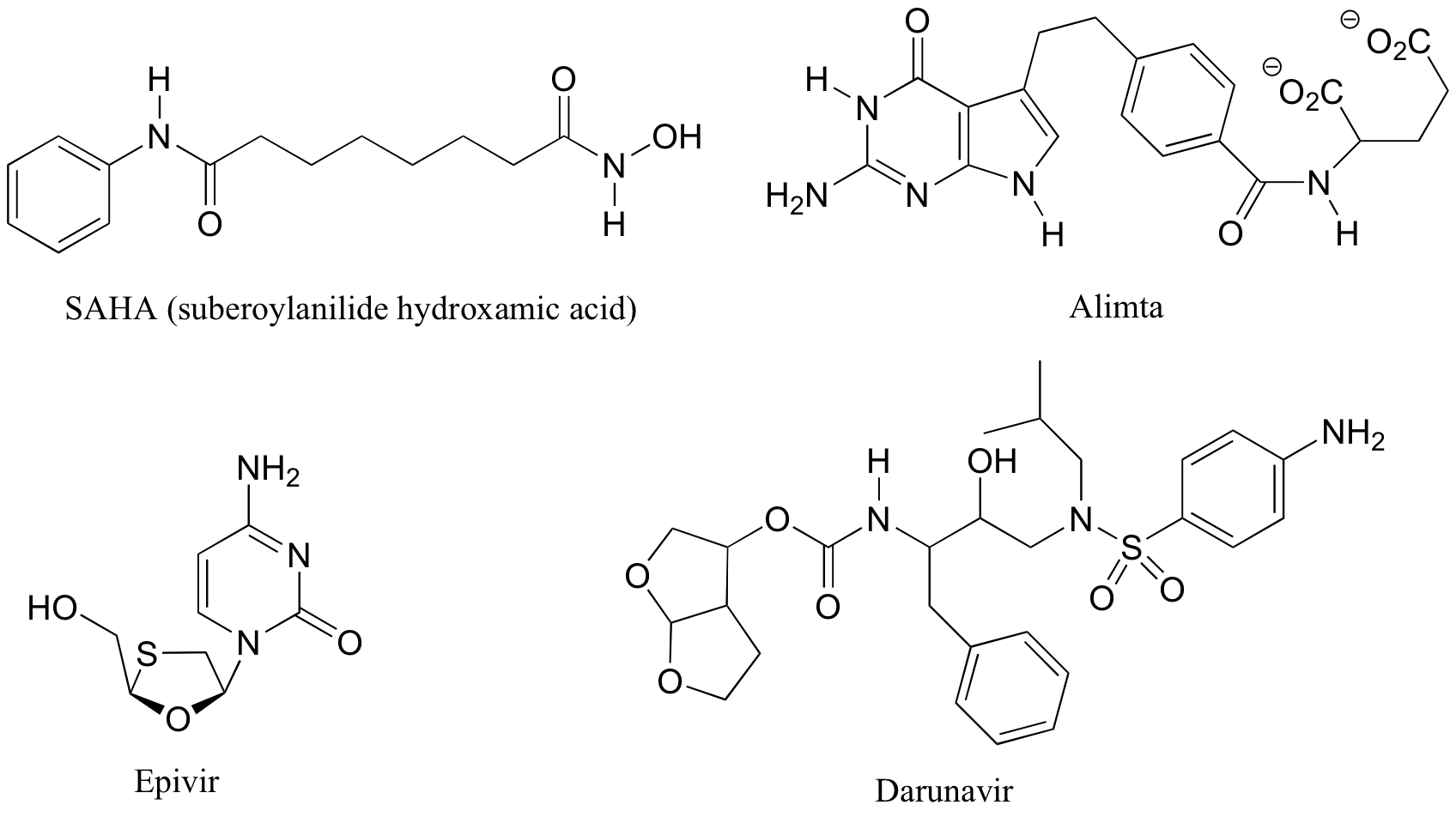
P3.7: Los cuatro medicamentos siguientes fueron presentados en un artículo de Chemical & Engineering News (16 de abril de 2007, p. 42) sobre nuevos medicamentos que se habían desarrollado en laboratorios universitarios.
a) Identificar cada uno como quiral o aquiral, e identificar todos los estereocentros. Además, indique cuántos estereoisómeros posibles existen para cada estructura.
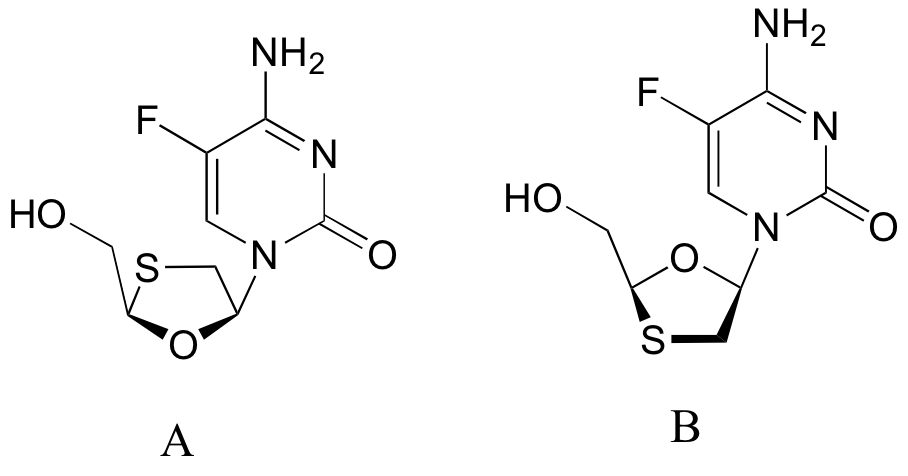
b) En este artículo también se mencionaron dos derivados fluorados de Epivar (estructuras A y B a continuación). ¿Cuál es la relación entre las estructuras A y B? (Sus opciones: no isómeros, isómeros constitucionales, diastereómeros pero no epímeros, epímeros, enantiómeros, idénticos)
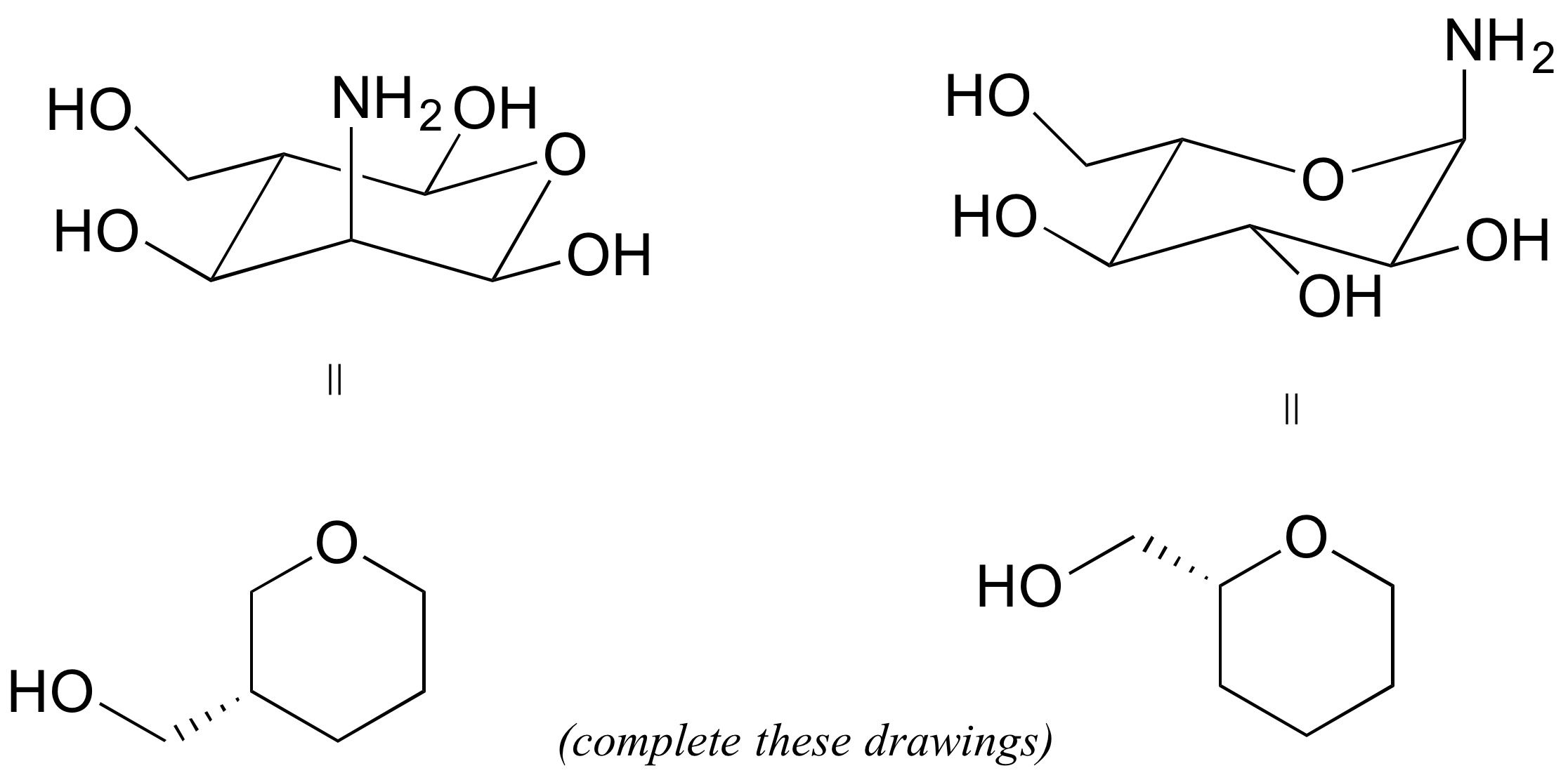
P3.8: Vuelva a dibujar las siguientes estructuras en la convención de cuña de anillo plano, sólido/tablero (los dibujos se han iniciado para usted).
P3.9: A continuación se muestra un fármaco experimental para la enfermedad de Alzheimer que fue mencionado en la edición del 13 de marzo de 2007 de Chemical and Engineering News.
a) Etiquetar todos los estereocentros como R o S.
b) Dibujar el enantiómero de la molécula mostrada.
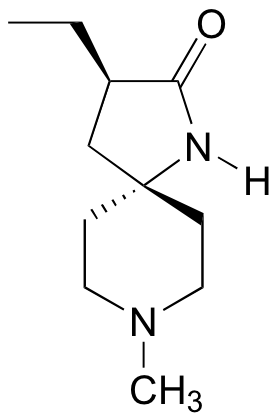
P3.10: Las siguientes moléculas son posibles nuevos fármacos para el tratamiento de la distrofia muscular de Duchenne (molécula A) y el cáncer de piel (molécula B) (Chemical and Engineering News Sept 26, 2005, p. 39). Dadas las designaciones R/S, vuelva a dibujar la estructura mostrando la estereoquímica correcta.
P3.11: Dibujar la estructura de las siguientes moléculas:
a) (R) -3-metil-3-hexanol
b) (R) -1-cloro-1-feniletano
c) ácido (2 R, 3 R) -2,3-dihidroxibutanodioico (ácido tartárico)
d) Ácido (S) - (E) -4-cloro-3-etil-2-pentenoico
e) (1 S, 3 R) -1-cloro-3-etilciclohexano
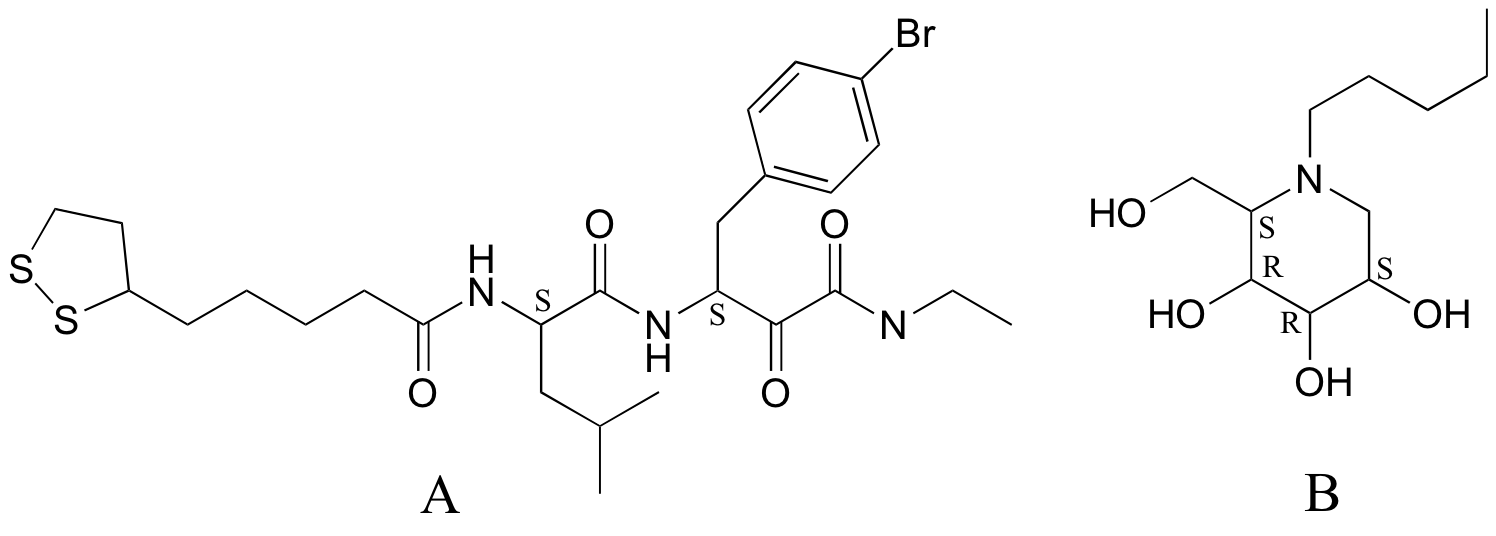
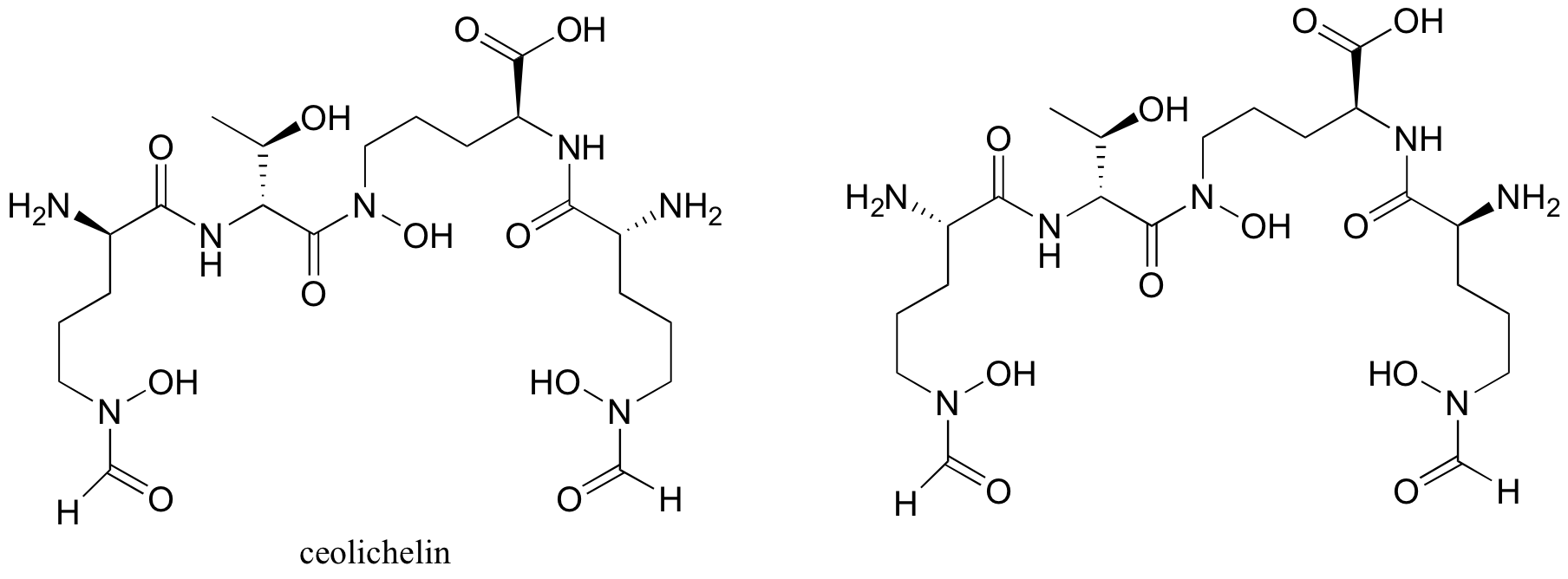
P3.12: La celicelina (la estructura de abajo a la izquierda) es un producto natural de bacterias del suelo que se identificó mediante una técnica conocida como 'minería genómica' (Chemical and Engineering News 19 de septiembre de 2005, p. 11). ¿Cuál es la relación entre la celicelina y el compuesto que se muestra a continuación y a la derecha?
P3.13: Identificar las relaciones entre los siguientes pares de estructuras (No isómeros, isómeros constitucionales, diastereómeros pero no epímeros, epímeros, enantiómeros, idénticos)
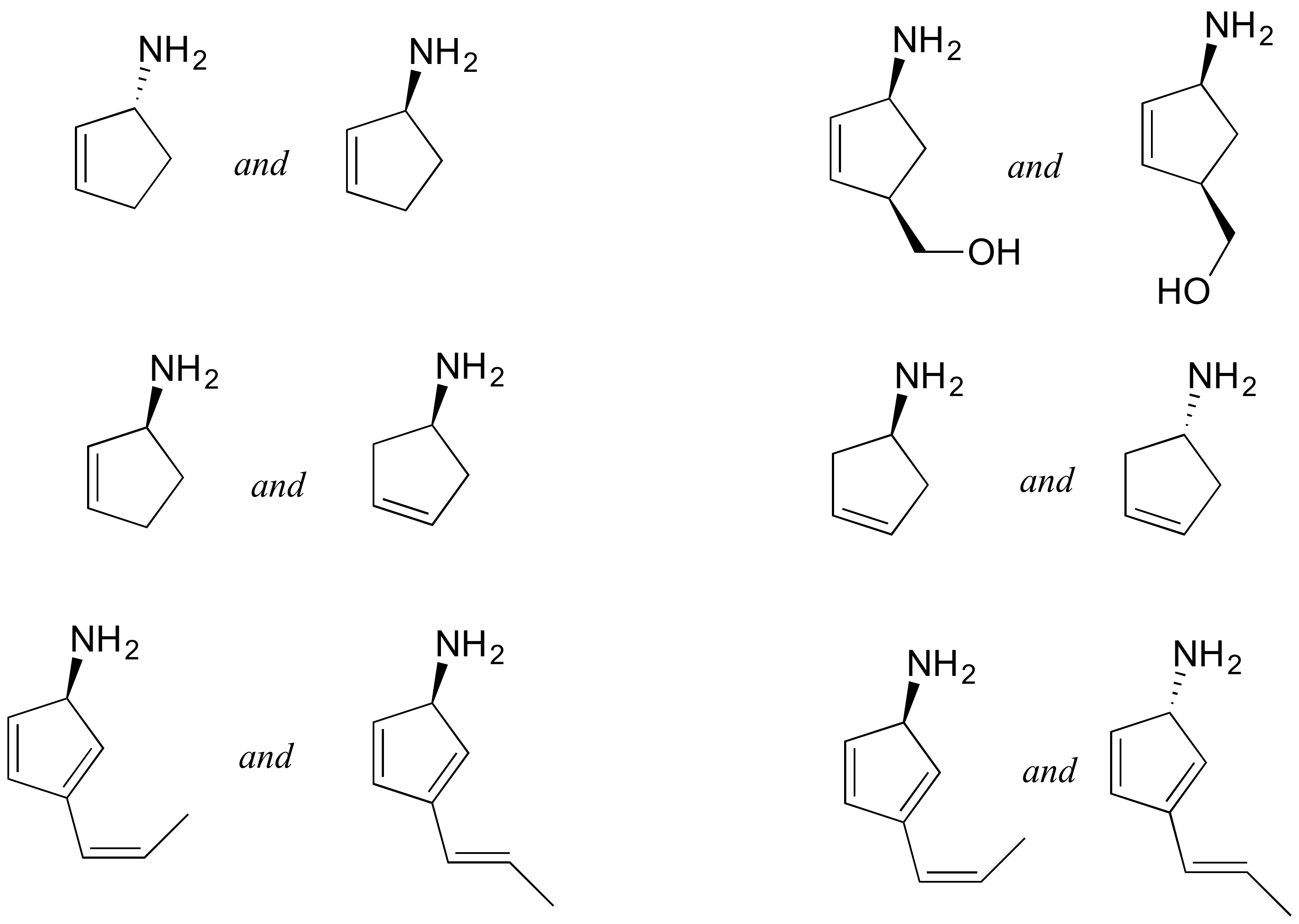
P3.14: Identificar las relaciones entre cada uno de los siguientes pares de azúcares pentosas (no isómeros, isómeros constitucionales, diastereómeros pero no epímeros, epímeros, enantiómeros, idénticos).
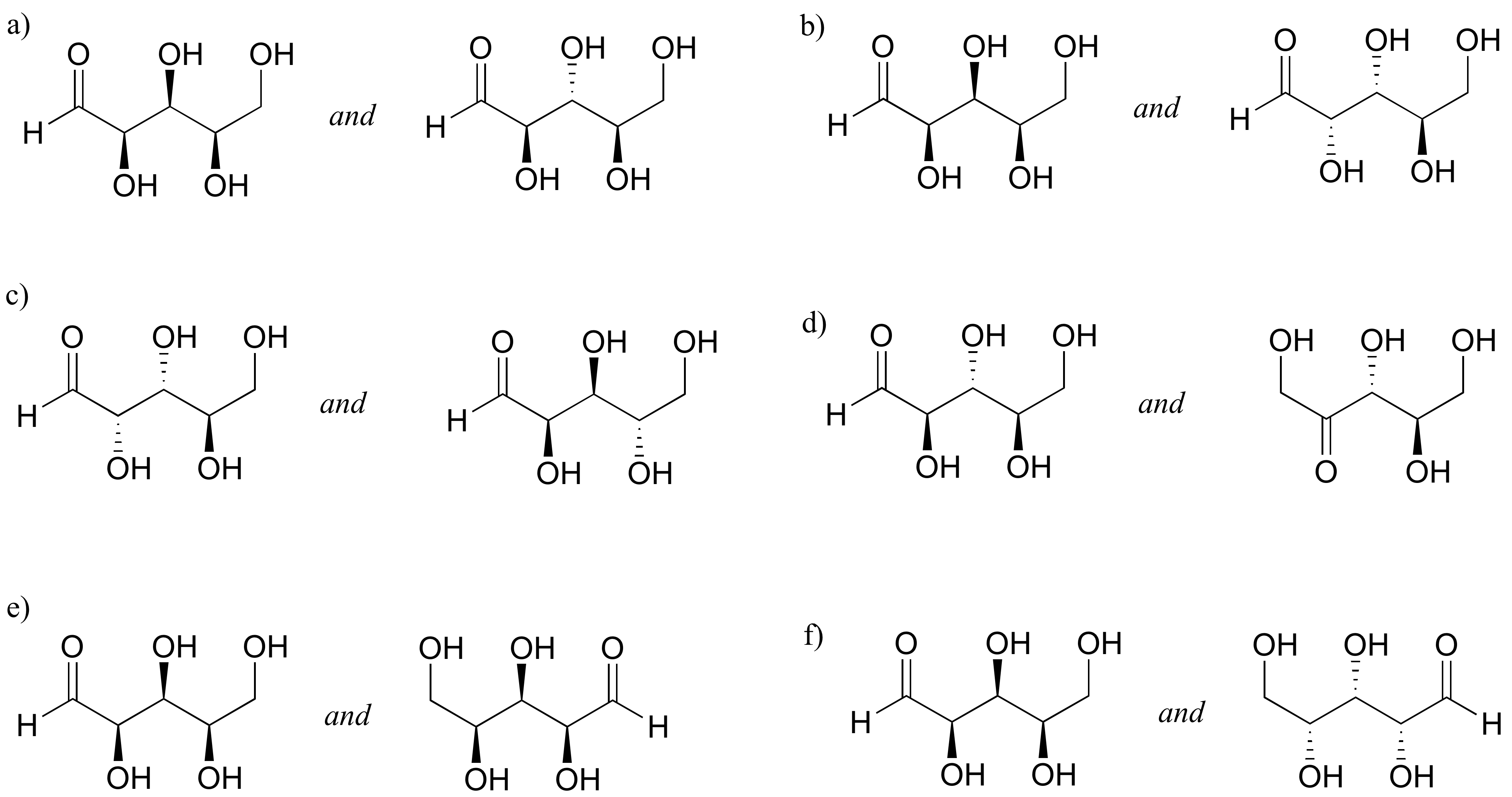
P3.15: Identificar las relaciones entre cada uno de los siguientes pares de azúcares hexosa (no isómeros, isómeros constitucionales, diastereómeros pero no epímeros, epímeros, enantiómeros, idénticos).
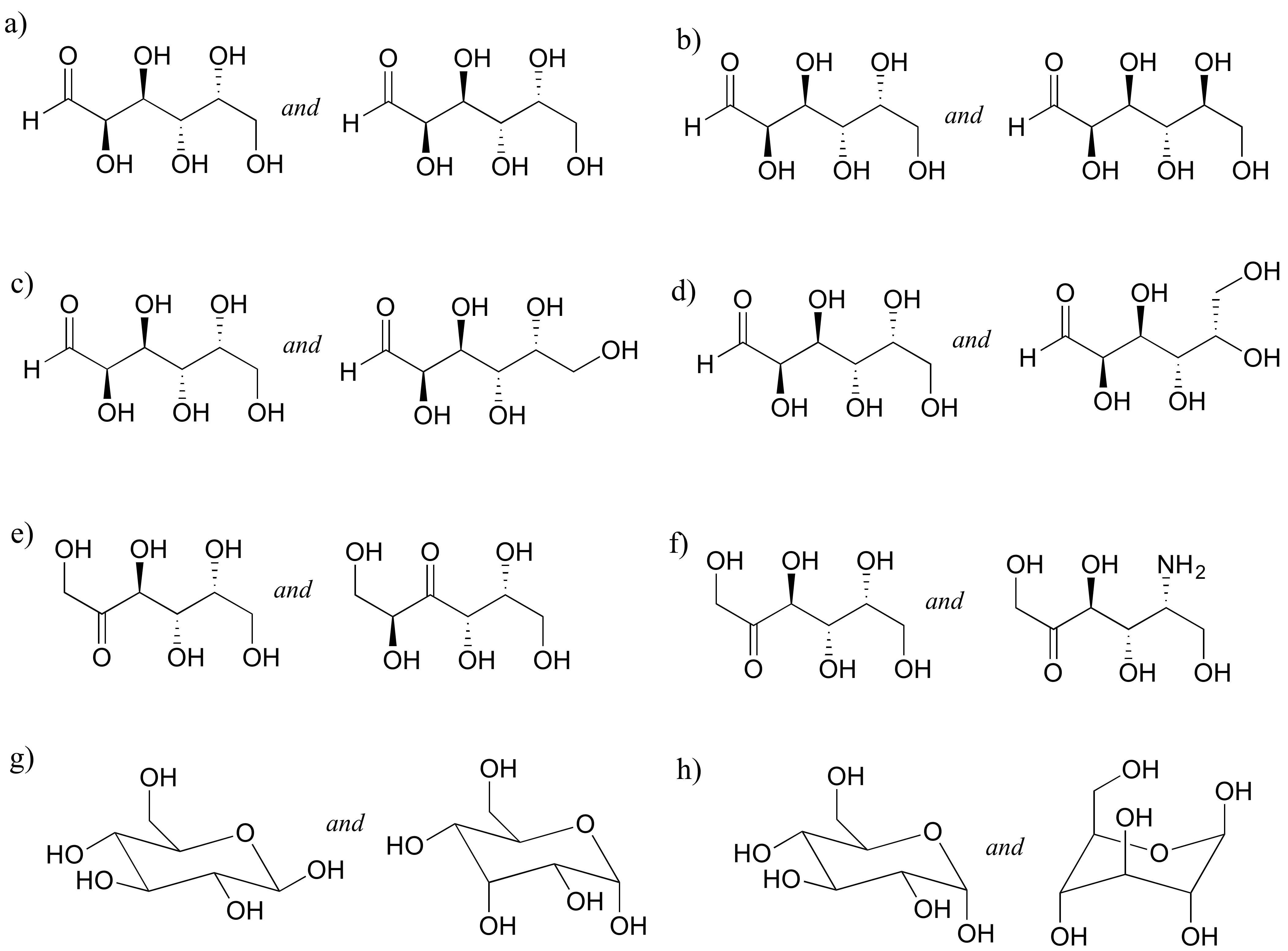
P3.16: El compuesto dibujado a continuación (sin mostrar estereoquímica) ha sido identificado como un posible agente antiinflamatorio por científicos de Schering-Plough, una compañía farmacéutica (ver Chemical and Engineering News 28 de noviembre de 2005 p. 29). ¿Cuántos estereoisómeros son posibles para el compuesto?
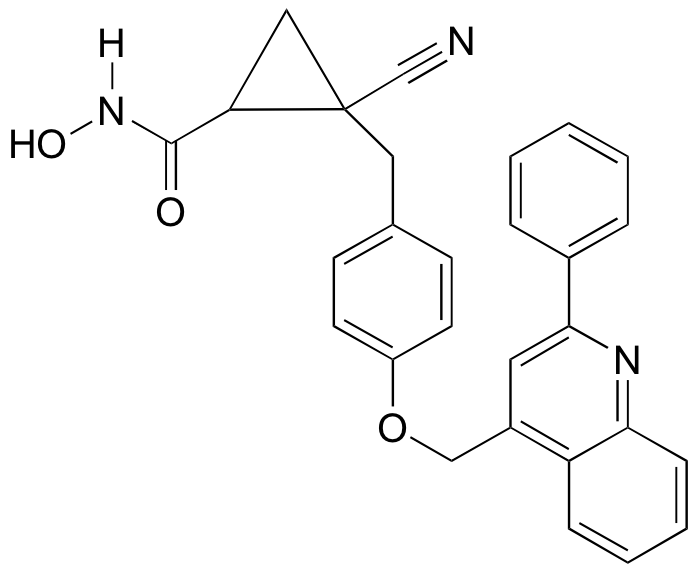
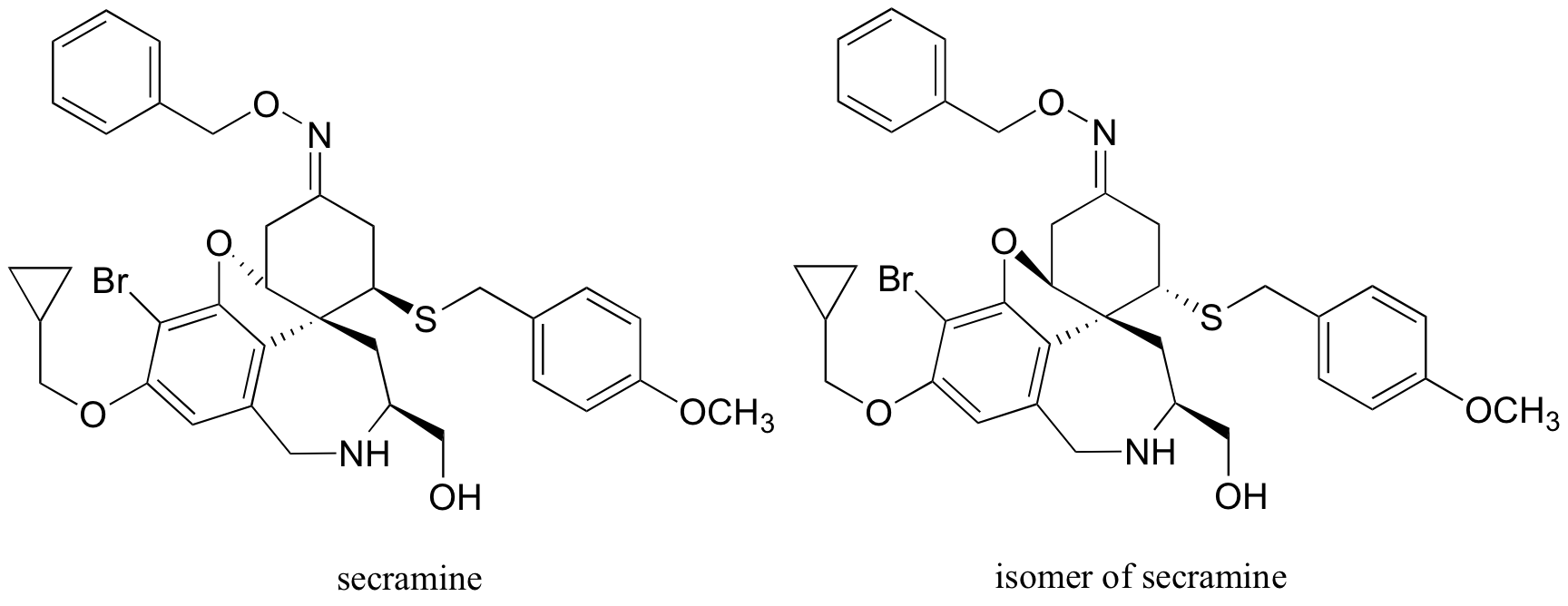
P3.17: La secramina es un compuesto sintético que se ha demostrado que interfiere con el transporte de proteínas recién sintetizadas en la célula (ver Chemical and Engineering News 28 de noviembre de 2005, p. 27). También se dibuja a continuación un isómero (hipotético) de secramina.
a) Identificar la relación entre los dos isómeros: ¿son isómeros constitucionales, isómeros confomacionales, enantiómeros o diastereómeros?
b) Localizar un anillo de cinco miembros en la estructura secramina.
P3.18: Se ha demostrado que el producto natural bistramida A se une a la actina, una proteína estructural importante en la célula, y suprime la proliferación celular (ver Chemical and Engineering News Nov. 21, 2005, p. 10).
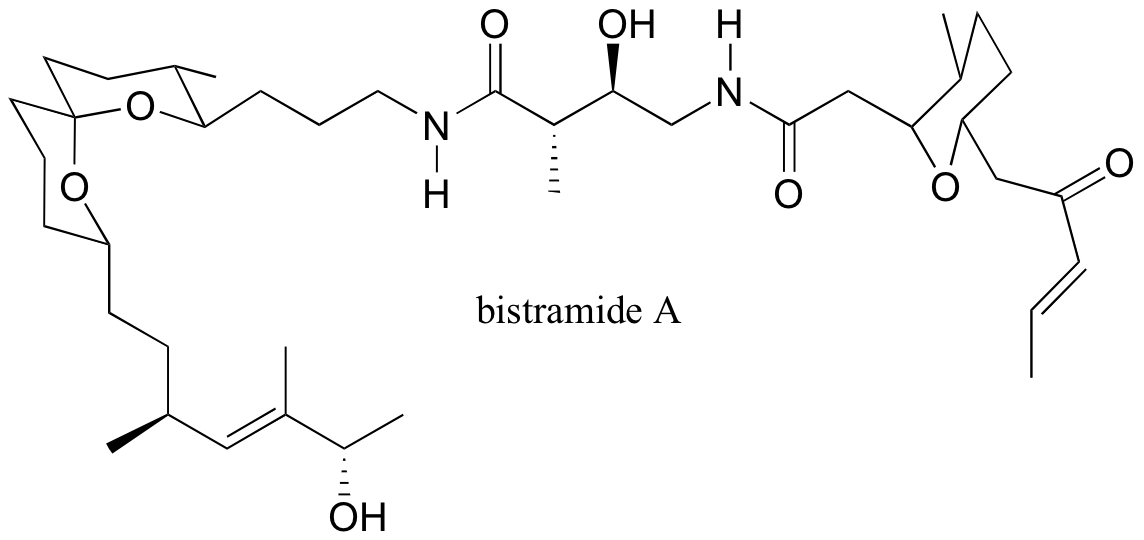
a) Marcar los grupos funcionales alquenos como E, Z o N (sin designación E/Z posible)
b) Teóricamente, ¿cuántos estereoisómeros son posibles para la bistramida A?
P3.19:
a) Dibujar proyecciones de Newman de la gauche y las anti conformaciones de 1,2-etandiol.
b) ¿Por qué podría esperarse que la conformación gauche sea la más estable de las dos?
c) ¿Crees que la gauche es también la conformación más estable del 1,2-dimetoxietano? Explique.
P3.20: Dibujar la conformación de la silla de cis -1,2-dimetilciclohexano.
a) Etiquete la configuración estereoquímica en C 1 y C 2 para la estructura que dibujó.
b) Construye un modelo de tu molécula y prueba diferentes conformaciones de embarcaciones posibles. ¿Puedes encontrar uno en el que haya un plano de simetría?
c) ¿El cis -1,2-dimetilciclohexano es una molécula quiral?
d) ¿es quiral cis -1,4-dimetilciclohexano? ¿Qué tal trans -1,4-dimetilciclohexano? ¿Qué tal trans -1-cloro-4-fluorociclohexano?
P3.21: En algunos casos especiales, un 'centro quiral' puede estar compuesto por varios átomos en lugar de solo uno, y las moléculas que contienen tales centros quirales multiatómicos son de hecho quirales. ¿Cuál es la relación entre los dos compuestos de difluoraleno a continuación? Será muy útil hacer modelos, y revisar las definiciones fundamentales de este capítulo.



