3.10: Estereoquímica de alquenos
- Page ID
- 72617
Cuando hablamos de estereoquímica, no siempre estamos hablando de compuestos quirales y centros quirales. Considere cis - y trans -2-buteno:
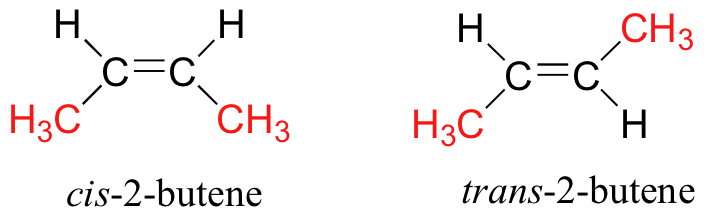
Cada uno puede superponerse sobre su propia imagen especular, y tampoco es quiral (¡también, tenga en cuenta la falta de un centro quiral!) Sin embargo, ambos tienen la misma fórmula molecular y la misma conectividad de enlace, por lo que por definición son estereoisómeros entre sí. Debido a que no son imágenes especulares, deben ser diastereómeros. Un grupo alqueno que puede existir en dos formas estereoisoméricas se denomina estereogénico.
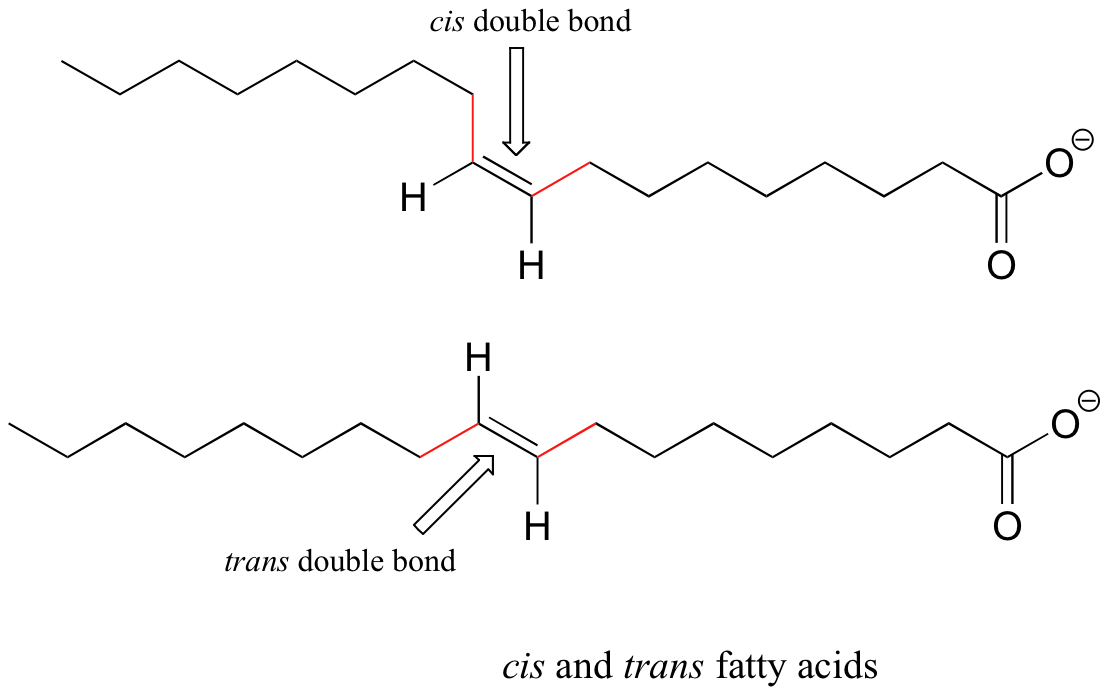
Los grupos alquenos en los ácidos grasos insaturados naturales son normalmente cis, pero los ácidos grasos trans (que se cree que están asociados con enfermedades cardíacas y otros problemas de salud) se encuentran en algunos productos alimenticios.
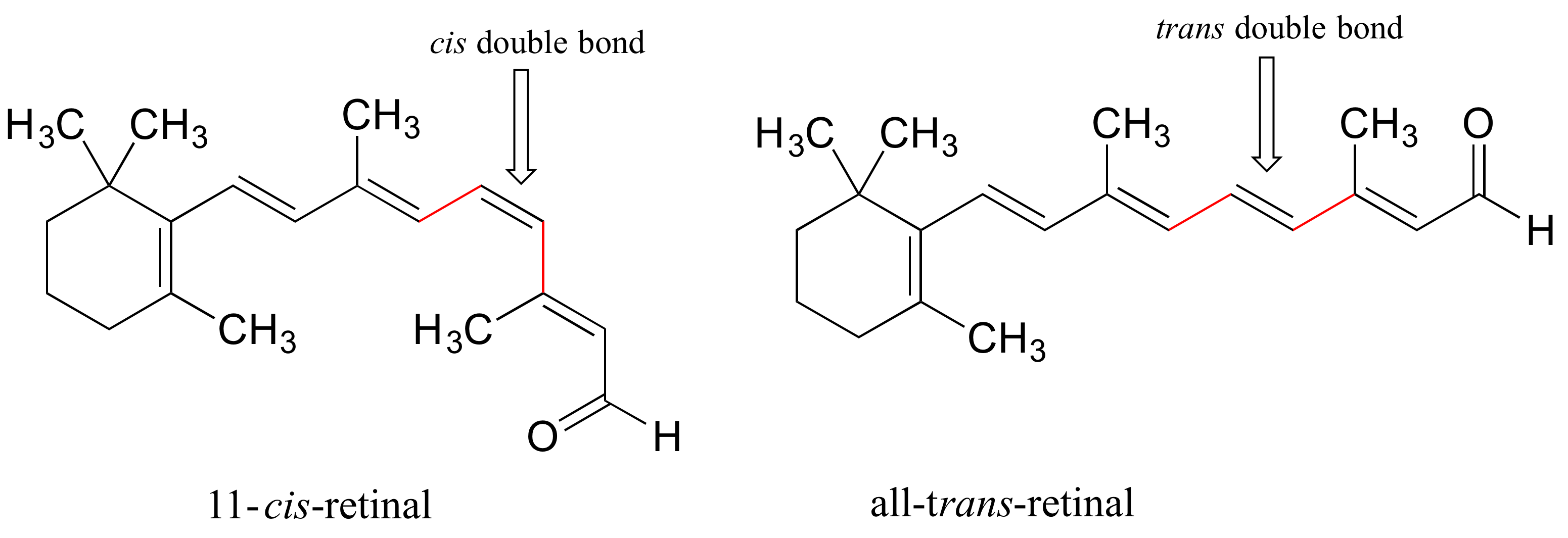
La retina es una molécula sensible a la luz, derivada de la vitamina A, que se encuentra en las células bastonciformes del ojo. Cuando la luz ingresa al ojo a través de la retina, una forma de retinal se convierte en un diastereómero cuando un doble enlace cis se convierte en trans (aprenderemos cómo sucede esto en el capítulo 13). Esto cambia la forma de la molécula y la forma en que se une a la proteína de la visión rodopsina, que a su vez inicia una cadena de eventos que lleva a que se envíe una señal al centro de visión del cerebro.
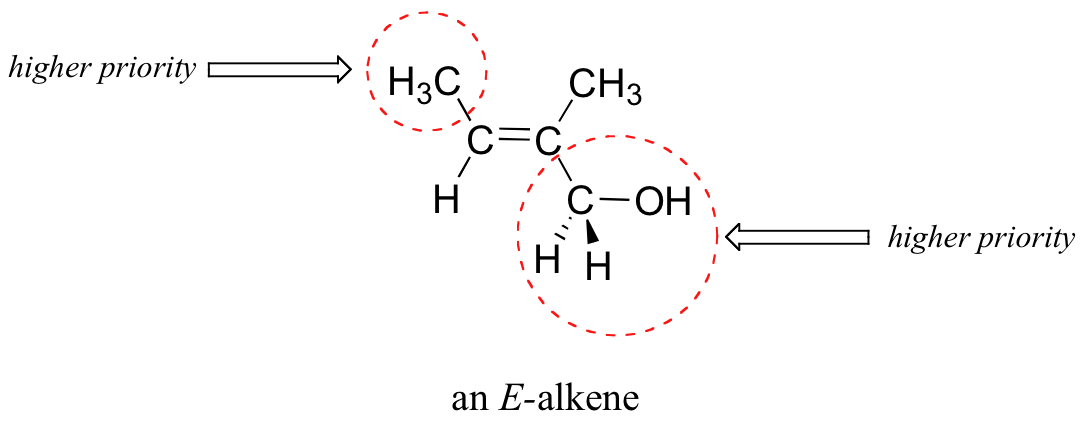
Si bien los términos cis y trans son bastante claros en los ejemplos anteriores, en algunos casos pueden ser ambiguos, y se requiere una designación estereoquímica más rigurosa. Para designar inequívocamente la estereoquímica de alquenos, lo mejor es usar los designadores 'E' y 'Z' en lugar de trans y cis. Para utilizar este sistema de nomenclatura, primero decidimos cuál es el grupo de mayor prioridad en cada carbono del doble enlace, utilizando las mismas reglas de prioridad que aprendimos para el sistema R/S. Si los grupos de mayor prioridad son uno del mismo lado del doble enlace, es un Z-alqueno, y si están en el lado opuesto es un E-alqueno. Un dispositivo de memoria que muchos estudiantes encuentran útil es la frase 'Z = zame zide'.
A continuación se muestra un ejemplo de un E-alqueno: observe que, aunque los dos grupos metilo están del mismo lado uno con relación al otro, el alqueno tiene estereoquímica E de acuerdo con las reglas del sistema E/Z porque uno de los grupos metilo tiene mayor prioridad (relativo a un hidrógeno) y el otro tiene menor prioridad (en relación con un alcohol primario). Los términos cis/trans serían ambiguos para este compuesto.
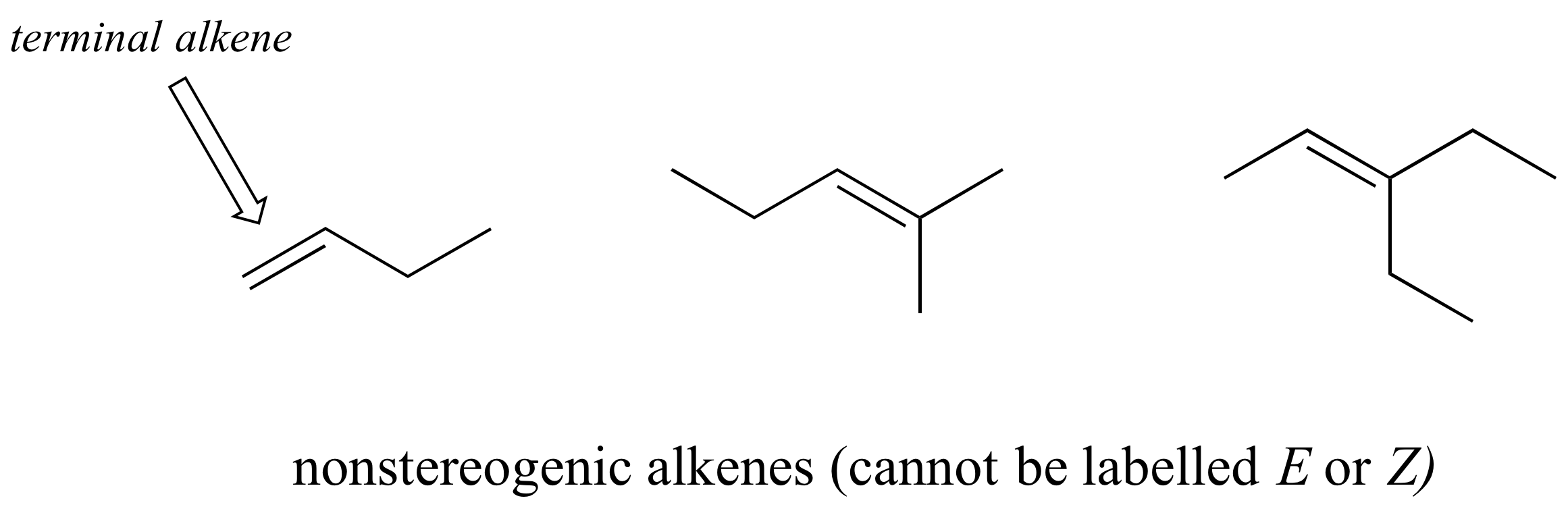
No todos los alquenos pueden etiquetarse E o Z: si uno (o ambos) de los carbonos de doble enlace tiene sustituyentes idénticos, el alqueno no es estereogénico y, por lo tanto, no se le puede asignar una configuración E o Z. Los alquenos terminales, en los que uno de los carbonos del alqueno está unido a dos átomos de hidrógeno, son el tipo de alqueno no estereogénico más comúnmente visto.
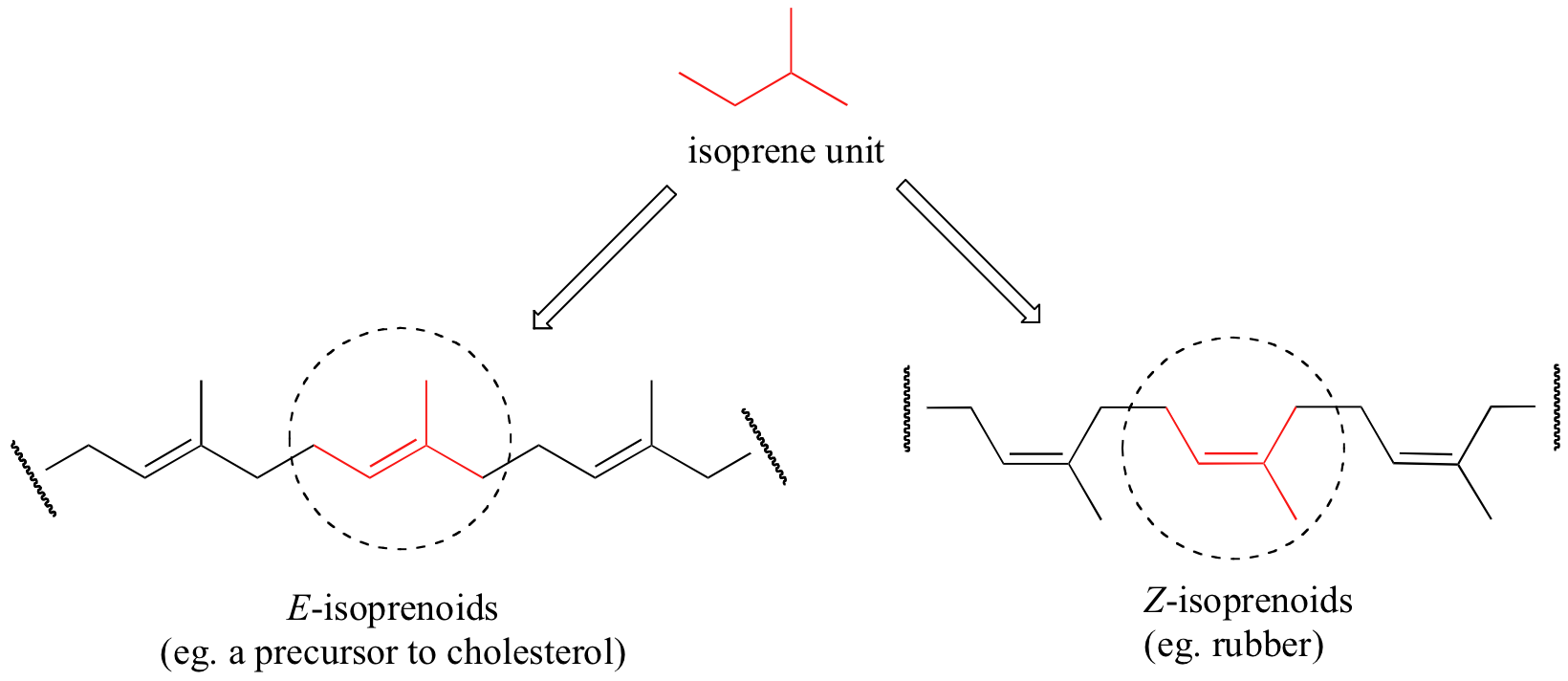
El caucho natural es un polímero compuesto por bloques de construcción de isoprenoides de cinco carbonos unidos a la estereoquímica Z. Los mismos bloques de construcción de isoprenpoides también se pueden conectar con la estereoquímica E, lo que lleva a un polímero que es un precursor del colesterol y muchos otros compuestos isoprenoides naturales que se encuentran en todas las formas de vida.
Los alquenos ubicados dentro de un anillo de cinco o seis miembros, como en el ciclohexeno, generalmente no están etiquetados E o Z, simplemente porque la geometría cerrada del anillo permite solo una posibilidad estereoquímica. El (E) -ciclohexeno no es físicamente posible, por lo que no es necesario incluir el designador (Z) para ciclohexeno. Los anillos más grandes, sin embargo, pueden tener hipotéticamente grupos de alqueno E o Z: dos ejemplos reales se incluyen en el ejercicio 3.26 a continuación.
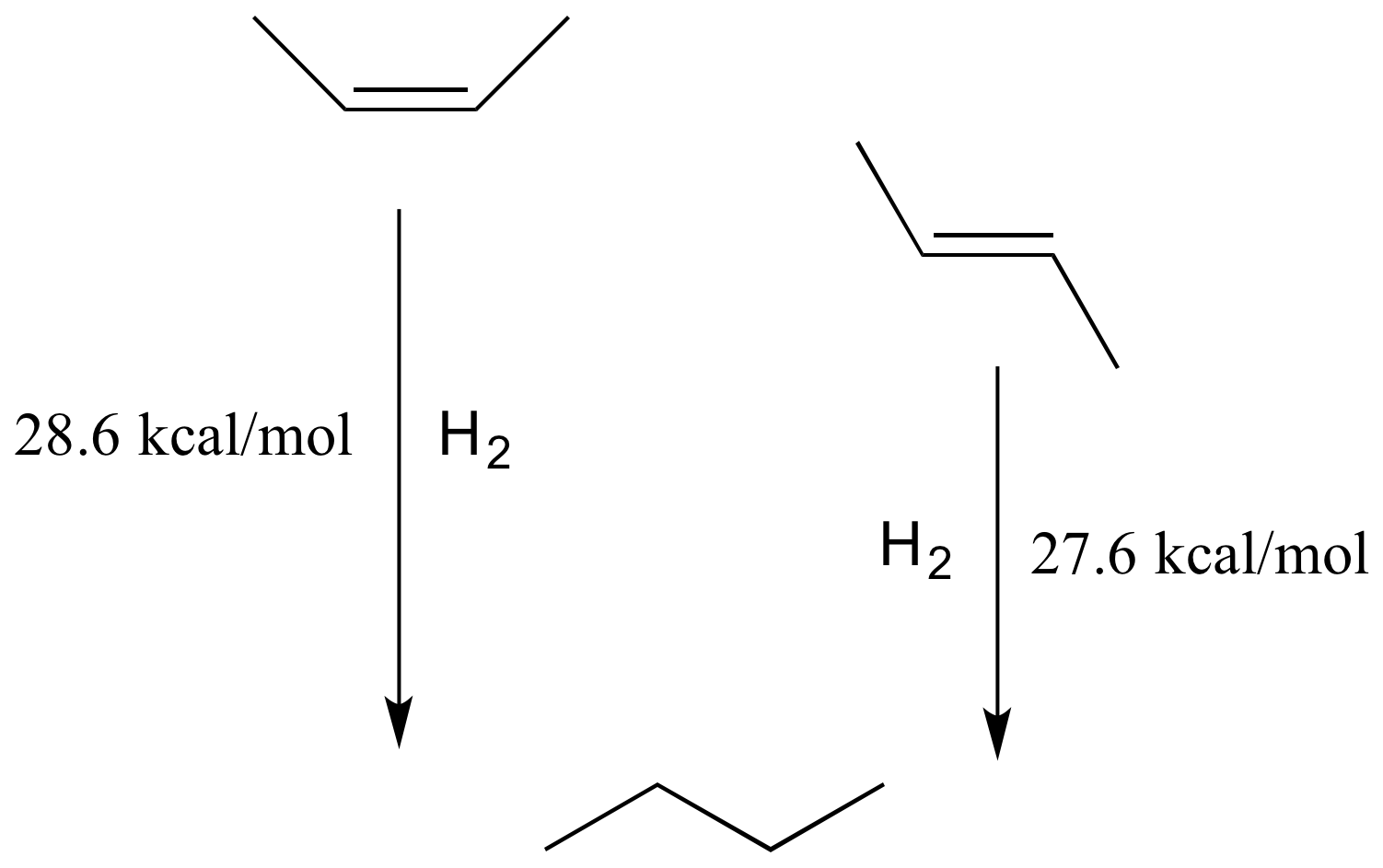
Como regla general, los alquenos con los grupos más voluminosos en lados opuestos del doble enlace son más estables, debido a la reducción de la tensión estérica. El diastereómero trans (E) del 2-buteno, por ejemplo, es ligeramente menor en energía que el diastereómero cis (Z), como se ve por sus calores relativos de hidrogenación a butano (ver sección 2.2C para un recordatorio del significado de 'calor de hidrogenación').
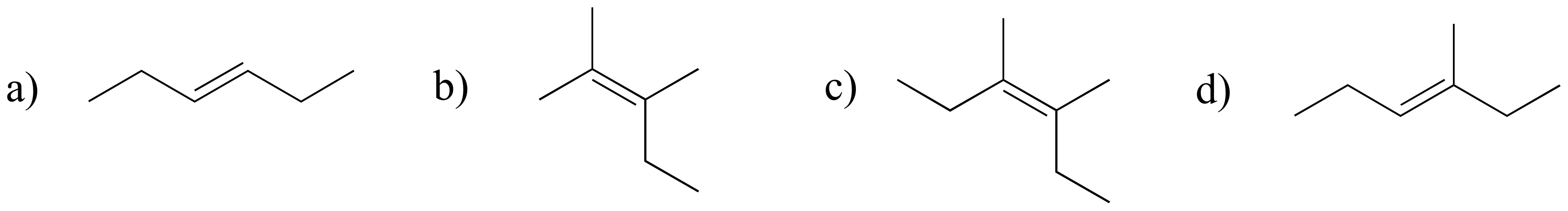
Ejercicio 3.25
Marque los grupos alquenos a continuación como E, Z o N (para un alqueno no estereogénico).
Ejercicio 3.26
Los compuestos que se muestran a continuación fueron todos aislados de fuentes naturales y sus estructuras reportadas en un número de 2007 de la revista Journal of Natural Products, una publicación de la American Chemical Society. Marque todos los grupos alquenos que no estén dentro de anillos de 5 o 6 miembros como E, Z o N (para un alqueno no estereogénico).
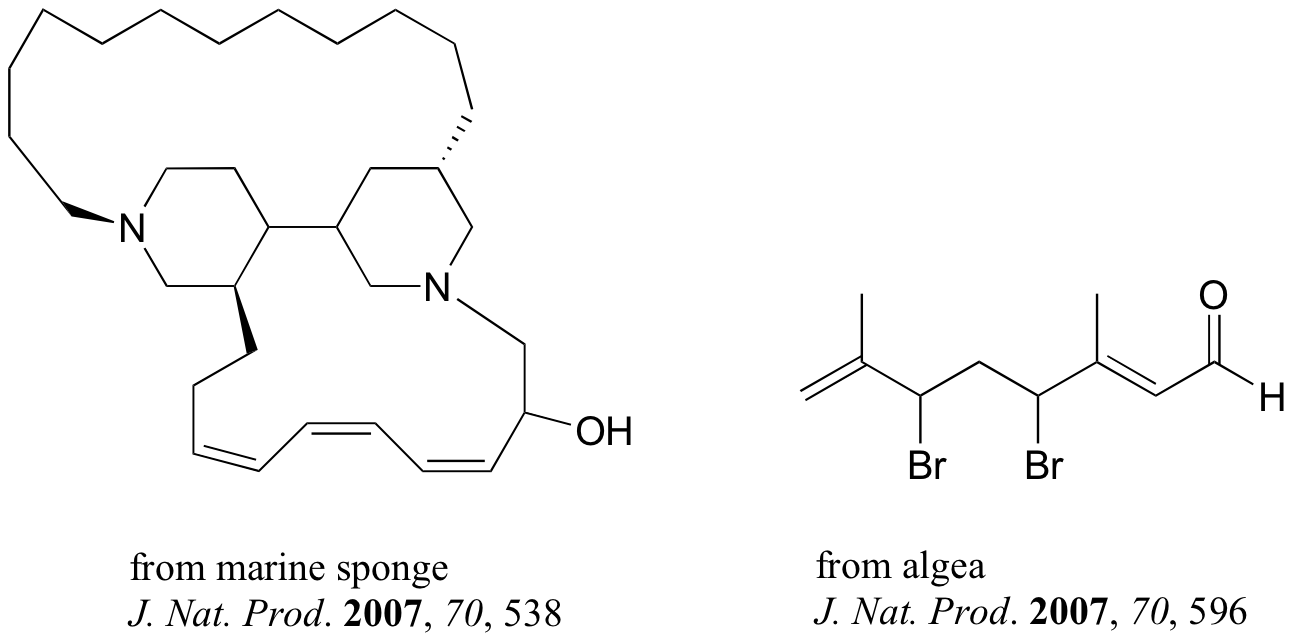
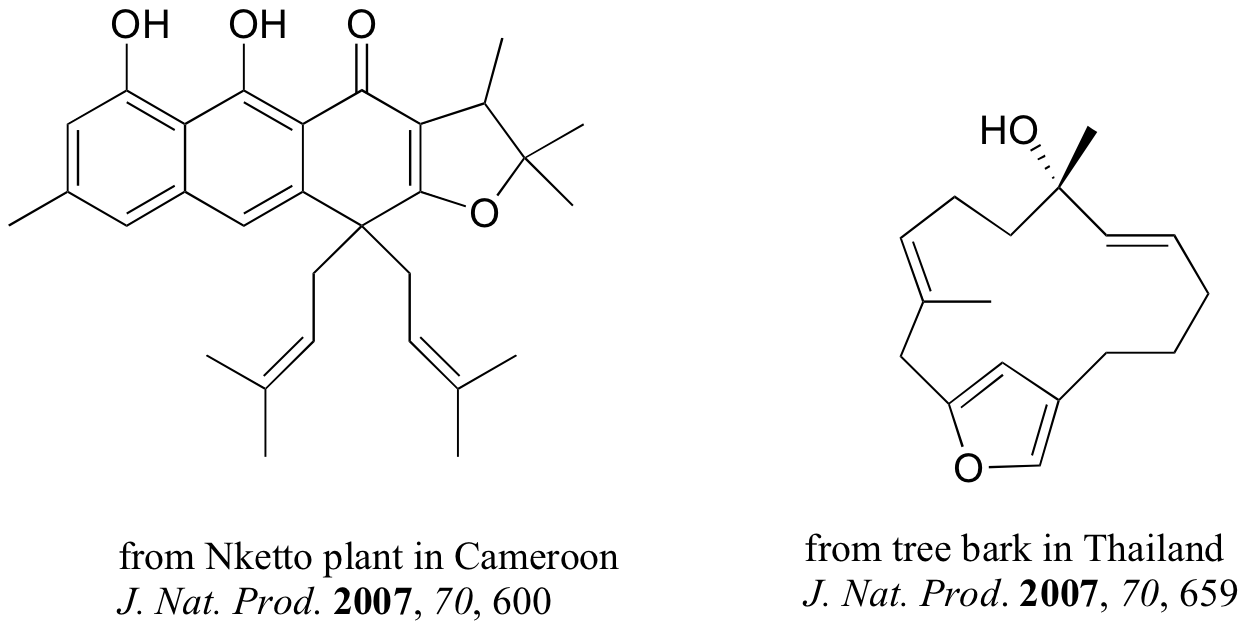
¿Cuántos estereoisómeros posibles?
¿Cómo sabemos cuántos estereoisómeros son posibles para una estructura dada? En realidad, hay una manera sencilla de resolver esto. Todo lo que tenemos que hacer es contar el número de centros quirales y grupos alquenos estereogénicos, el uso de esta regla siguiente:
número de formas estereoisoméricas = 2 n
.. donde n = el número de centros quirales más el número de grupos alquenos estereogénicos
(la rara excepción a esta regla es cuando es posible una forma meso - en este caso, la regla se convierte en 2 n -1)
Consideremos por ejemplo una molécula con dos centros quirales y un alqueno estereogénico. Por la regla antes señalada, sabemos de inmediato que debe haber ocho posibles estereoisómeros. Dibujando todas las posibilidades, vemos:
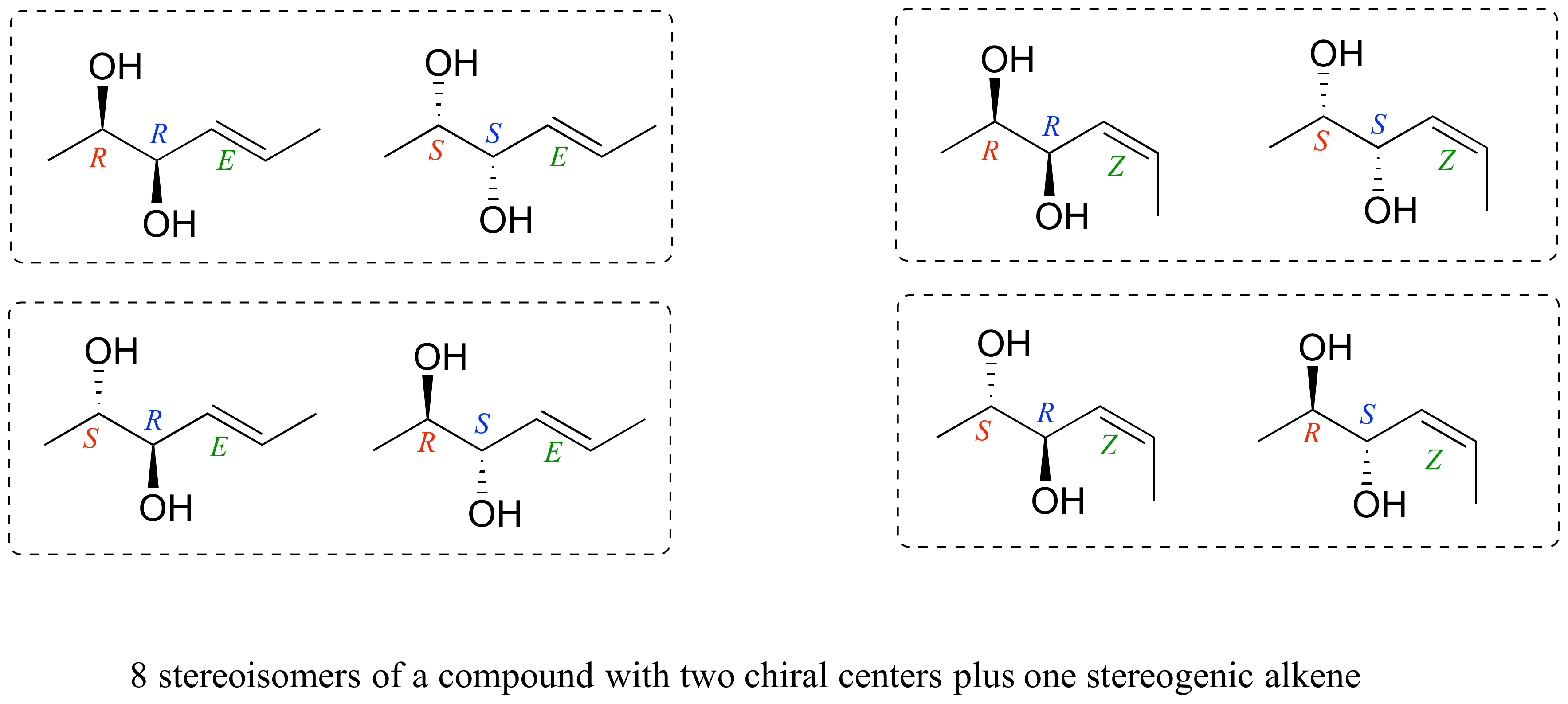
Vemos que, por ejemplo, R R E tiene un enantiómero, el compuesto S S E. Los otros seis estereoisómeros son todos diastereómeros de R R E.
Es necesario destacar que el enantiómero del compuesto RRE es el compuesto SSE, no el compuesto SSZ. Recuerde, la relación E/Z es diastereomérica, no enantiomérica. Usa modelos para convencerte de que los isómeros RRE y SSE son imágenes especulares entre sí, mientras que los compuestos RRE y SSZ no lo son. En general, para obtener el enantiómero de un compuesto, invertimos todos los centros quirales pero dejamos todos los alquenos estereogénicos iguales.
Dibujar el enantiómero de cada uno de los compuestos a continuación, y asignar configuraciones a todos los centros quirales y alquenos estereogénicos. ¿Cuántos diastereómeros son posibles para cada una de las estructuras que dibujaste?



