4.2: Introducción a la espectroscopia molecular
- Page ID
- 72067
El espectro electromagnético
La radiación electromagnética, como recordarás de una clase anterior de química o física, está compuesta por ondas eléctricas y magnéticas que oscilan en planos perpendiculares. La luz visible es radiación electromagnética. Así son los rayos gamma que son emitidos por el combustible nuclear gastado, los rayos X que usa un médico para visualizar tus huesos, la luz ultravioleta que provoca una dolorosa quemadura solar cuando te olvidas de aplicar bloqueador solar, la luz infrarroja que usa el ejército en las gafas de visión nocturna, las microondas que usas para calentar tu burritos congelados, y las ondas de radiofrecuencia que traen música a cualquiera que sea lo suficientemente anticuado como para seguir escuchando radio FM o AM.
Al igual que las olas del océano, las ondas electromagnéticas viajan en una dirección definida. Si bien la velocidad de las olas oceánicas puede variar, sin embargo, la velocidad de las ondas electromagnéticas —comúnmente conocida como la velocidad de la luz— es esencialmente una constante, aproximadamente 300 millones de metros por segundo. Esto es cierto ya sea que estemos hablando de radiación gamma o de luz visible. Obviamente, hay una gran diferencia entre estos dos tipos de ondas —estamos rodeados de estas últimas durante más de la mitad de nuestro tiempo en la tierra, mientras que ojalá nunca nos expongamos a las primeras en grado significativo. Las diferentes propiedades de los distintos tipos de radiación electromagnética se deben a diferencias en sus longitudes de onda, y las diferencias correspondientes en sus energías: longitudes de onda más cortas corresponden a energía mayor.
La radiación de alta energía (como los rayos gamma y los rayos X) se compone de ondas muy cortas, tan cortas como 10 -16 metros de cresta a cresta. Las olas más largas son mucho menos energéticas y, por lo tanto, son menos peligrosas para los seres vivos. Las ondas de luz visible están en el rango de 400 — 700 nm (nanómetros, o 10-9 m), mientras que las ondas de radio pueden tener varios cientos de metros de longitud.
La noción de que la radiación electromagnética contiene una cantidad cuantificable de energía tal vez pueda entenderse mejor si hablamos de la luz como una corriente de partículas, llamadas fotones, en lugar de como una onda. (Recordemos el concepto conocido como 'dualidad onda-partícula': a nivel cuántico, el comportamiento de las ondas y el comportamiento de las partículas se vuelven indistinguibles, y las partículas muy pequeñas tienen una 'longitud de onda' observable). Si describimos la luz como una corriente de fotones, la energía de una longitud de onda particular se puede expresar como:
\[E = \dfrac{hc}{\lambda} \tag{4.1.1}\]
donde E es energía en kJ/mol, λ (la letra griega lambda) es longitud de onda en metros, c es 3.00 x 10 8 m/s (la velocidad de la luz), y h es 3.99 x 10 -13 kJ·s·mol -1, un número conocido como La constante de Planck.
Debido a que la radiación electromagnética viaja a una velocidad constante, cada longitud de onda corresponde a una frecuencia dada, que es el número de veces por segundo que una cresta pasa por un punto dado. Las ondas más largas tienen frecuencias más bajas y las ondas más cortas tienen frecuencias más altas. La frecuencia se reporta comúnmente en hercios (Hz), lo que significa 'ciclos por segundo', u 'ondas por segundo'. La unidad estándar para frecuencia es s -1.
Al hablar de ondas electromagnéticas, podemos referirnos ya sea a la longitud de onda o a la frecuencia - los dos valores se interconvierten usando la expresión simple:
\[\lambda \nu = c \tag{4.1.2}\]
donde ν (la letra griega 'nu') es la frecuencia en s -1. La luz roja visible con una longitud de onda de 700 nm, por ejemplo, tiene una frecuencia de 4.29 x 10 14 Hz, y una energía de 40.9 kcal por mol de fotones. El rango completo de longitudes de onda de radiación electromagnética se conoce como el espectro electromagnético.
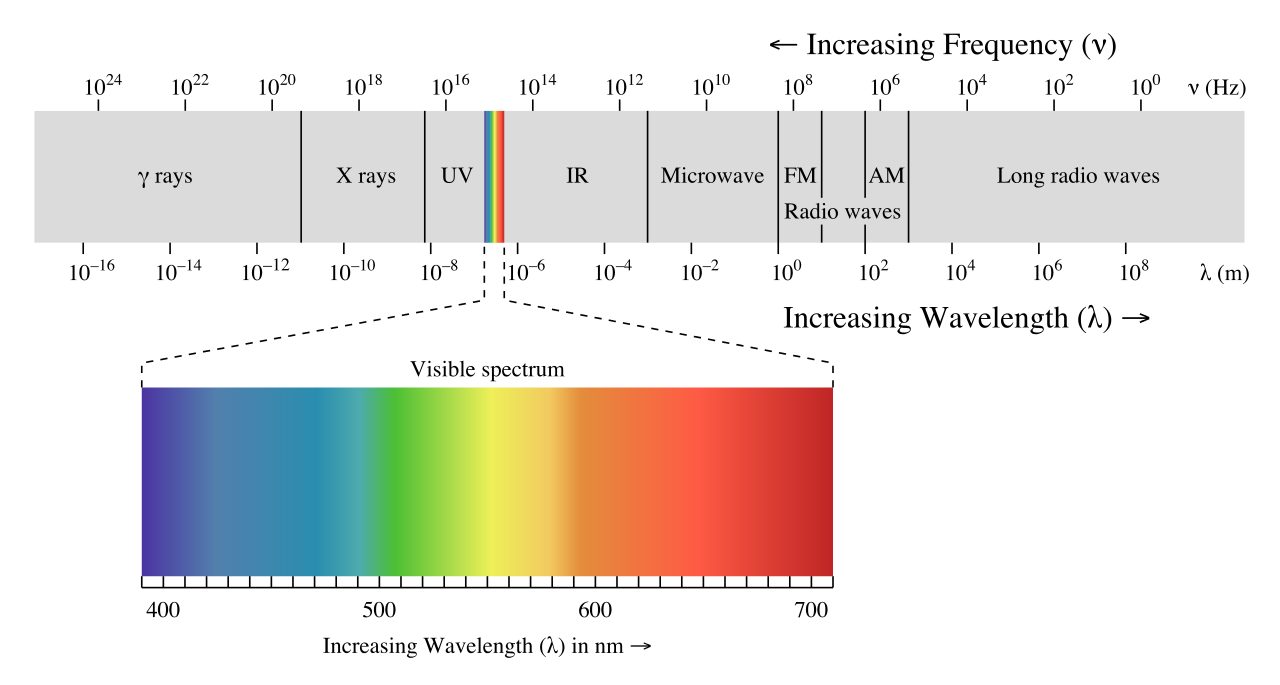
(Imagen de Wikipedia commons)
Observe que la luz visible ocupa solo una banda estrecha del espectro completo. La luz blanca del sol o una bombilla es una mezcla de todas las longitudes de onda visibles. Ves la región visible del espectro electromagnético dividida en sus diferentes longitudes de onda cada vez que ves un arco iris: la luz violeta tiene la longitud de onda más corta, y la luz roja tiene la más larga.
La luz visible tiene un rango de longitud de onda de aproximadamente 400-700 nm. ¿Cuál es el rango de frecuencia correspondiente? ¿Cuál es el rango de energía correspondiente, en kJ/mol de fotones?
Soluciones
Resumen de un experimento de espectroscopía molecular
In a spectroscopy experiment, electromagnetic radiation of a specified range of wavelengths is allowed to pass through a sample containing a compound of interest. The sample molecules absorb energy from some of the wavelengths, and as a result jump from a low energy ‘ground state’ to some higher energy ‘excited state’. Other wavelengths are not absorbed by the sample molecule, so they pass on through. A detector on the other side of the sample records which wavelengths were absorbed, and to what extent they were absorbed.
Here is the key to molecular spectroscopy: a given molecule will specifically absorb only those wavelengths which have energies that correspond to the energy difference of the transition that is occurring. Thus, if the transition involves the molecule jumping from ground state A to excited state B, with an energy difference of ΔE, the molecule will specifically absorb radiation with wavelength that corresponds to ΔE, while allowing other wavelengths to pass through unabsorbed.
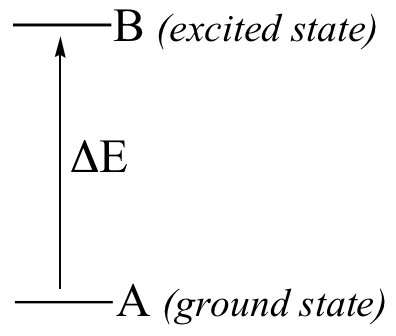
By observing which wavelengths a molecule absorbs, and to what extent it absorbs them, we can gain information about the nature of the energetic transitions that a molecule is able to undergo, and thus information about its structure.
These generalized ideas may all sound quite confusing at this point, but things will become much clearer as we begin to discuss specific examples.


