4.3: Espectrometría de Masas
- Page ID
- 72043
La espectrometría de masas (EM) es una poderosa técnica analítica ampliamente utilizada por químicos, biólogos, investigadores médicos y científicos ambientales y forenses, entre otros. Con la EM, estamos observando la masa de una molécula, o de diferentes fragmentos de esa molécula.
Conceptos básicos de un experimento de espectrometría de masas
Hay muchos tipos diferentes de instrumentos MS, pero todos tienen los mismos tres componentes esenciales. En primer lugar, existe una fuente de ionización, donde a la molécula se le da una carga eléctrica positiva, ya sea mediante la eliminación de un electrón o mediante la adición de un protón. Dependiendo del método de ionización utilizado, la molécula ionizada puede o no romperse en una población de fragmentos más pequeños. En la siguiente figura, algunas de las moléculas de muestra permanecen enteras, mientras que otras se fragmentan en trozos más pequeños.
A continuación en línea hay un analizador de masas, donde los fragmentos catiónicos se separan según su masa.
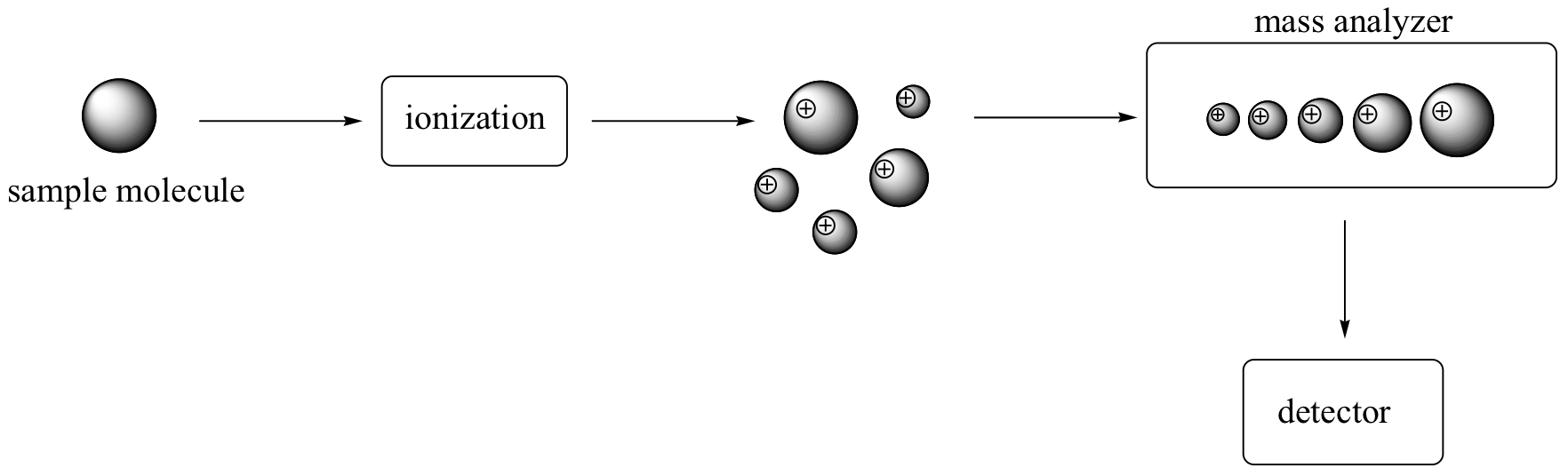
Finalmente, hay un detector, que detecta y cuantifica los iones separados.
Uno de los tipos más comunes de técnicas de EM utilizadas en el laboratorio orgánico es la ionización electrónica. En la fuente de ionización, la molécula de muestra es bombardeada por un haz de electrones de alta energía, lo que tiene el efecto de derribar un electrón de valencia de la molécula para formar un catión radical. Debido a que gran cantidad de energía es transferida por este proceso de bombardeo, el catión radical rápidamente comienza a descomponerse en fragmentos más pequeños, algunos de los cuales están cargados positivamente y algunos de los cuales son neutros. Los fragmentos neutros son adsorbidos sobre las paredes de la cámara o son retirados por una fuente de vacío. En el componente del analizador de masas, los fragmentos cargados positivamente y cualquier resto de iones moleculares no fragmentados son acelerados por un tubo por un campo eléctrico.
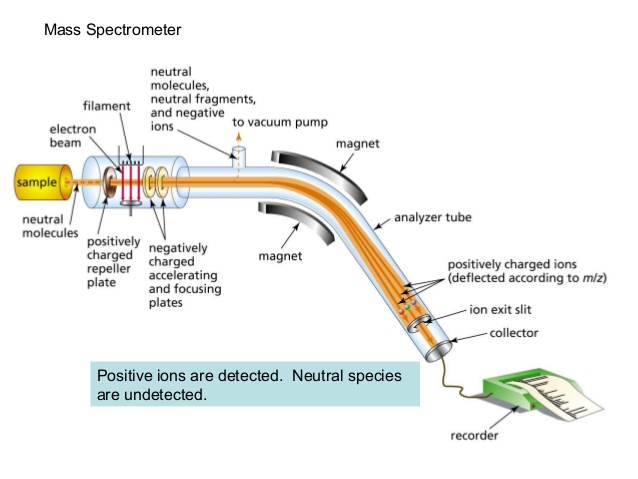
(Imagen de Wikipedia Commons)
Este tubo es curvo, y los iones son desviados por un fuerte campo magnético. Los iones de diferentes relaciones de masa a carga (m/z) se desvía en una medida diferente, lo que resulta en una 'clasificación' de iones por masa (prácticamente todos los iones tienen cargas de z = +1, por lo que clasificar por la relación masa a carga es lo mismo que clasificar por masa). Un detector al final del tubo de vuelo curvo registra y cuantifica los iones clasificados.
Mirando los espectros de masas
A continuación se muestra la salida típica para un experimento de MS de ionización electrónica (los datos de MS en la sección se derivan de la base de datos espectral para compuestos orgánicos, un servicio gratuito basado en la web proporcionado por AIST en Japón.
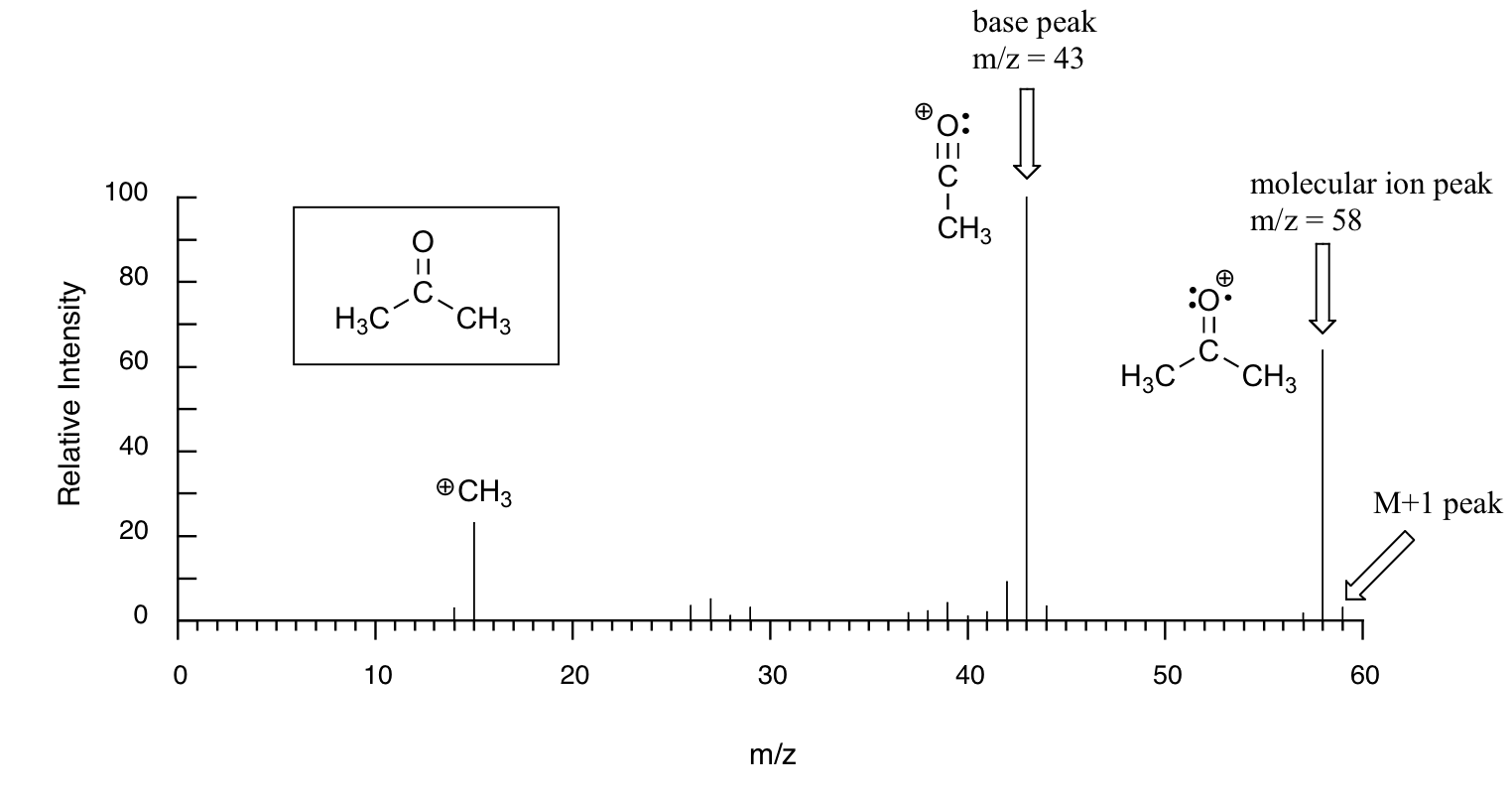
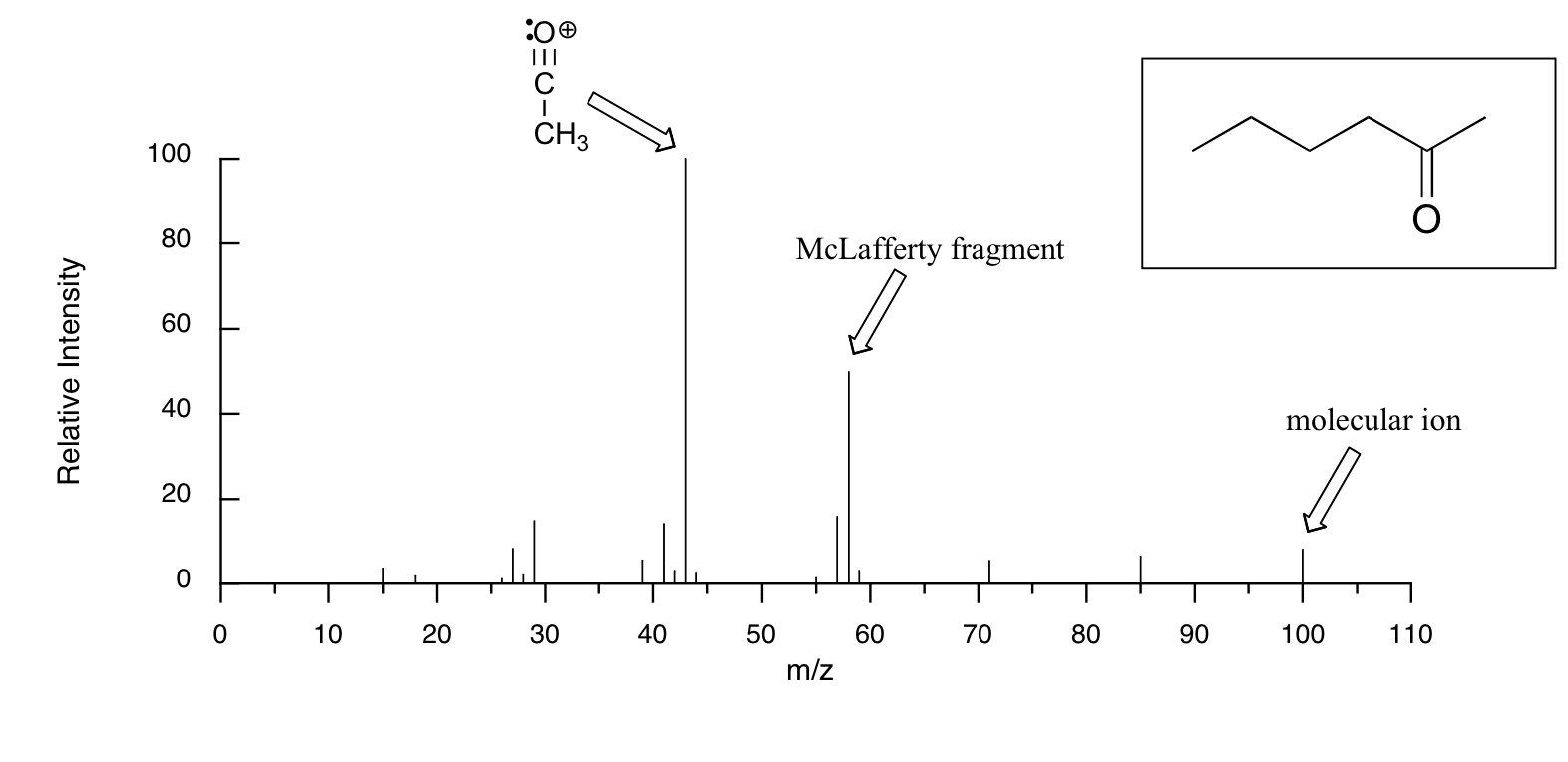
La muestra es acetona. En el eje horizontal está el valor para m/z (como dijimos anteriormente, la carga z es casi siempre +1, por lo que en la práctica esto es lo mismo que la masa). En el eje vertical se encuentra la abundancia relativa de cada ion detectado. En esta escala, el ion más abundante, llamado pico base, se establece en 100%, y todos los demás picos se registran en relación con este valor. Para la acetona, el pico base está en m/z = 43 - discutiremos la formación de este fragmento un poco más adelante. El peso molecular de la acetona es 58, por lo que podemos identificar el pico a m/z = 58 como el correspondiente al pico de iones moleculares, o pico parental. Observe que hay un pequeño pico a m/z = 59: esto se conoce como el pico M+1. ¿Cómo puede haber un ion que tenga una masa mayor que el ion molecular? Simple: una pequeña fracción -aproximadamente 1.1%- de todos los átomos de carbono en la naturaleza son en realidad el isótopo 13 C en lugar del 12 C. El isótopo 13 C es, por supuesto, más pesado que 12 C por 1 unidad de masa. Además, alrededor de 0.015% de todos los átomos de hidrógeno son en realidad deuterio, el isótopo 2H. Entonces el pico M+1 representa aquellas pocas moléculas de acetona en la muestra que contenían ya sea un 13 C o 2 H.
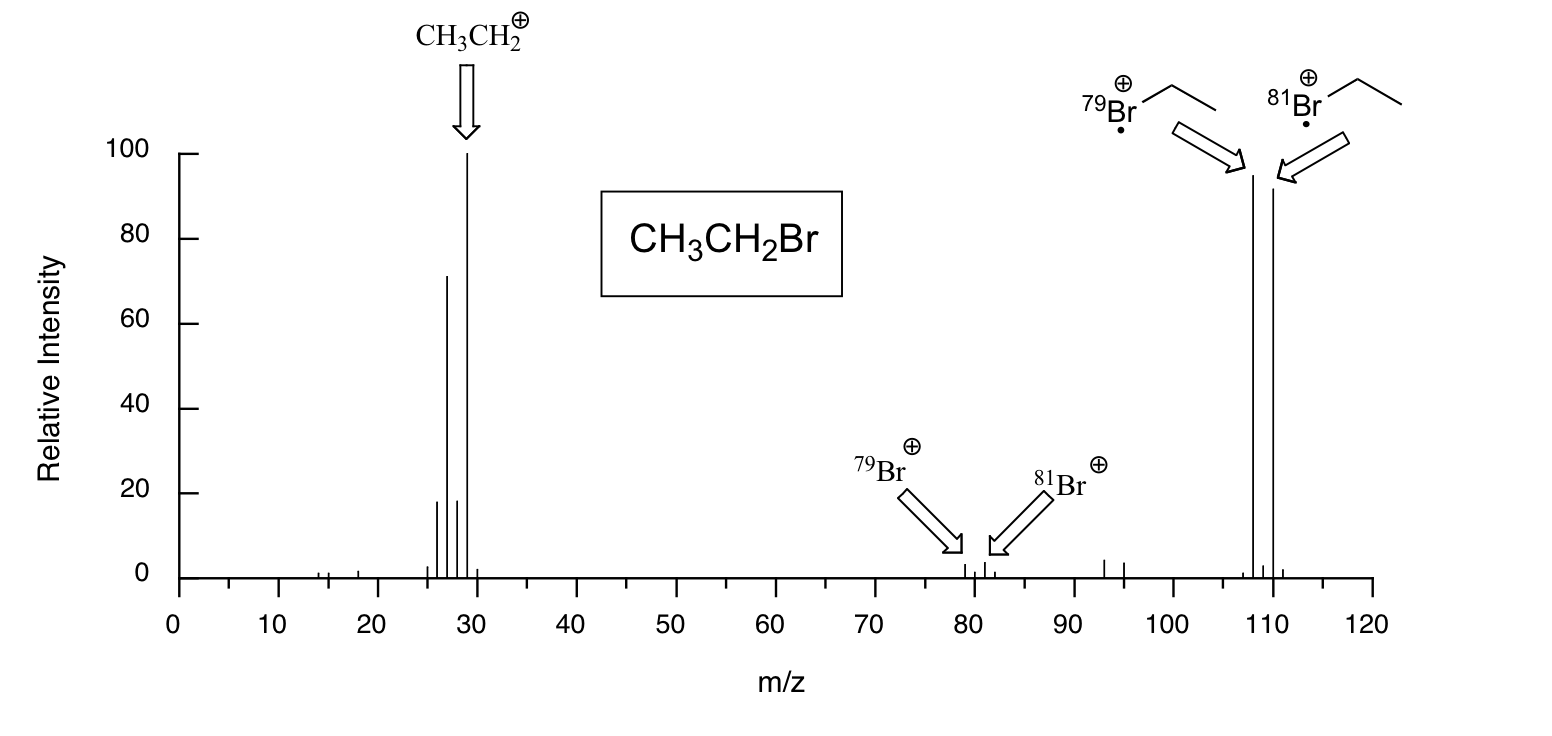
Las moléculas con muchos átomos de oxígeno a veces muestran un pequeño pico M+2 (unidades 2 m/z mayores que el pico parental) en sus espectros de masas, debido a la presencia de una pequeña cantidad de 18 O (el isótopo más abundante de oxígeno es 16 O). Debido a que existen dos isótopos abundantes tanto de cloro (aproximadamente 75% 35 Cl y 25% 37 Cl) como de bromo (aproximadamente 50% 79 Br y 50% 81 Br), los compuestos clorados y bromados tienen picos M+2 muy grandes y reconocibles. Los fragmentos que contienen ambos isótopos de Br se pueden ver en el espectro de masas del bromuro de etilo:
Gran parte de la utilidad en la EM de ionización de electrones proviene del hecho de que los cationes radicales generados en el proceso de bombardeo de electrones tienden a fragmentarse de manera predecible. El análisis detallado de los patrones típicos de fragmentación de diferentes grupos funcionales está fuera del alcance de este texto, pero vale la pena ver algunos ejemplos representativos, aunque no intentemos entender el proceso exacto por el cual se produce la fragmentación. Vimos, por ejemplo, que el pico base en el espectro de masas de la acetona es m/z = 43. Esto es el resultado de la escisión en la posición 'alfa', es decir, en el enlace carbono-carbono adyacente al carbonilo. La escisión alfa da como resultado la formación de un ion acilio (que representa el pico base a m/z = 43) y un radical metilo, el cual es neutro y por lo tanto no se detecta.
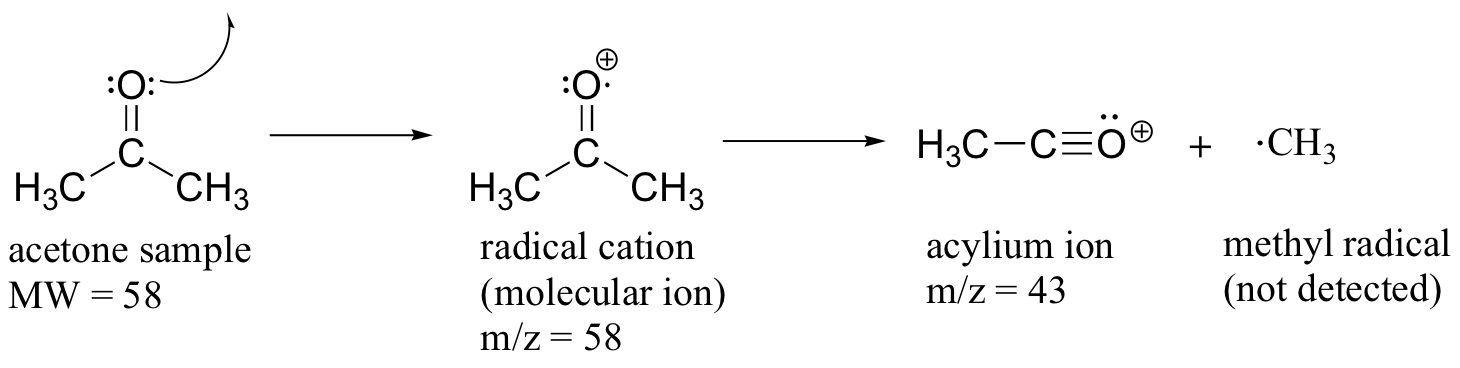
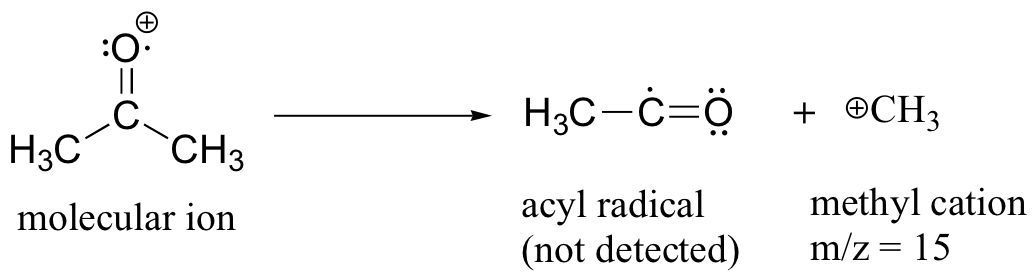
Después del pico parental y el pico base, el siguiente pico más grande, con una abundancia relativa de 23%, se encuentra en m/z = 15. Esto, como cabría esperar, es el resultado de la formación de un catión metilo, además de un radical acilo (que es neutro y no detectado).
Un patrón de fragmentación común para compuestos carbonílicos más grandes se denomina reordenamiento de McLaFerty:
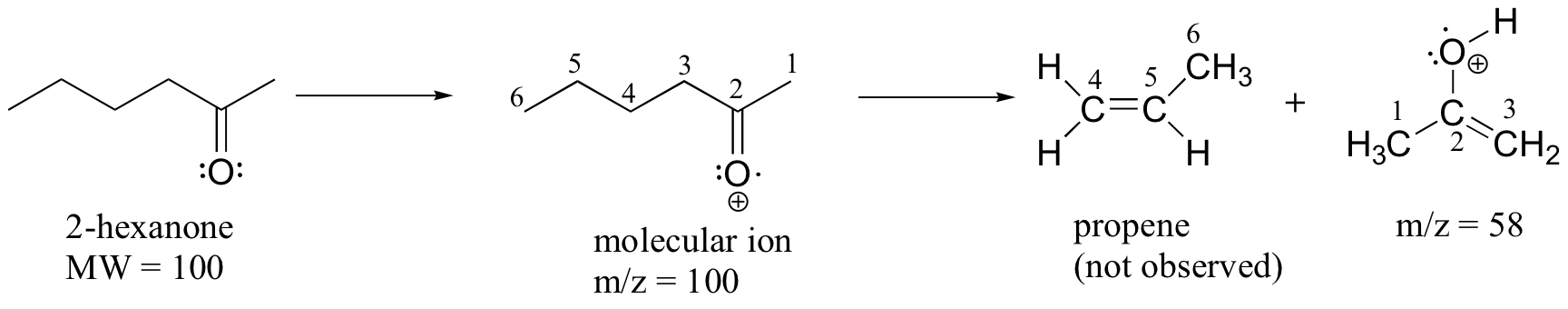
El espectro de masas de 2-hexanona muestra un 'fragmento McLaferty' a m/z = 58, mientras que el fragmento de propeno no se observa porque es una especie neutra (recuerde, solo se observan fragmentos catiónicos en MS). El pico base en este espectro es nuevamente un ion acilio.
Cuando los alcoholes se someten a MS de ionización electrónica, el ion molecular es altamente inestable y, por lo tanto, a menudo no se detecta un pico parental. A menudo, el pico base es de un ion 'oxonio'.

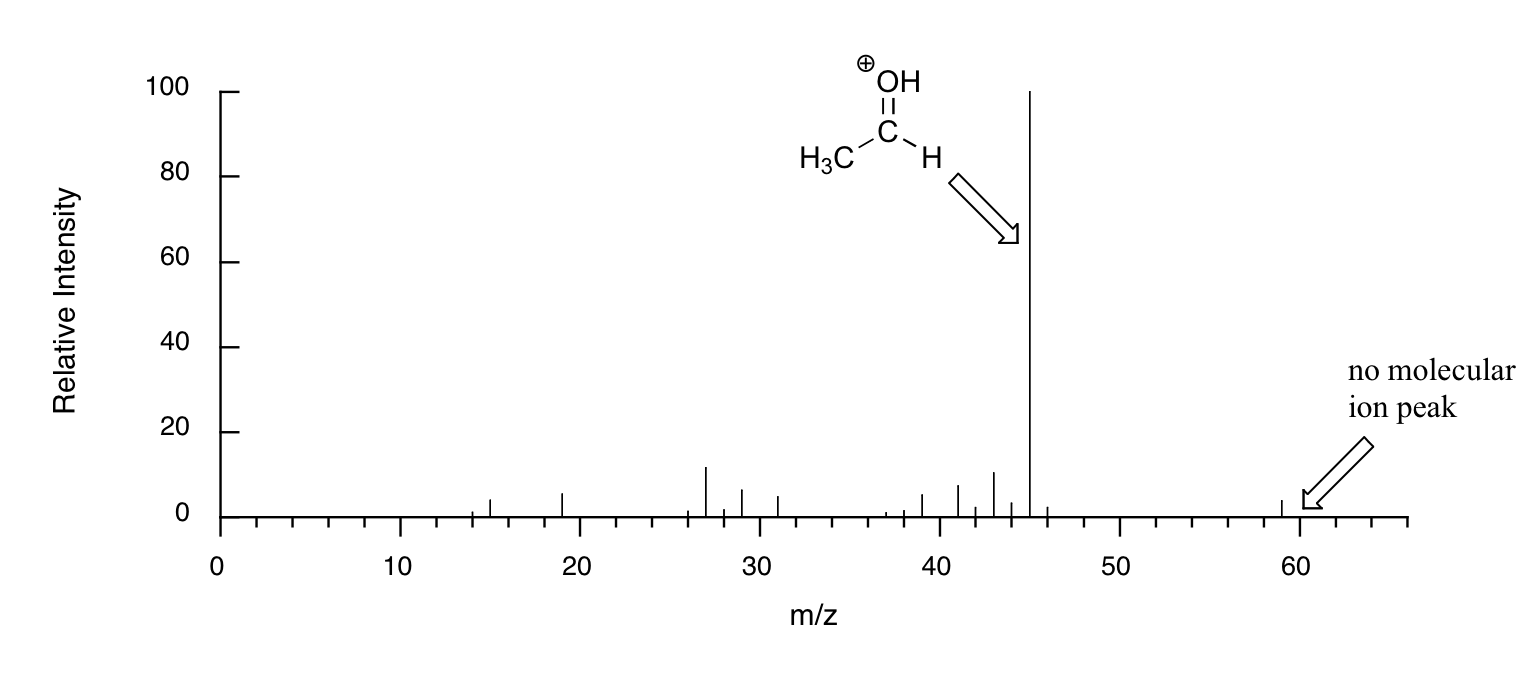
Otros grupos funcionales también tienen patrones de fragmentación predecibles. Al analizar cuidadosamente la información de fragmentación que proporciona un espectro de masas, un espectrómetro experto a menudo puede “unir el rompecabezas” y hacer algunas predicciones muy seguras sobre la estructura de la muestra inicial. Puedes ver muchos más ejemplos reales de espectros de masas en la Base de Datos Espectrales para Compuestos Orgánicos
Usando los patrones de fragmentación para la acetona como guía, predice las señales que encontrarías en los espectros de masas de:
a) 2-butanona; b) 3-hexanona; c) ciclopentanona
Predecir algunas señales que esperarías ver en un espectro de masas de 2-cloropropano.
El espectro de masas de un aldehído muestra un pico parental a m/z = 58 y un pico base a m/z = 29. Proponer una estructura e identificar las dos especies cuyos valores de m/z fueron listados. (
Cromatografía de gases - espectrometría de masas
Muy a menudo, la espectrometría de masas se utiliza en conjunto con una técnica de separación llamada cromatografía de gases (GC). El procedimiento combinado de GC-MS es muy útil cuando se trata de una muestra que es una mezcla de dos o más compuestos diferentes, debido a que los diversos compuestos se separan entre sí antes de ser sometidos individualmente a análisis de EM. Aquí no entraremos en los detalles de la cromatografía de gases, aunque si estás tomando un curso de laboratorio orgánico bien podrías tener la oportunidad de probar suerte en GC, y es casi seguro que estarás expuesto a las técnicas conceptualmente análogas de la cromatografía de capa fina y columna. Baste decir que en GC, una cantidad muy pequeña de una muestra líquida es vaporizada, inyectada en una columna metálica larga y enrollada, y empujada a través de la columna por gas helio. En el camino, diferentes compuestos en la muestra se adhieren a las paredes de la columna en diferentes grados, y así viajan a diferentes velocidades y emergen por separado del extremo de la columna. En GC-MS, cada compuesto purificado se envía directamente desde el final de la columna GC al instrumento MS, por lo que al final obtenemos un espectro de masas separado para cada uno de los compuestos en la muestra mixta original. Debido a que el espectro MS de un compuesto es una 'huella' muy confiable y reproducible, podemos instruir al instrumento para que busque en una base de datos MS e identifique cada compuesto en la muestra.
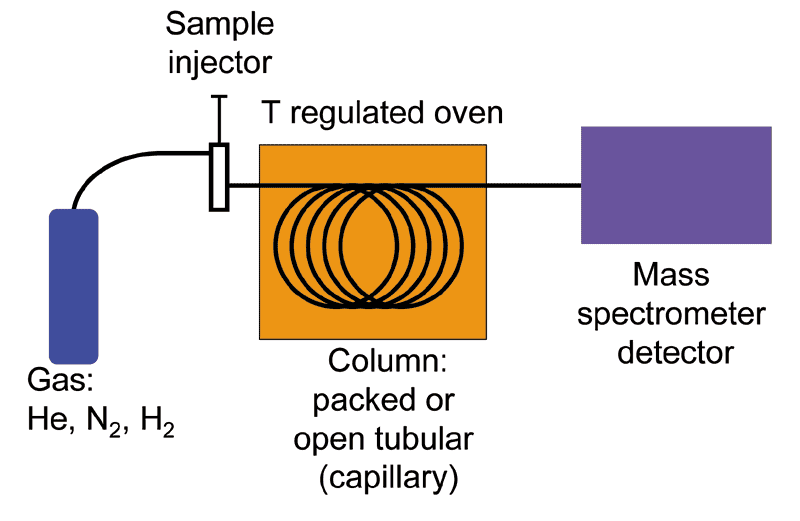
Esquema de cromatografía de gases-espectrometría de masas (GC-MS)
(Imagen de Wikipedia por K. Murray)
La sensibilidad extremadamente alta de la instrumentación moderna de GC-MS permite detectar e identificar pequeñas cantidades traza de compuestos orgánicos. Los químicos ambientales utilizan cada vez más GC-MS para detectar la presencia de contaminantes orgánicos dañinos en muestras de alimentos y agua. Los cribas de seguridad aeroportuaria también utilizan instrumentos GC-MS de alta velocidad para buscar residuos de productos químicos para fabricar bombas en el equipaje facturado.
Espectrometría de masas de proteínas - aplicaciones en proteómica
La espectrometría de masas por ionización electrónica generalmente no es muy útil para analizar biomoléculas: su alta polaridad dificulta su entrada en fase vapor, el primer paso en EIMS. La espectrometría de masas de biomoléculas ha experimentado una revolución en las últimas décadas, con muchas nuevas técnicas de ionización y separación que se están desarrollando. Generalmente, la estrategia para el análisis de biomoléculas implica la ionización suave, en la que se imparte mucha menos energía (en comparación con técnicas como EIMS) a la molécula que se analiza durante el proceso de ionización. Por lo general, la ionización suave implica agregar protones en lugar de eliminar electrones: los cationes formados de esta manera son significativamente menos energéticos que los cationes radicales formados por la eliminación de un electrón. El resultado de la ionización suave es que se produce poca o ninguna fragmentación, por lo que la masa que se mide es la de una molécula intacta. Por lo general, las biomoléculas grandes se digieren en trozos más pequeños usando métodos químicos o enzimáticos, luego sus masas se determinan por MS “blanda”
Los nuevos desarrollos en la tecnología MS de ionización blanda han facilitado la detección e identificación de proteínas que están presentes en cantidades muy pequeñas en muestras biológicas. En la ionización por electroaspersión (ESI), la muestra de proteína, en solución, se pulveriza en un tubo y las moléculas son inducidas por un campo eléctrico para recoger protones adicionales del disolvente. Otro método común de 'ionización suave' es la 'ionización por desorción láser asistida por matriz' (MALDI). Aquí, la muestra de proteína se adsorbe sobre una matriz sólida, y la protonación se logra con un láser.
Típicamente, tanto la ionización por electronebulización como MALDI se utilizan junto con un componente analizador de masas de tiempo de vuelo (TOF).

Las proteínas son aceleradas por un electrodo a través de una columna, y la separación se logra porque los iones más ligeros viajan a mayor velocidad que los iones más pesados con la misma carga general. De esta manera, se pueden separar las muchas proteínas de una muestra biológica compleja (como plasma sanguíneo, orina, etc.) y determinar con mucha precisión sus masas individuales. La proteína moderna MS es extremadamente sensible — ¡recientemente, los científicos incluso pudieron detectar la presencia de la proteína Tyrannosaurus rex en un esqueleto fosilizado! (Ciencia 2007, 316, 277).
La espectrometría de masas de ionización blanda se ha convertido en los últimos años en una herramienta cada vez más importante en el campo de la proteómica. Tradicionalmente, los bioquímicos proteicos tienden a estudiar la estructura y función de las proteínas individuales. Los investigadores de la proteómica, en contraste, quieren aprender más sobre cómo interactúan entre sí un gran número de proteínas en un sistema vivo, y cómo responden a los cambios en el estado del organismo. Un subcampo importante de la proteómica es la búsqueda de 'biomarcadores' proteicos para enfermedades humanas: es decir, proteínas que están presentes en mayores cantidades en los tejidos de una persona enferma que en una persona sana. La detección en una persona sana de un biomarcador conocido para una enfermedad como la diabetes o el cáncer podría proporcionar a los médicos una alerta temprana de que el paciente puede ser especialmente susceptible a la enfermedad, por lo que se podrían tomar medidas preventivas para prevenir o retrasar la aparición.
En un estudio de 2005, se utilizó la espectrometría de masas MALDI-TOF para comparar muestras de fluidos de receptores de trasplante de pulmón que habían sufrido rechazo de tejido con muestras de receptores que no habían sufrido rechazo. Se encontró que tres péptidos (proteínas cortas) estaban presentes en niveles elevados específicamente en las muestras de rechazo tisular. Se espera que estos péptidos puedan servir como biomarcadores para identificar a los pacientes que tienen un mayor riesgo de rechazar sus pulmones trasplantados. (Proteomics 2005, 5, 1705).


