5.3: Equivalencia Química
- Page ID
- 72408
La frecuencia de radiación absorbida por un protón (o cualquier otro núcleo) durante una transición de espín en un experimento de RMN se llama su 'frecuencia de resonancia'. Si todos los protones en todas las moléculas orgánicas tuvieran la misma frecuencia de resonancia, la espectroscopia de RMN pero no sería terriblemente útil para los químicos. Afortunadamente para nosotros, sin embargo, las frecuencias de resonancia no son uniformes para diferentes protones en una molécula, sino que la frecuencia de resonancia varía según el entorno electrónico en el que habita un protón dado. En el acetato de metilo, por ejemplo, hay dos 'conjuntos' distintos de protones.
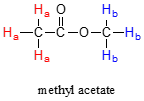
Los tres protones de acetato de metilo etiquetados anteriormente con Ha tienen una frecuencia de resonancia diferente en comparación con los tres protones Hb, debido a que los dos conjuntos de protones se encuentran en entornos electrónicos no idénticos: los\(H_a\) protones están en un carbono junto a un carbono carbonilo, mientras que los\(H_b\) protones o en un carbono junto a la un oxígeno. En la terminología de RMN, los tres\(H_a\) protones son químicamente equivalentes entre sí, al igual que los tres\(H_b\) protones. Los\(H_a\) protones son, sin embargo, químicamente no equivalentes a los\(H_b\) protones. Como consecuencia, la frecuencia de resonancia de los\(H_a\) protones es diferente de la de los\(H_b\) protones. Por ahora, no te preocupes por qué los diferentes entornos electrónicos dan lugar a diferentes frecuencias de resonancia -llegaremos a eso pronto.
La capacidad de reconocer la equivalencia química y la no equivalencia entre los átomos en una molécula será fundamental para comprender la RMN. Cada una de las moléculas siguientes contiene solo un conjunto de protones químicamente equivalentes: los seis protones del benceno, por ejemplo, son equivalentes entre sí y tienen la misma frecuencia de resonancia en un experimento de RMN. Observe que cualquier descripción de la unión y posición de un protón en el benceno también se aplica a los otros cinco protones.
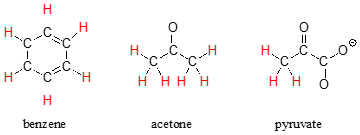
Cada una de las moléculas de la siguiente figura contiene dos conjuntos de protones químicamente equivalentes, al igual que nuestro ejemplo anterior de acetato de metilo, y nuevamente en cada caso la frecuencia de resonancia de los\(H_a\) protones será diferente a la de los\(H_b\) protones.
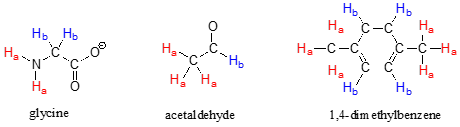
Tomemos como ejemplo el acetaldehído: una descripción de la unión y posición del\(H_b\) protón no se aplica a los tres\(H_a\) protones:\(H_b\) está unido a un carbono carbonilo\(sp^2\) hibridado mientras que los\(H_a\) protones están unidos a un carbono metílico\(sp^3\) -hibridado.
Tenga en cuenta que si bien los cuatro protones aromáticos en 1,4-dimetilbenceno son químicamente equivalentes, su isómero constitucional 1,2 dimetilbenceno tiene dos conjuntos de protones aromáticos además de los seis protones metil (\(H_a\)). El isómero 1,3-sustituido, por otro lado, tiene tres conjuntos de protones aromáticos.
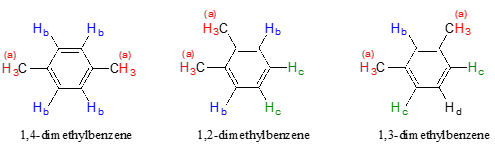
En el 1,2-dimetilbenceno, ambos\(H_b\) protones están adyacentes a un sustituyente metilo, mientras que ambos\(H_c\) protones están a dos carbonos de distancia. En 1,3-dimetilbenceno,\(H_b\) está situado entre dos grupos metilo, los dos\(H_c\) protones están a un carbono de distancia de un grupo metilo, y\(H_d\) está a dos carbonos de un grupo metilo.
Como probablemente ya se haya dado cuenta, la equivalencia química o no equivalencia en RMN está estrechamente relacionada con la simetría. Diferentes planos de simetría en los tres isómeros del dimetilbenceno conducen a diferentes patrones de equivalencia.
La estereoquímica puede desempeñar un papel en la determinación de la equivalencia o no equivalencia de núcleos en RMN. En el cloroeteno (comúnmente conocido como cloruro de vinilo, el compuesto utilizado para elaborar cloruro de polivinilo o PVC),\(H_a\) y\(H_b\) se encuentran en entornos electrónicos no equivalentes, debido a que\(H_a\) es cis al átomo de cloro mientras que Hb es trans. De igual manera, el Ha y Hb en el clorociclopropano no son equivalentes debido a sus posiciones ya sea en el mismo lado u opuesto del anillo con respecto al cloro.
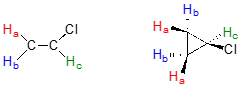
Si piensas en nuestra discusión sobre la proquiralidad en la sección 3.11, debes reconocer que los\(H_b\) protones\(H_a\) y en los ejemplos anteriores son pares diastereotópicos.
La mayoría de las moléculas orgánicas tienen varios conjuntos de protones en diferentes ambientes químicos, y cada conjunto tendrá una frecuencia de resonancia diferente en\(^1H\) espectroscopía de RMN. A continuación vemos algunos ejemplos de múltiples conjuntos de protones en moléculas biológicas.
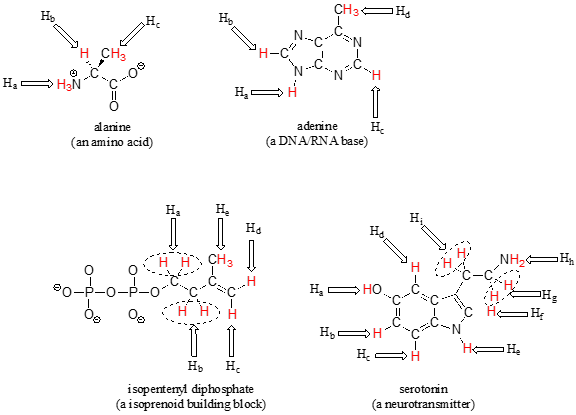
¿Cuántos conjuntos de protones equivalentes contienen las siguientes moléculas?