5.5: La base de las diferencias en el cambio químico
- Page ID
- 72462
Blindaje diamagnético y deshielding
Llegamos ahora a la pregunta de por qué los protones no equivalentes tienen diferentes frecuencias de resonancia y, por lo tanto, diferentes cambios químicos. El desplazamiento químico de un protón dado está determinado principalmente por las interacciones con los electrones cercanos. Lo más importante a entender es que cuando los electrones son sometidos a un campo magnético externo, forman sus propios pequeños campos magnéticos inducidos en oposición al campo externo.
Considere la molécula de metano (\(CH_4\)) en la que los cuatro protones equivalentes tienen un desplazamiento químico de 0.23 ppm (este es un valor que podemos buscar en cualquier fuente de referencia química). Los electrones de valencia alrededor del carbono metílico, cuando se someten a B0, generan su propio campo magnético inducido muy pequeño que se opone\(B_0\). Este campo inducido, en un grado pequeño pero significativo, protege a los protones cercanos de experimentar toda la fuerza de\(B_0\), un efecto conocido como blindaje diamagnético local. En otras palabras, los protones de metano no experimentan del todo la fuerza de\(B_0\) - lo que experimentan se llama\(B_{eff}\), o el campo efectivo, que es ligeramente más débil que\(B_0\) debido a la influencia de los electrones cercanos.
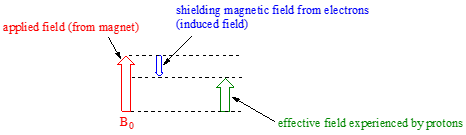
Debido a que\(B_{eff}\) es ligeramente más débil que B0, la frecuencia de resonancia (y por lo tanto el desplazamiento químico) del protón metano es ligeramente inferior a lo que sería si no tuviera electrones cerca y estuviera sintiendo toda la fuerza de\(B_0\). (Debe tener en cuenta que la figura anterior no es a escala: el campo aplicado es generado por un imán superconductor y es extremadamente fuerte, mientras que el campo inducido opuesto de los electrones es comparativamente muy pequeño.)
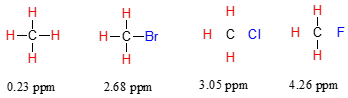
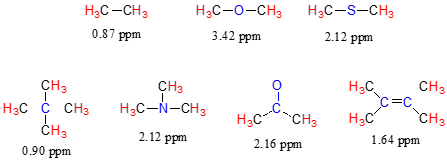
Ahora considere el fluoruro de metilo, el CH3F, en el que los protones tienen un desplazamiento químico de 4.26 ppm, significativamente mayor que el del metano. Esto es causado por algo llamado el efecto deshielding. Recordemos que el flúor es muy electronegativo: tira de electrones hacia sí mismo, disminuyendo efectivamente la densidad de electrones alrededor de cada uno de los protones. Para los protones, estar en un ambiente de menor densidad electrónica significa menos blindaje diamagnético, lo que a su vez significa una mayor exposición general a\(B_0\), una frecuencia de resonancia más fuerte\(B_{eff}\) y mayor. Dicho de otra manera, el flúor, al alejar la densidad de electrones de los protones, los está deshielding, dejándolos más expuestos\(B_0\). A medida que aumenta la electronegatividad del sustituyente, también lo hace el grado de deshielding, y también lo hace el desplazamiento químico. Esto es evidente cuando observamos los desplazamientos químicos del metano y tres compuestos de halometano (recordemos que la electronegatividad aumenta a medida que avanzamos una columna en la tabla periódica, por lo que la flourina es la más electronegativa y la menos bromo).
En gran medida, entonces, podemos predecir tendencias en el cambio químico considerando la cantidad de deshielding que se está produciendo cerca de un protón.
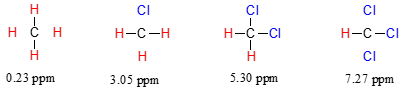
El desplazamiento químico del triclorometano (nombre común cloroformo) es, como se esperaba, mayor que el del diclorometano, que a su vez es mayor que el del clorometano.
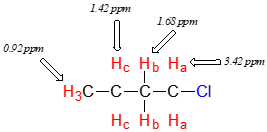
El efecto deshielding de un sustituyente electronegativo disminuye bruscamente con el aumento de la distancia:
La presencia de oxígeno electronegativo, nitrógeno, azufre o\(sp^2\) carbono hibridado también tiende a desplazar ligeramente hacia abajo las señales de RMN de protones cercanos:
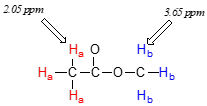
Ahora podemos finalmente asignar los dos picos en el espectro\(^1H\) -NMR del acetato de metilo. Podemos predecir que los protones del éster metílico (\(H_b\)), que son deshidados por el átomo de oxígeno adyacente, tendrán un desplazamiento químico mayor que los protones acetato (\(H_a\)), los cuales son deshidados en menor medida por el grupo carbonilo. Por lo tanto, la señal a 3.7 debe corresponder a\(H_b\), y la señal a 2.0 a\(H_a\).
Anisotropía diamagnética
Los protones vinílicos (aquellos directamente unidos a un carbono alqueno) y los protones aromáticos resuenan mucho más abajo de lo que puede explicarse simplemente por el efecto de deshielding de los átomos electronegativos cercanos. Obsérvese los desplazamientos químicos de los protones vinílicos y aromáticos en ciclohexeno y benceno:
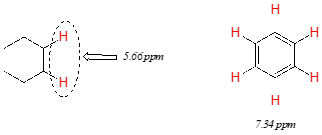
Primero consideraremos el protón aromático. Recordemos que en el benceno y en muchas otras estructuras aromáticas, un sexteto de electrones p se deslocaliza alrededor del anillo. Cuando se expone la molécula\(B_0\), estos\(p\) electrones comienzan a circular en una corriente anular, generando su propio campo magnético inducido que se opone\(B_0\). En este caso, sin embargo, el campo inducido de\(p\) los electrones no protege a los protones aromáticos de\(B_0\) como cabría esperar, sino que hace que los protones experimenten un campo magnético más fuerte en la dirección de\(B_0\), en otras palabras, se suma a\(B_0\) más que restar de ella.
Para entender cómo sucede esto, necesitamos entender el concepto de anisotropía diamagnética (anisotropía significa `no uniforme`). Hasta el momento, hemos estado imaginando los campos magnéticos como orientados en una dirección uniforme. Esto sólo es cierto sobre un área pequeña. Si damos un paso atrás y tomamos una visión más amplia, sin embargo, vemos que las líneas de fuerza en un campo magnético son en realidad anisotrópicas. Empiezan en la dirección 'norte', para luego dar vueltas como una serpiente que se muerde la cola.
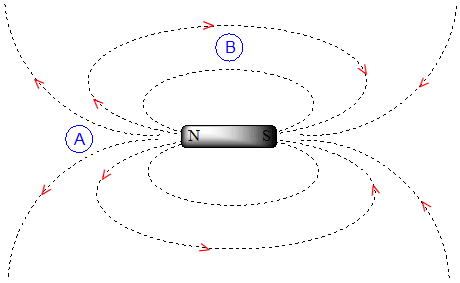
Si estamos en el punto A de la figura anterior, sentimos un campo magnético apuntando en dirección norte. Si estamos en el punto B, sin embargo, sentimos un campo apuntando hacia el sur.
En el campo inducido generado por la corriente del anillo aromático, los protones aromáticos se encuentran en el equivalente al 'punto B', lo que significa que la corriente inducida en esta región del espacio está orientada en la misma dirección que\(B_0\), por lo que se suma a\(B_0\) más que restarla.
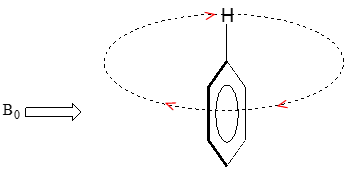
resultado final es que los protones aromáticos, debido a la anisotropía del campo inducido generado por la corriente del\(pi \) anillo, parecen estar altamente deshirados. Su desplazamiento químico está muy abajo, en la región de 6.5-8 ppm.
La anisotropía diamagnética también es responsable de los desplazamientos químicos del campo abajo de protones vinílicos (4.5-6.5 ppm) y protones aldehído (9-10 ppm). Estos grupos no son aromáticos y por lo tanto no generan corrientes de anillo si el benceno, pero los electrones p circulan de tal manera que generan un campo magnético que se suma\(B_0\) en las regiones del espacio ocupadas por los protones. Los protones de ácido carboxílico están muy abajo (10-12 ppm) debido a la influencia combinada del átomo de oxígeno electronegativo y el\(pi \) enlace cercano.
Protonesenlazados por hidrógeno
Los protones que están directamente unidos al oxígeno o al nitrógeno tienen desplazamientos químicos que pueden variar ampliamente dependiendo del disolvente y la concentración. Estos protones pueden participar en diversos grados en las interacciones de enlaces de hidrógeno, y el grado de enlace de hidrógeno influye en gran medida en la densidad de electrones alrededor del protón y, por lo tanto, en el desplazamiento químico. Las señales para los protones de enlace de hidrógeno también tienden a ser más amplias que las de los hidrógenos unidos al carbono, un fenómeno que también se debe a los enlaces de hidrógeno.
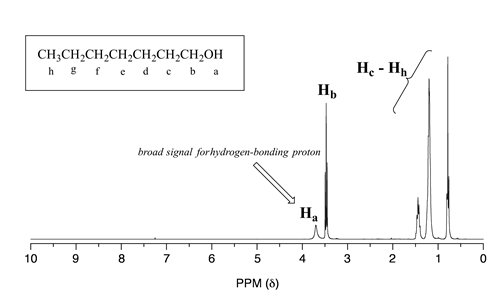
Los protones de alcohol, por ejemplo, suelen mostrar señales amplias en cualquier lugar entre 1-5 ppm. La señal para\(H_a\) en el espectro de 1-heptanol es un ejemplo típico de una señal de RMN ensanchada para un protón de alcohol.
La siguiente tabla proporciona un resumen de los rangos de desplazamiento químico aproximados para protones en diferentes arreglos de unión. Una tabla más detallada se puede encontrar en el apéndice.
| T tipo de protón | C rango de desplazamiento hemico (ppm) |
|---|---|
| unido al\(sp^3\) carbono | 0.5 - 4 |
| unido a\(N\) (amine) | 1 - 3 |
| unido a\(O\) (alcohol) | 1 - 5 |
| alqueno/vinílico | 3.5 - 6.5 |
| alquino terminal | 2 - 3 |
| unido a\(N\) (amide) | 5 - 9 |
| aromático | 6 - 9 |
| aldehído | 9.5 - 10 |
| ácido carboxílico | 10 - 13 |
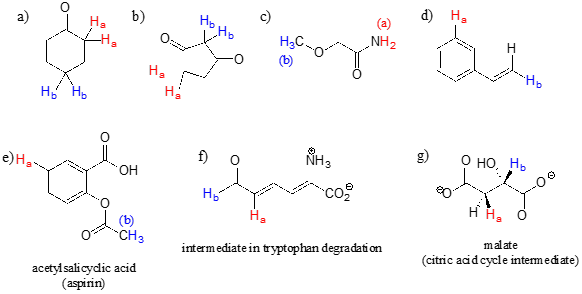
Por cada par de protones coloreados rojo (\(H_a\)) y azul (\(H_b\)) en las estructuras de abajo, estado que se espera que tenga el mayor desplazamiento químico en\(^1H\) -NMR. Para algunos de estos será útil consultar la Tabla 2 al dorso del libro.
El\(^1H\) espectro de RMN del compuesto aromático [18] anuleno tiene dos picos, a 8.9 ppm y -1.8 ppm (¡un desplazamiento químico negativo, campo arriba del TMS!) con una relación de integración de 2:1. Explicar el inusual desplazamiento químico de este último pico.
![Texto: [18] Anular.](https://chem.libretexts.org/@api/deki/files/141354/clipboard_e2b5218efd84cbb2f950a2668cf032535.png)


