5.6: Acoplamiento Spin-Spin
- Page ID
- 72407
Los espectros\(^1H\) de RMN que hemos visto hasta ahora (de acetato de metilo y 1,4-dimetilbenceno) son algo inusuales en el sentido de que en ambas moléculas, cada conjunto de protones genera una única señal de RMN. De hecho, los espectros\(^1H\) de RMN de la mayoría de las moléculas orgánicas contienen señales de protones que se 'dividen' en dos o más sub-picos. Sin embargo, en lugar de ser una complicación, este comportamiento de división es realmente muy útil porque nos proporciona más información sobre nuestra molécula de muestra.
Considera el espectro para 1,1,2-tricloroetano. En este y en muchos espectros a seguir, mostramos ampliaciones de señales individuales para que los patrones de división de señal sean reconocibles.
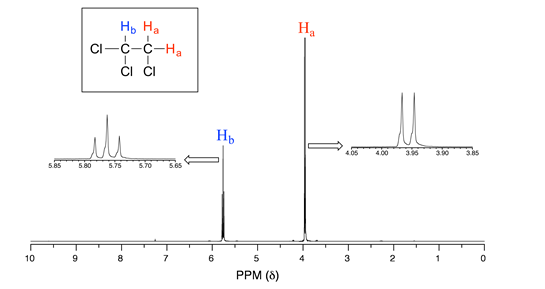
La señal a 3.96 ppm, correspondiente a los dos\(H_a\) protones, se divide en dos subpicos de igual altura (y área) —esto se conoce como doblete. La\(H_b\) señal a 5.76 ppm, por otro lado, se divide en tres subpicos, con el pico medio más alto que los dos picos externos -si tuviéramos que integrar cada subpico, veríamos que el área bajo el pico medio es el doble que la de cada uno de los picos externos. Esto se llama triplete.
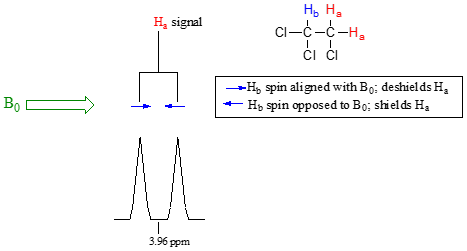
La fuente de división de la señal es un fenómeno llamado acoplamiento espín-espín, un término que describe las interacciones magnéticas entre núcleos vecinos no equivalentes activos en NMR. (Los términos 'división' y 'acoplamiento' a menudo se usan indistintamente cuando se habla de RMN). En nuestro ejemplo de 1,1,2 triclorometano, los\(H_b\) protones\(H_a\) y se acoplan por giro entre sí. Así es como funciona, mirando primero la\(H_a\) señal: además de estar blindado por electrones de valencia cercanos, cada uno de los\(H_a\) protones también está influenciado por el pequeño campo magnético generado por la puerta de\(H_b\) al lado (recuerde, cada protón giratorio es como un pequeño imán). El momento magnético de se\(H_b\) alineará con\(B_0\) en poco más de la mitad de las moléculas en la muestra, mientras que en las moléculas restantes se opondrá a\(B_0\). El Beff 'sentido' por\(H_a\) es un poco más débil si\(H_b\) está alineado en contra\(B_0\), o ligeramente más fuerte si\(H_b\) está alineado con\(B_0\). En otras palabras, en la mitad de las moléculas\(H_a\) está blindado por\(H_b\) (por lo tanto, la señal de RMN se desplaza ligeramente campo arriba) y en la otra mitad\(H_a\) se deshicede por\(H_b\) (y la señal de RMN se desplaza ligeramente campo abajo). Lo que de otro modo sería un solo\(H_a\) pico se ha dividido en dos subpicos (un doblete), un campo arriba y otro campo abajo de la señal original. Estas ideas se pueden ilustrar mediante un diagrama de división, como se muestra a continuación.
Ahora, pensemos en la\(H_b\) señal. El ambiente magnético que experimenta\(H_b\) está influenciado por los campos de ambos\(H_a\) protones vecinos, a los que llamaremos\(H_a1\) y\(H_a2\). Aquí hay cuatro posibilidades, cada una de las cuales es igualmente probable. Primero, los campos magnéticos de ambos\(H_a1\) y\(H_a2\) podrían alinearse con\(B_0\), lo que deshield\(H_b\), desplazando su señal de RMN ligeramente campo abajo. En segundo lugar, tanto el\(H_a1\) campo\(H_a2\) magnético como el campo podrían alinearse en oposición a\(B_0\), lo que blindaría\(H_b\), desplazando su señal de resonancia ligeramente hacia arriba. Tercero y cuarto,\(H_a1\) podrían ser con\(B_0\) y\(H_a2\) opuestos, u\(H_a1\) opuestos a\(B_0\) y\(H_a2\) con\(B_0\). En cada uno de los dos últimos casos, el efecto de blindaje de un\(H_a\) protón cancelaría el efecto deshielding del otro, y el desplazamiento químico de no\(H_b\) cambiaría.
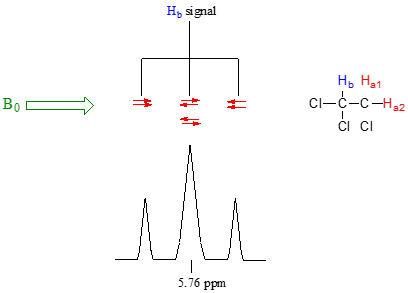
Entonces, al final, la señal para\(H_b\) es un triplete, con el pico medio dos veces más grande que los dos picos externos porque hay dos formas que\(H_a1\) y\(H_a2\) pueden cancelarse entre sí.
Considere el espectro para el acetato de etilo:
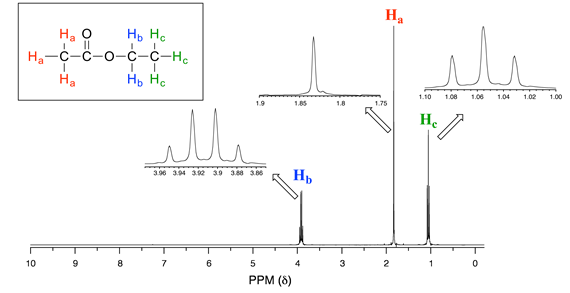
Vemos un pico “singlete” no dividido a 1.83 ppm que corresponde a los protones acetilo (\(H_a\)), esto es similar a la señal para los protones acetato en acetato de metilo que consideramos anteriormente. Esta señal no se divide porque no hay protones adyacentes en la molécula. La señal a 1.06 ppm para los\(H_c\) protones es dividida en un triplete por los dos\(H_b\) protones de al lado. La explicación aquí es la misma que la explicación del pico triplete que vimos anteriormente para 1,1,2-tricloroetano.
Los protones Hb dan lugar a una señal de cuarteto a 3.92 ppm —observe que los dos picos medios son más altos que los dos picos externos. Este patrón de división es el resultado del efecto de acoplamiento de espín de los tres protones Hc adyacentes, y puede explicarse por un análisis similar al que se utilizó para explicar los patrones de doblete y triplete.
- Explique, usando un diagrama de división, las posibles combinaciones de estados de espín nuclear para los\(H_c\) protones en acetato de etilo, y por qué la\(H_b\) señal se divide en un cuarteto.
- La relación de integración de los dos 'subpicos' en un doblete es 1:1, y en tripletes es 1:2:1. ¿Cuál es la relación de integración del\(H_b\) cuarteto en acetato de etilo? (Pista — usa la ilustración que dibujaste en la parte a para responder a esta pregunta.)
A estas alturas, probablemente ya hayas reconocido el patrón que generalmente se conoce como la regla n + 1: si un conjunto de protones tiene n protones vecinos, no equivalentes, se dividirá en n + 1 subpicos. Así, los dos\(H_b\) protones en acetato de etilo dividieron la\(H_c\) señal en un triplete, y los tres\(H_c\) protones dividieron la\(H_b\) señal en un cuarteto. \(H_a\), con cero protones vecinos, es un singlete. Esta es información muy útil si estamos tratando de determinar la estructura de una molécula desconocida: si vemos una señal de triplete, sabemos que el protón o conjunto de protones correspondiente tiene dos `vecinos`. Cuando comencemos a determinar estructuras de compuestos desconocidos usando datos espectrales de\(^1H\) RMN, se hará más evidente cómo se puede usar este tipo de información.
En este punto hay que enfatizar cuatro puntos importantes.
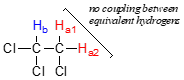
Primero, la división de la señal solo ocurre entre protones no equivalentes —es decir,\(H_a1\) en 1,1,2-tricloroetano no se divide por\(H_a2\), y viceversa.
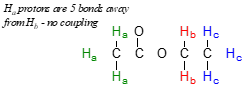
 Segundo, la división ocurre principalmente entre protones que están separados por tres o menos enlaces. Es por eso que los\(H_a\) protones en acetato de etilo forman un singlete, los vecinos de protones más cercanos están a cinco enlaces de distancia, demasiado lejos para que se produzca el acoplamiento.
Segundo, la división ocurre principalmente entre protones que están separados por tres o menos enlaces. Es por eso que los\(H_a\) protones en acetato de etilo forman un singlete, los vecinos de protones más cercanos están a cinco enlaces de distancia, demasiado lejos para que se produzca el acoplamiento.
Con instrumentos más sensibles a veces veremos la división de 4 enlaces e incluso de 5 enlaces, pero en nuestro tratamiento de RMN, en aras de la simplicidad siempre asumiremos que solo se ve la división de tres enlaces.
En tercer lugar, los protones que están unidos al oxígeno o al nitrógeno generalmente no se dividen -y no se dividen por- protones adyacentes. \(OH\)y\(NH\) los protones son lo suficientemente ácidos como para intercambiar rápidamente entre diferentes moléculas, por lo que los protones vecinos nunca en realidad 'sienten' su influencia.
El espectro de 1-heptanol tiene una señal de protones de alcohol característicamente amplia a 3.7 ppm (etiquetada con Ha a continuación).
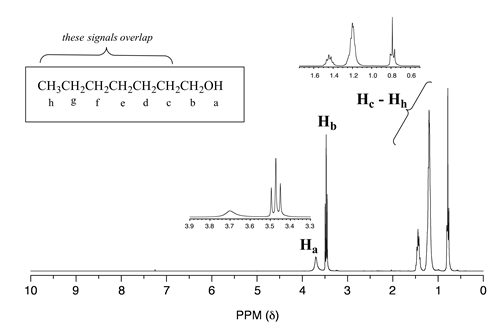
Observe en este espectro que\(H_b\) es un triplete, acoplado a los dos\(H_c\) protones pero no acoplado a\(H_a\). Las señales correspondientes a\(H_c\) través de Hh son complejas debido a la superposición, cuando esto sucede (¡como suele suceder!) , el análisis detallado se vuelve más desafiante.
A continuación se presentan algunos ejemplos más de información sobre el desplazamiento químico y el patrón de división para algunas moléculas orgánicas relativamente simples.
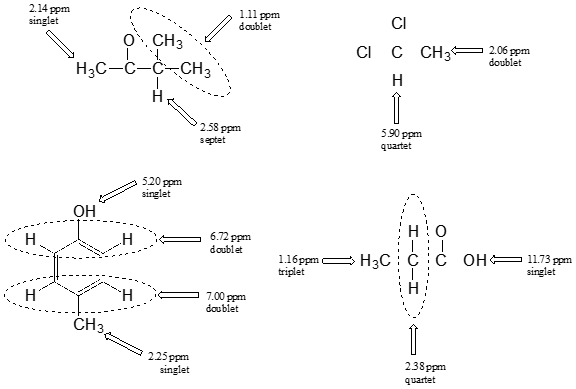
¿Cuántas señales de protones esperaría ver en el\(^1H\) espectro de RMN del triclosán (un agente antimicrobiano común en el jabón)? Para cada una de las señales de protones, predice el patrón de división, asumiendo que solo puedes ver división de 3 enlaces.
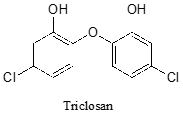
¿Cuántas señales de protones esperarías ver en el\(^1H\)-NMR spectrum of the neurotransmitter serotonin? For each of the proton signals, predict the splitting pattern, again assuming only 3-bond splitting.
En un mundo ideal, todos los espectros de RMN serían tan fáciles de interpretar como los que hemos visto hasta ahora: cada pico estaría separado de los demás, la integración de picos sería obvia, y la multiplicidad (singlete, doblete, etc.) sería fácil de reconocer. El mundo real, desafortunadamente, no siempre es tan bonito: picos con cambios químicos similares se superponen, haciendo que la interpretación sea mucho más difícil. Ya hemos visto este es el espectro del 1-heptanol anterior. En el espectro del metilbenceno, esperaríamos que la señal\(H_a\) sea un singlete,\(H_b\) un doblete\(H_c\) y\(H_d\) que sea tripletes. Al observar los valores relativos de integración para los cuatro picos, esperaríamos ver una relación 3:2:2:1.
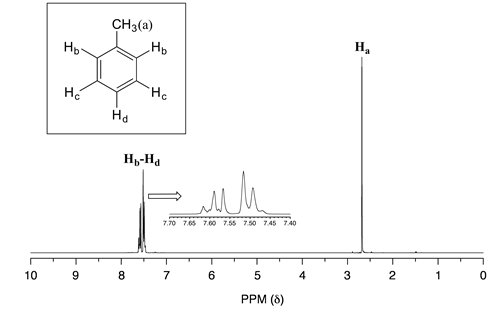
En la práctica, sin embargo, los tres conjuntos de protones aromáticos\(H_b\),\(H_c\) y\(H_d\) tienen desplazamientos químicos muy similares por lo que sus señales se superponen sustancialmente, y no podemos reconocer patrones de división de dobletes o tripletes. En este caso, nos referiríamos a la parte aromática del espectro como un multiplete. Podemos reportar la relación de integración del\(H_a\) pico en comparación con los picos aromáticos combinados como de 3 a 5, o el equivalente de 1 a 1.67.
La magnitud del acoplamiento espín-espín se puede expresar usando la constante de acoplamiento, abreviada con la letra mayúscula J. La constante de acoplamiento es simplemente la diferencia, expresada en Hz, entre dos sub-picos adyacentes en una señal dividida, y es una medida de la medida en que un núcleo 'siente' el magnético dipolo de su vecino.
Para nuestro doblete en el espectro 1,1,2-tricloroetano, por ejemplo, los dos subpicos están separados por 6.1 Hz, y así escribimos\(^3J_{a-b} = 6.1 Hz\).
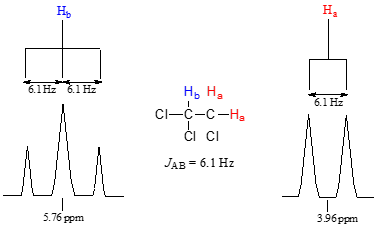
 El superíndice '3' nos dice que se trata de una interacción de acoplamiento de tres enlaces, y el subíndice 'a-b' nos dice que estamos hablando de acoplamiento entre\(H_a\) y\(H_b\). A diferencia del valor de desplazamiento químico, la constante de acoplamiento, expresada en Hz, es la misma independientemente de la intensidad de campo aplicada del imán de RMN. La intensidad del momento magnético de un protón vecino, que es la fuente del fenómeno de acoplamiento espín-espín, no depende de la intensidad de campo aplicada. Por esta razón, las constantes de acoplamiento normalmente se dan en Hz, no en ppm.
El superíndice '3' nos dice que se trata de una interacción de acoplamiento de tres enlaces, y el subíndice 'a-b' nos dice que estamos hablando de acoplamiento entre\(H_a\) y\(H_b\). A diferencia del valor de desplazamiento químico, la constante de acoplamiento, expresada en Hz, es la misma independientemente de la intensidad de campo aplicada del imán de RMN. La intensidad del momento magnético de un protón vecino, que es la fuente del fenómeno de acoplamiento espín-espín, no depende de la intensidad de campo aplicada. Por esta razón, las constantes de acoplamiento normalmente se dan en Hz, no en ppm.
Cuando observamos de cerca la señal del triplete en 1,1,2-tricloroetano, vemos que la constante de acoplamiento -la 'brecha' entre los subpicos- es de 6.1 Hz, lo mismo que para el doblete. La constante de acoplamiento\(^3J_{a-b}\) cuantifica la interacción magnética entre los conjuntos de hidrógeno de Ha y Hb, y esta interacción es de la misma magnitud en cualquier dirección. En otras palabras, el acoplamiento spin-spin es recíproco:\(H_a\) influye\(H_b\) en la misma medida que\(H_b\) influye\(H_a\).
Las constantes de acoplamiento entre conjuntos de protones en carbonos\(sp^3\) hibridados vecinos están típicamente en la región de 6-8 Hz. Las constantes de acoplamiento para protones vinílicos vecinos pueden variar de 0 Hz (sin acoplamiento en absoluto) a 18 Hz, dependiendo de la disposición de unión.
Constantes típicas de acoplamiento protón-protón
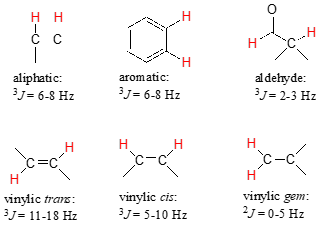
Para protones vinílicos en una configuración trans, vemos constantes de acoplamiento en el rango de\(^3J = 11-18 Hz\), mientras que los protones cis se acoplan en el\(^3J = 5-10 Hz\) rango. El acoplamiento de 2 enlaces entre protones en el mismo carbono alqueno (denominados protones geminales) es muy fino, generalmente de 5 Hz o inferior.
A menudo se observa un acoplamiento fino (2-3 Hz) entre un protón aldehído y un vecino de tres enlaces.
Dar los patrones de división esperados y las constantes de acoplamiento aproximadas para los protones etiquetados en el compuesto a continuación.
Presentación de datos de RMN en formato de tabla
La información de RMN se puede registrar convenientemente en forma condensada sin tener que reproducir el espectro real. Por ejemplo, la información de la especta\(^1H\) -NM de acetato de etilo y metilbenceno (ver figuras anteriores) se puede presentar en formato tabular, enumerando el desplazamiento químico, el patrón de división de picos y el área relativa bajo los picos (generalmente, el pico más pequeño se establece en 1). La información de la constante de acoplamiento no se muestra en las tablas de ejemplo a continuación.
| ppm | dividiendo | integración |
|---|---|---|
| 3.92 | q | 1 |
| 1.83 | s | 1.5 |
| 1.06 | t | 1.5 |
| ppm | dividiendo | integración |
|---|---|---|
| 7.45 - 7.63 | m | 1.67 |
| 2.64 | s | 1 |
(abreviaturas: s = singlete, d = doblete, t = triplete, q = cuarteto, m = multiplete)
Haga coincidir el\(^1H\) espectro de RMN a continuación con su compuesto correspondiente y asigne todas las señales.
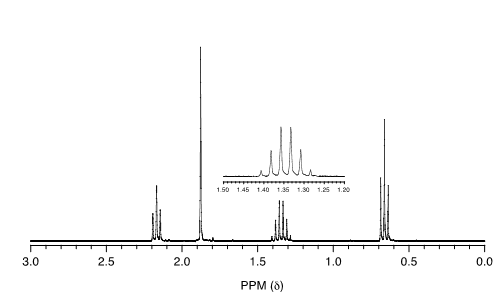
a) ciclopentanona b) 3-pentanona c) butaldehído
d) 2-pentanona e) 4-heptanona f) 1-buteno
- ¿Cuál de los compuestos del ejercicio anterior se espera que tenga un espectro\(^1H\) -NMR compuesto por dos tripletes y un sexteto?
- ¿Cuál tendría un espectro compuesto por dos trillizos?
- ¿Cuál tendría un espectro que incluye una señal superior a 8 ppm?
Explica cómo podrías distinguir entre los espectros de\(^1H\) RMN de los tres isómeros a continuación.