5.7: Espectroscopia de RMN 13C
- Page ID
- 72461
El isótopo 12 C del carbono -que representa hasta aproximadamente el 99% de los carbonos en las moléculas orgánicas- no tiene un momento magnético nuclear y, por lo tanto, es inactivo a NMR. Afortunadamente para los químicos orgánicos, sin embargo, el isótopo 13 C, que representa la mayor parte del 1% restante de los átomos de carbono en la naturaleza, tiene un momento dipolar magnético al igual que los protones. La mayor parte de lo que hemos aprendido sobre la espectroscopía de 1H-RMN también se aplica a 13 C-RMN, aunque existen varias diferencias importantes.
El momento magnético de un núcleo de 13 C es mucho más débil que el de un protón, lo que significa que las señales de RMN de 13 núcleos C son inherentemente mucho más débiles que las señales de protones. Esto, combinado con la baja abundancia natural de 13 C, significa que es mucho más difícil observar las señales de carbono: se requiere más muestra y, a menudo, los datos de cientos de escaneos deben promediarse para reducir la relación señal/ruido a niveles aceptables. A diferencia de las señales de 1H-RMN, el área bajo una señal de 13 C-RMN no se puede utilizar fácilmente para determinar el número de carbonos a los que corresponde. Las señales para algunos tipos de carbonos son inherentemente más débiles que para otros tipos; los picos correspondientes a los carbonos de carbonilo, por ejemplo, son mucho más pequeños que los de los picos de metilo o metileno (CH 2). Por esta razón, la integración de picos generalmente no es útil en la espectroscopía de 13 C-RMN.
Las frecuencias de resonancia de 13 núcleos C son menores que las de los protones en el mismo campo aplicado; en un instrumento con un imán de 7.05 Tesla, los protones resuenan a aproximadamente 300 MHz, mientras que los carbonos resuenan a aproximadamente 75 MHz. Esto es afortunado, ya que nos permite mirar 13 señales C usando una 'ventana' completamente separada de frecuencias de radio. Al igual que en 1H-RMN, el estándar utilizado en 13 experimentos de RMN C para definir el punto de 0 ppm es tetrametilsilano (TMS),
aunque por supuesto en 13 C-NMR es la señal de los cuatro carbonos equivalentes en TMS la que sirve como estándar. Los desplazamientos químicos para núcleos de 13 C en moléculas orgánicas se extienden en un rango mucho más amplio que para los protones, hasta 200 ppm para 13 C en comparación con 10-12 ppm para protones (ver Tabla 3 para una lista de 13 desplazamientos químicos de RMN C típicos).
El desplazamiento químico de un núcleo de 13 C está influenciado esencialmente por los mismos factores que influyen en el desplazamiento químico de un protón: los enlaces a átomos electronegativos y los efectos de anisotropía diamagnética tienden a desplazar las señales campo abajo (mayor frecuencia de resonancia). Además, la hibridación sp 2 da como resultado un gran cambio de campo abajo. Las 13 señales de C-RMN para los carbonos carbonílicos son generalmente las más alejadas (170-220 ppm), debido tanto a la hibridación sp 2 como al doble enlace con el oxígeno.
Ejercicio 5.15
¿Cuántos conjuntos de carbonos no equivalentes hay en cada una de las moléculas mostradas en el ejercicio 5.2?
Ejercicio 5.16
¿Cuántos conjuntos de carbonos no equivalentes hay en:
a) metilbenceno
b) 2-pentanona
c) 1,4-dimetilbenceno
d) triclosán
(todas las estructuras se muestran anteriormente en este capítulo)
Debido a la baja abundancia natural de 13 núcleos C, es muy poco probable encontrar dos 13 átomos de C cerca uno del otro en la misma molécula, y por lo tanto no vemos acoplamiento espín-espín entre carbonos vecinos en un espectro de 13 C-RMN. Sin embargo, 13 núcleos C se acoplan a protones cercanos, lo que resulta en espectros complicados. Para mayor claridad, los químicos generalmente utilizan una técnica llamada desacoplamiento de banda ancha, que esencialmente 'desactiva 'el acoplamiento C-H, dando como resultado un espectro en el que todas las señales de carbono son singletes. A continuación se muestra el sectro de 13 C-RMN de protón desacoplado de acetato de etilo, mostrando las cuatro señales esperadas, una para cada uno de los carbonos. También podemos ver una señal para el átomo de carbono en el disolvente deuterado de cloroformo (CdCl 3) (aunque una discusión detallada está más allá de nuestro alcance aquí, es interesante señalar que esta señal se divide en un triplete por deuterio, que es RMN activa y tiene tres posibles estados de espín en lugar de dos). Podemos ignorar la señal del solvente al interpretar 13 espectros de C-RMN.
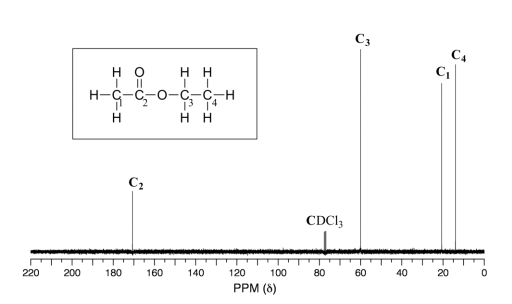
higo 30
Si bien el desacoplamiento de banda ancha resulta en un espectro mucho más simple, se pierde información útil sobre la presencia de protones vecinos. Sin embargo, otra técnica de RMN llamada DEPT (Distortionless Enhancement by Polarization Transfer) nos permite determinar cuántos hidrógenos están unidos a cada carbono. Esta información generalmente se proporciona en problemas en los que se le pide interpretar el espectro de 13 C-RMN de un compuesto desconocido. (Los detalles de cómo funciona la técnica DEPT están más allá del alcance de este libro, pero se cubrirán si tomas un curso más avanzado en espectroscopia).
Una de las mayores ventajas de 13 C-NMR en comparación con 1H-NMR es la amplitud del espectro; recuerde que los carbonos resuenan de 0-220 ppm en relación con el estándar TMS, a diferencia de solo 0-12 ppm para protones. Debido a esto, las señales de 13 C rara vez se superponen, y
casi siempre podemos distinguir picos separados para cada carbono, incluso en un compuesto relativamente grande que contiene carbonos en ambientes muy similares. En el espectro protónico del 1-heptanol vimos anteriormente solo se analizan fácilmente el singlete ancho del protón alcohol (H a) y el triplete para (H b). Las otras señales de protones se superponen, dificultando el análisis. En el espectro de 13 C de una misma molécula, sin embargo, podemos distinguir fácilmente cada señal de carbono, y sabemos por estos datos que nuestra muestra tiene siete carbonos no equivalentes. (Observe también que, como es de esperar, los desplazamientos químicos de los carbonos disminuyen progresivamente a medida que se alejan más del oxígeno deshielding).
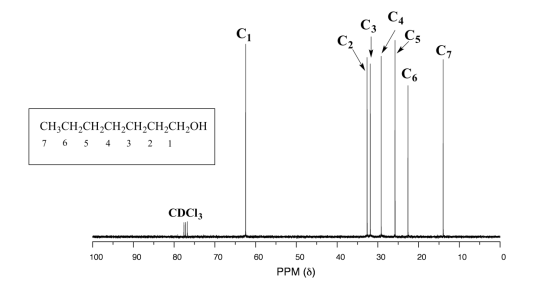
higo 32
Esta propiedad de 13 C-NMR la hace muy útil en la elucidación de estructuras más grandes y complejas.
Ejercicio 5.17
A continuación se muestran 13 espectros de RMN C para metilbenceno (nombre común tolueno) y metacrilato de metilo. Haga coincidir los espectros con la estructura correcta y realice asignaciones de picos.
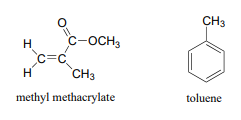
Espectro A:

higo 33
Spetrum B:
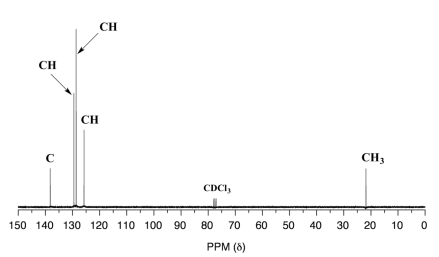
higo 34
Ejercicio 5.18
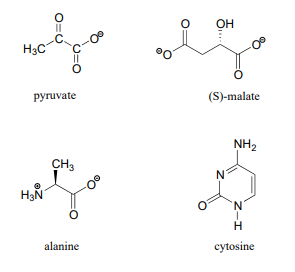
13 Los datos de RMN C para algunas biomoléculas comunes se muestran a continuación (los datos son de la Biblioteca Aldrich de 1H y 13C NMR). Hacer coincidir los datos de RMN con la estructura correcta y realizar asignaciones completas de picos.
espectro a: 168.10 ppm (C), 159.91 ppm (C), 144.05 ppm (CH), 95.79 ppm (CH)
espectro b: 207.85 ppm (C), 172.69 ppm (C), 29.29 ppm (CH 3)
espectro c: 178.54 ppm (C), 53.25 ppm (CH), 18.95 ppm (CH 3)
espectro d: 183.81 ppm (C), 182. 63 ppm (C), 73.06 ppm (CH), 45.35 ppm (CH 2)
higo 36a
13 C-NMR en Estudios de Etiquetado Isotópico
Aunque solo aproximadamente 1 de cada 100 átomos de carbono en una molécula orgánica natural es un isótopo 13C, los químicos a menudo son capaces de sintetizar moléculas que están enriquecidas artificialmente en 13C en posiciones específicas de carbono. Esto puede ser muy útil en estudios bioquímicos, ya que nos permite 'marcar' uno o más carbonos en una molécula precursora pequeña y luego rastrear la presencia del marcador 13C a través de una ruta biosintética hasta el producto final, proporcionando una idea de cómo ocurre la biosíntesis. Por ejemplo, los científicos pudieron cultivar bacterias en un medio en el que la única fuente de carbono era el acetato enriquecido en 13C en la posición C1 (carbonilo). Cuando aislaron un compuesto isoprenoide llamado amino-bacterio-hopanetriol sintetizado por la bacteria y observaron su espectro de RMN 13C, observaron que el marcador 13C del acetato se había incorporado en ocho posiciones específicas. Ellos sabían esto porque las señales de 13C-RMN para estos carbonos eran mucho más fuertes en comparación con las mismas señales en un compuesto de control (no marcado).
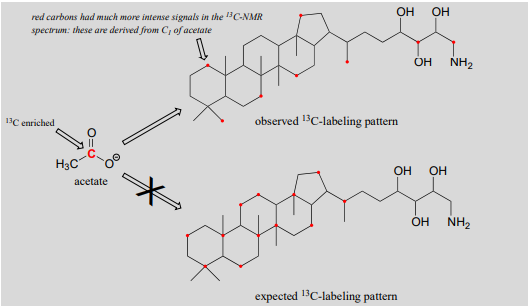
Este resultado fue muy sorprendente: los científicos esperaban un patrón completamente diferente de incorporación de 13C basado en lo que creían que era la vía de biosíntesis de isoprenoides involucrada. Este resultado inesperado condujo finalmente al descubrimiento de que las bacterias sintetizan compuestos isoprenoides por una vía completamente diferente a la de levaduras, plantas y animales. La vía metabólica bacteriana recién descubierta es actualmente un objetivo clave para el desarrollo de nuevos antibióticos y antimalaria. (Eur. J. Biochem. 1988, 175, 405).


