5.8: Resolviendo estructuras desconocidas
- Page ID
- 72430
Ahora finalmente es el momento de juntar todo lo que hemos estudiado sobre las técnicas de determinación de estructuras y aprender a resolver realmente la estructura de una molécula orgánica 'desde cero', comenzando, en otras palabras, con nada más que los datos experimentales brutos. Para este ejercicio, imaginaremos que se nos ha dado un vial que contiene una muestra pura de un compuesto orgánico desconocido, y que este compuesto a nuestro conocimiento nunca antes había sido sintetizado, aislado o caracterizado, somos los primeros en tenerlo en nuestras manos. ¿Podemos averiguar su estructura? Si bien, por supuesto, el método exacto para determinar una estructura desconocida dependerá del compuesto en cuestión y, en el mundo real de la investigación, probablemente implicará algunas técnicas que están más allá del alcance de este libro, aquí hay una visión general de un enfoque que podría tomarse para analizar una muestra pura de un compuesto orgánico relativamente simple, utilizando las técnicas que hemos aprendido.
Paso 1: Utilizar MS y análisis de combustión para determinar la fórmula molecular
Antes de comenzar a analizar datos espectroscópicos, necesitamos una información muy importante sobre nuestro compuesto: su fórmula molecular. Esto se puede determinar mediante el uso combinado de espectrometría de masas y análisis de combustión. No entraremos en los detalles del análisis de combustión -por ahora, basta con saber que esta técnica nos dice el porcentaje de masa de cada elemento en el compuesto. Debido a que el oxígeno molecular está involucrado en la reacción de combustión, el oxígeno en la muestra no se mide directamente, pero suponemos que si los porcentajes de masa no suman el 100%, el resto se contabiliza por el oxígeno.
Cuando obtengamos nuestro compuesto desconocido, una de las primeras cosas que haremos es enviar una pequeña cantidad a una compañía analítica especializada en análisis de combustión. Nos devuelven un informe en el que se afirma que nuestro compuesto está compuesto, en masa, de 52.0% de carbono, 38.3% de cloro y 9.7% de hidrógeno. Esto suma hasta el 100%, por lo que nuestro compuesto no contiene ningún átomo de oxígeno.
Para determinar la fórmula molecular de nuestro compuesto a partir de estos datos, primero necesitamos conocer su masa molar. Esta información, como recuerda del capítulo 4, determinamos observando el 'pico de iones moleculares' en el espectro de masas de nuestro compuesto. En este ejemplo, encontramos que nuestros datos de MS muestran un pico de iones moleculares a m/z = 92, dándonos una masa molar de 92 g/mol (recuerda que en el experimento de MS, la carga (z) es casi siempre igual a 1, porque estamos viendo +1 cationes).
Entonces, un mol de nuestro compuesto es 92g. ¿Cuántos moles de átomos de carbono hay en un mol del compuesto? Simple: 52% de 92g es 47.8g. Entonces en un mol de nuestro compuesto, hay alrededor de 48 g de carbono, lo que significa cuatro moles de carbono. Con cálculos similares, encontramos que un mol de nuestro compuesto contiene nueve hidrógenos y un cloro. Por lo tanto nuestra fórmula molecular es\(C_4H_9Cl\).
Paso 2: Calcular el índice de deficiencia de hidrógeno
El siguiente paso es calcular un número llamado Índice de Deficiencia de Hidrógeno (IHD) a partir de la fórmula molecular. El IHD nos dirá cuántos enlaces múltiples y/o estructuras de anillo tiene nuestra molécula, información muy útil. La idea detrás del IHD es muy simple: la presencia de un doble enlace o una estructura de anillo significa que dos átomos de hidrógeno menos pueden ser parte del compuesto. La fórmula para calcular IHD a partir de una fórmula molecular es:
Cálculo del índice de deficiencia de hidrógeno:
\[IHD = \frac{(2n+2) - A}{2}\]
donde:
n = número de átomos de carbono
A = (número de átomos de hidrógeno) + (número de átomos de halógeno) - (número de átomos de nitrógeno) - (carga neta)
Por ejemplo, una molécula con la fórmula molecular\(C_6H_{14}\) tendría n = 6 y A = 14, por lo que podemos calcular ese IHD = 0 y con ello saber que un compuesto con esta fórmula no tiene dobles enlaces ni estructuras de anillo. El hexano y el 2-metil pentano son dos ejemplos de compuestos que aplican.
Una fórmula molecular de\(C_6H_{12}\), por otro lado, corresponde a IHD = 1, por lo que un compuesto con esta fórmula debe tener un doble enlace o una estructura de anillo. El ciclohexano (estructura de un anillo) y el 2-hexeno (un doble enlace) son dos posibilidades. El benceno (\(C_6H_6\)) y el metilbenceno (\(C_7H_8\)) tienen IHD = 4, correspondiendo en ambos casos a tres enlaces p y un anillo. Un valor de IHD de 4 o mayor suele ser un indicador de que está presente un anillo aromático.
- ¿Cuál es el IHD que corresponde a una fórmula molecular\(C_6H_{12}O\)? Dibujar las estructuras de tres posibles compuestos que encajen.
- El aminoácido alanina tiene fórmula molecular\(C_2H_8NO_2^+\) en tampón acuoso de\(pH = 2\). Calcular el IHD. Después, dibuje la estructura relevante para confirmar que este IHD tiene sentido.
- ¿Cuál es el IHD de los compuestos a continuación? (Pista: ¡no necesitas averiguar fórmulas moleculares!)
La fórmula para nuestra muestra de determinación de estructura\(C_4H_9Cl\),, corresponde a IHD = 0, lo que significa que nuestro compuesto no contiene múltiples enlaces o anillos.
Paso 3: Utilice los datos de espectroscopia disponibles para identificar partes discretas de la estructura.
En este problema, tenemos\(NMR\) datos de protones y carbono con los que trabajar (otros problemas pueden incluir datos de IR y/o UV/Vis).
| ppm | dividiendo | integración |
|---|---|---|
| 3.38 | d | 2 |
| 1.95 | m | 1 |
| 1.01 | d | 6 |
\(^{13}C-NMR\):
52.49 (\(CH_2\))
31.06 (\(CH\))
20.08 (\(CH_3\))
El proceso de armar una estructura orgánica es muy parecido a armar un rompecabezas. En todos los casos comenzamos de la misma manera, determinando la fórmula molecular y el valor de IHD. Después de eso,
no hay una fórmula establecida para el éxito- lo que tenemos que hacer es averiguar todo lo que podamos sobre piezas individuales de la molécula a partir de los datos\(NMR\) (y a menudo IR, MS o UV-Vis), y anotarlos. Eventualmente, ojalá, podamos juntar estas piezas de una manera que concuerde con todos nuestros datos empíricos. Vamos a darle una oportunidad.
Vemos que solo hay tres señales en cada\(NMR\) espectro, pero cuatro carbonos en la molécula, lo que nos dice que dos de los carbonos son químicamente equivalentes. El hecho de que la señal a 1.01 ppm en el espectro de protones corresponda a seis protones sugiere fuertemente que la molécula tiene dos grupos metil (\(CH_3\)) equivalentes. Debido a que esta señal es un doblete, debe haber un\(CH\) carbono unido a cada uno de estos dos grupos metilo. Tomados en conjunto, esto sugiere:
El\(^1H-NMR\) signal at 3.38 ppm must be for protons bound to the carbon which is in turn bound to the chlorine (we infer this because this signal is the furthest downfield in the spectrum, due to the deshielding effect of the electronegative chlorine). This signal is for two protons and is a doublet, meaning that there is a single nonequivalent proton on an adjacent carbon.
Step 4: Try to put the pieces of the puzzle together, and see if everything fits the available data.
At this point, we have accounted for all of the atoms in the structure, and we have enough information to put together a structure that corresponds to 1-chloro-2-methylpropane.
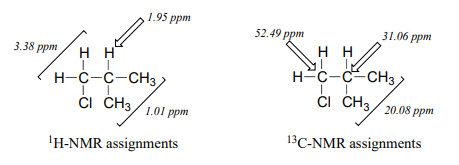
Para confirmar, hacemos asignación de todas las\(NMR\) señales a sus átomos correspondientes y nos aseguramos de que nuestra estructura se ajuste a todos los\(NMR\) datos. Observe que el pico de protones a 1.95 ppm podría esperarse que sea un '9-tet' debido a sus ocho vecinos de 3 enlaces: sin embargo, dos de los vecinos son diferentes de los otros seis, y pueden no acoplarse exactamente en la misma medida. La señal a 1.95 no será, entonces, un 9-tet 'limpio', y lo llamaríamos multiplete.
Tres isómeros constitucionales de 1-cloro-2-metilpropano producen los siguientes datos de RMN. Asigne estructuras a los tres compuestos y realice todas las asignaciones de picos.
- Compuesto A: (2-cloro-2-metilpropano)
\(^1H-NMR\):
1.62 ppm,\(9H\), s
\(^{13}C-NMR\):
67.14 ppm (\(C\))
34.47 ppm (\(CH_3\))
- Compuesto B: (1-clorobutano)
\(^1H-NMR\):
3.42 ppm,\(2H\), t
1.68 ppm,\(2H\), p
1.41 ppm,\(2H\), sexteto
0.92 ppm,\(3H\), t
\(^{13}C-NMR\):
44.74 ppm (\(CH_2\))
34.84 ppm (\(CH_2\))
20.18 ppm (\(CH_2\))
13.34 ppm (\(CH_3\))
- Compuesto C: (2-clorobutano)
\(^1H-NMR\):
3.97 ppm,\(1H\), sexteto
1.71 ppm,\(2H\), p
1.50 ppm,\(3H\), d
1.02 ppm,\(3H\), t
\(^{13}C-NMR\):
60.34 ppm (\(CH\))
33.45 ppm (\(CH_2\))
24.94 ppm (\(CH_3\))
11.08 ppm (\(CH_3\))
Probemos otro problema, esta vez incorporando información IR.
Se obtuvieron los siguientes datos para una muestra pura de un compuesto orgánico desconocido:
Análisis de combustión:
\(C\): 85.7%
\(H\): 6.67%
MS: Ión molecular a m/z = 210
\(^1H-NMR\):
7.5-7.0, 10H, m
5.10, 1H, s
2.22, 3H, s
\(^{13}C-NMR\):
206.2 (\(C\)) 128.7 (\(CH\)) 30.0 (\(CH_3\))
138.4 (\(C\)) 127.2 (\(CH\))
129.0 (\(CH\)) 65.0 (\(CH\))
IR: 1720 cm-1, fuerte (por supuesto hay muchos otros picos en el espectro IR, pero este es el más característico)
El peso molecular es 210, y podemos determinar a partir del análisis de combustión que la fórmula molecular es\(C_{15}H_{14}O\) (se supone que el porcentaje de masa de oxígeno en el compuesto es 100 - 85.7 - 6.67 = 7.6%). Esto nos da IHD = 9.
Debido a que tenemos diez protones con señales en la región aromática (7.5-7.0 ppm), probablemente estamos tratando con dos grupos fenilo, cada uno con un carbono sustituido. El\(^{13}C-NMR\) espectro muestra solo cuatro señales en el rango para los carbonos aromáticos, lo que nos dice que los dos grupos fenilo deben estar en entornos electrónicos equivalentes (si están en ambientes diferentes, darían lugar a ocho señales).
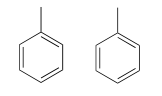
Esto representa 12 carbonos, 10 hidrógenos y 8 unidades IHD. Observe que el espectro de carbono tiene solo seis picos, ¡y solo cuatro picos en la región aromática! Esto indica de nuevo que los dos grupos fenilo están en posiciones químicamente equivalentes.
El espectro IR tiene una banda característica de absorción de carbonilo, por lo que representa el átomo de oxígeno en la fórmula molecular, la unidad IHD restante y la\(^{13}C-NMR\) señal a 206.2 ppm.
Ahora sólo nos quedan dos carbonos y cuatro hidrógenos por dar cuenta. El espectro de protones nos dice que tenemos un grupo metilo (el singlete de 2.22 ppm) que no está dividido por protones vecinos. Mirando la tabla de cambios químicos típicos, vemos que este valor de desplazamiento químico está en el rango de un carbono junto a un carbonilo.
Finalmente, hay un último protón a 5.10 ppm, también un singlete. Al armar el rompecabezas, la única posibilidad que cabe es 1,1-difenil-2-propanona:
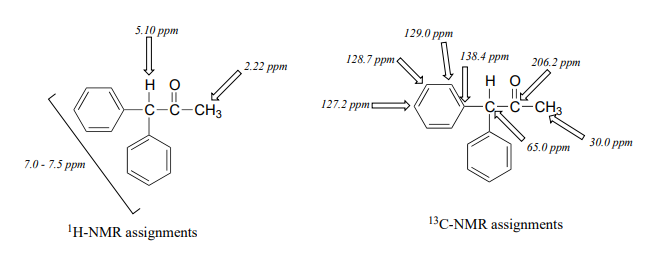
higo 43
- Contestar
-
Agrega el texto de respuesta aquí y automáticamente se ocultará si tienes una plantilla de “AutoNum” activa en la página.


