6.2: Una primera mirada a algún mecanismo de reacción orgánica
- Page ID
- 72629
Una reacción ácido-base (transferencia de protones)
Comenzaremos con un tipo de reacción relativamente simple con el que sin duda estás familiarizado de clases de química anteriores: una reacción ácido-base. Tenga en cuenta que en el capítulo 7, volveremos a considerar la reactividad ácido-base con mucho mayor detalle. Aquí está la reacción ácido-base entre el ion hidróxido y el ácido clorhídrico:
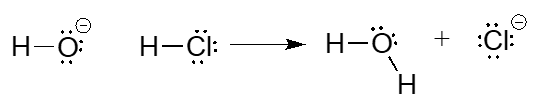
Una reacción como la anterior incluiría, por supuesto, un catión espectador, como el sodio (\(\ce{Na^{+}}\)) o el potasio (\(\ce{K^{+}}\)). En la mayoría de las figuras de reacción que veremos a lo largo de este libro, el ion espectador no se muestra en interés de la simplicidad.
Un protón se transfiere desde\(\ce{HCl}\), el ácido, al ion hidróxido, la base. El producto es agua (el ácido conjugado del ion hidróxido) e ion cloruro (la base conjugada de\(\ce{HCl}\)).
A pesar de su simplicidad (y a pesar de que los reactivos y productos son inorgánicos más que orgánicos), esta reacción nos permite considerar por primera vez muchas de las ideas fundamentales de la química orgánica que vamos a explorar en diversos contextos a lo largo de este texto.
Una clave muy importante para comprender casi cualquier mecanismo de reacción es el concepto de densidad electrónica, y cómo se conecta al movimiento de electrones (ruptura de enlaces y formación de enlaces) que ocurre en una reacción. El ion hidróxido —específicamente, el átomo de oxígeno que lleva la carga formal negativa— tiene una alta densidad de electrones: es rico en electrones.
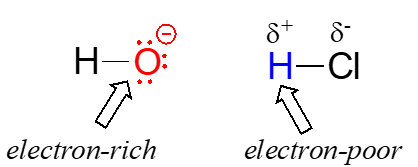
El átomo de hidrógeno en\(\ce{HCl}\), por otro lado, tiene baja densidad de electrones: es pobre en electrones, porque el cloro es más electronegativo que el hidrógeno. Como cabría esperar, un átomo que es rico en electrones es probable que se sienta atraído por un átomo que es pobre en electrones. A medida que el hidróxido y\(\ce{HCl}\) se acercan entre sí, se forma un nuevo enlace entre el oxígeno y el hidrógeno, y el enlace hidrógeno-cloro se rompe. El resultado final es una molécula de agua y un anión cloruro.
En términos de química orgánica, un mecanismo de reacción es una descripción formalizada de cómo tiene lugar una reacción, cómo obtenemos, en otras palabras, de reactivos a productos. Anteriormente (sección 2.3), vimos cómo se usaban flechas curvas para representar el movimiento 'imaginario' de dos electrones al ilustrar la conversión entre dos contribuyentes de resonancia de una misma molécula o ion (recuerde de esa discusión que la conversión entre dos contribuyentes de resonancia es no una reacción - es simplemente una ilustración de dos formas diferentes de dibujar la misma molécula). La misma convención de flecha curva se utiliza en los dibujos de mecanismos para mostrar el movimiento de electrones que tiene lugar en reacciones químicas, donde los enlaces se rompen y forman realmente. El mecanismo para la reacción\(\ce{HCl + OH}\) -, por ejemplo, se puede representar dibujando dos flechas curvas.
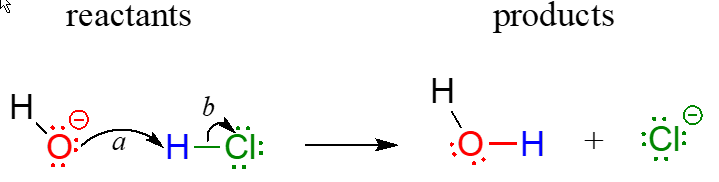
La flecha (a) en el dibujo mecanicista se origina en uno de los pares solitarios en el oxígeno hidróxido y apunta al símbolo 'H' en ácido clorhídrico, ilustrando el 'ataque' del par solitario de oxígeno y la posterior formación de un nuevo enlace hidrógeno-oxígeno. La flecha (b) se origina en la mitad del enlace hidrógeno-cloro y apunta al símbolo '\(\ce{Cl}\)', lo que indica que este enlace se está rompiendo: los dos electrones que forman el enlace están 'saliendo' y convirtiéndose en un par solitario sobre el ion cloruro. Siempre tenga en cuenta que estas flechas curvas por definición representan el movimiento de dos electrones. (Cuando estudiemos las reacciones radicales en el capítulo 17, veremos cómo representar el movimiento de un solo electrón).
Cuando se dibujan dos (o más) flechas curvas en la misma figura de un mecanismo, el significado pretendido es que los movimientos de electrones que se muestran están ocurriendo simultáneamente. Por ejemplo, en la figura anterior, el movimiento electrónico ilustrado por la flecha (a) (formación de\(\ce{O-H}\) enlaces) se está produciendo al mismo tiempo que la ruptura del\(\ce{H-Cl}\) enlace ilustrada por la flecha (b).
El estado de transición (TS) de una etapa química es un punto en el que los enlaces están en proceso de rotura y/o formación. (Más específicamente, veremos a continuación al discutir diagramas de energía que el estado de transición es el punto de mayor energía en la etapa química). Los estados de transición se ilustran dibujando los enlaces de formación/ruptura como líneas punteadas, y están encerrados por corchetes con el símbolo de “doble daga”. Por ejemplo, el estado de transición en la reacción ácido-base entre hidróxido y se\(\ce{HCl}\) puede ilustrar como:
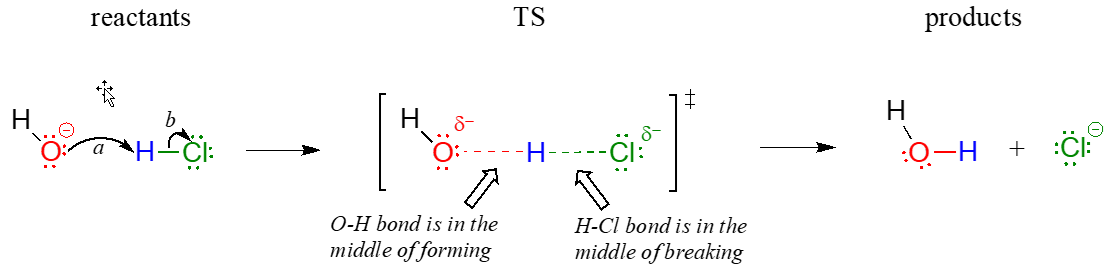
Observe en el dibujo anterior que tanto el oxígeno como el cloro llevan cargas negativas parciales en el estado de transición: la carga formal sobre el oxígeno cambia de -1 a 0 durante el transcurso de la etapa de reacción, mientras que la carga formal sobre el cloro cambia de 0 a -1.
Si bien a veces puede ser instructivo incluir un dibujo de estado de transición en un diagrama de mecanismo orgánico, no son elementos 'obligatorios' de dicho diagrama. Cuando se le pida que dibuje un mecanismo de reacción en los ejercicios y problemas de este libro, no es necesario incluir dibujos TS en su respuesta a menos que se le indique específicamente que lo haga.
Dibuje flechas de movimiento electrónico para ilustrar el mecanismo de la reacción ácido-base entre ácido acético\(\ce{CH3CO2H}\),, y amoníaco,\(\ce{NH3}\). Extraer las estructuras Lewis de reactivos y productos, incluyendo todos los pares solitarios y cargas formales. Incluya un dibujo de estado de transición en su mecanismo.
Dibuja flechas de movimiento electrónico para ilustrar el mecanismo del reverso de la reacción en el Ejercicio 6.2.1 : la reacción ácido-base entre el ion acetato (\(\ce{CH_3CO_2^-}\), actuando como base) y el amonio (\(\ce{NH_4^+}\)), actuando como un ácido). Nuevamente, extraer las estructuras Lewis de reactivos y productos, incluyendo todos los pares solitarios y cargas formales.
Una reacción de sustitución nucleofílica de una etapa
La reacción entre hidróxido y\(\ce{HCl}\) es un ejemplo sencillo de una reacción ácido-base de Brønsted (transferencia de protones). Ahora continuamos nuestra introducción a las ideas esenciales de la reactividad orgánica con un tipo diferente de reacción en la que se reordenan los enlaces a un átomo de carbono. Considera lo que podría suceder si un ión hidróxido se encuentra con una molécula de clorometano. El hidróxido es una especie rica en electrones, por lo que podría esperarse que actúe como base y 'ataque' a un hidrógeno como lo hizo en el ejemplo anterior con ácido clorhídrico. En este caso, sin embargo, los tres hidrógenos sobre el clorometano no son pobres en electrones, ya que están ligados no al cloro sino al carbono, que no es muy electronegativo. Sin embargo, hay un átomo relativamente pobre en electrones en el clorometano: el carbono mismo.
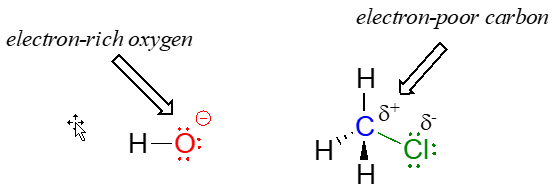
Debido a la relativa electronegatividad del cloro, el enlace carbono-cloro es polar. Es lógico pensar que un par solitario de electrones en el oxígeno hidróxido rico en electrones será atraído hacia el núcleo de carbono pobre en electrones.
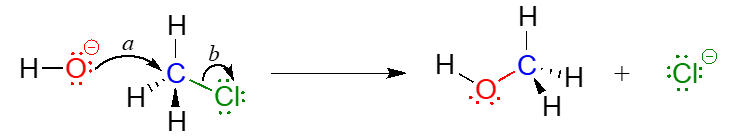
En el dibujo del mecanismo anterior, la flecha curva (a) muestra los electrones de par solitario en el oxígeno hidróxido moviéndose para llenar un\(sp^3\) orbital sobre clorometano, formando un nuevo enlace carbono-oxígeno s. No obstante, para que se forme este nuevo vínculo, uno de los enlaces que ya están en el carbono debe romperse simultáneamente; de lo contrario, habrá cinco enlaces al carbono y se violará la regla del octeto (recuerde que la 'regla del octeo' nos dice que los elementos en la segunda fila de la tabla periódica pueden tener un máximo de ocho electrones de valencia). La flecha curva (b) ilustra cómo los dos electrones en el enlace carbono-cloruro se rompen de su enlace s y se convierten en un par solitario en el producto de iones cloruro. En otras palabras, la flecha (b) ilustra la ruptura del enlace carbono-cloro. (Veremos un dibujo de estado de transición para esta reacción en el capítulo 8, cuando estudiemos este tipo de mecanismo de reacción con mucho mayor detalle).
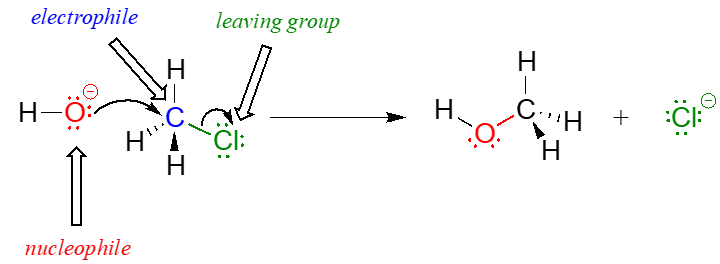
El mecanismo de reacción ilustrado anteriormente llamó una sustitución nucleofílica. El término 'sustitución' es fácil de entender: solo reconozca cómo el hidróxido sustituye al cloro como el cuarto enlace al carbono central. El término “nucleofílico” significa “amante del núcleo” y se refiere a las especies ricas en electrones, el oxígeno hidróxido. Este oxígeno es un nucleófilo: es rico en electrones y atraído por el núcleo pobre en electrones del átomo de carbono, y 'ataca' con un par solitario para formar un nuevo enlace covalente.
Hay dos términos más que entran en juego aquí, ambos los cuales verás una y otra vez a medida que continúas estudiando reacciones orgánicas. Debido a que el átomo de carbono en el cloruro de metilo es pobre en electrones, se siente atraído por cualquier cosa que sea rica en electrones, cualquier cosa nucleófila, en otras palabras. Así, el carbono es referido en este contexto como un electrófilo. El cloro, debido a que sale con dos electrones para convertirse en un ion cloruro, se denomina grupo lábil.
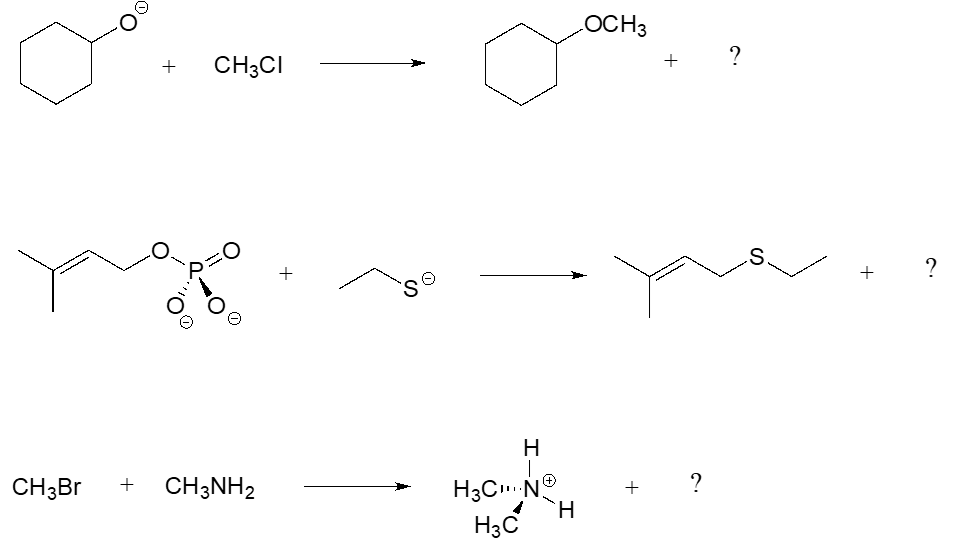
En cada una de las reacciones de sustitución nucleofílica a continuación, identifique el grupo nucleófilo, electrófilo y saliente, y rellene el producto faltante.
.docx_%255BCompatibility_Mode%255D_-_Word_(Product_Activation_Fai.png)
Un mecanismo de sustitución nucleofílica de dos pasos
Los mecanismos de reacción describen no solo el movimiento electrónico que ocurre en una reacción química, sino también el orden en que ocurren los eventos de ruptura y formación de enlaces. Algunas reacciones de sustitución nucleofílica, por ejemplo, pueden ocurrir por un mecanismo de dos etapas que es diferente del mecanismo de un solo paso que acabamos de ver entre el ión hidróxido y el clorometano. Observe, por ejemplo, la reacción de sustitución entre el ion acetato y el 2-cloro-2-metil propano (nombre común cloruro de terc-butilo).
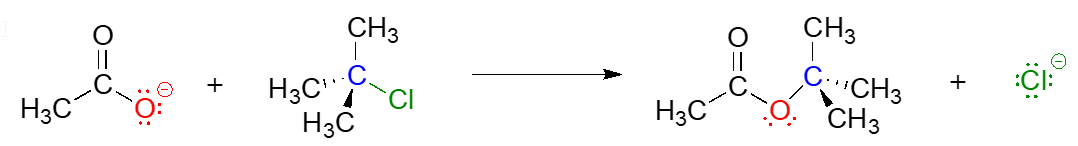
A diferencia de la reacción de clorometano más hidróxido, en la que el proceso de sustitución se realizó en una sola etapa concertada, resulta que este mecanismo implica dos etapas separadas. El grupo saliente, anión cloruro, sale primero, antes de que el nucleófilo acetato ataque.
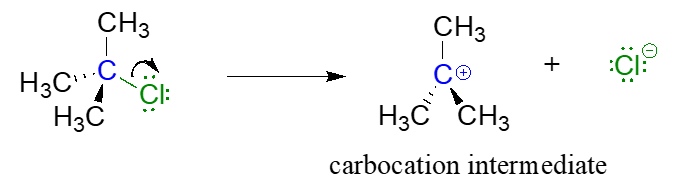
Paso 1: Pérdida del grupo de salida (lenta)
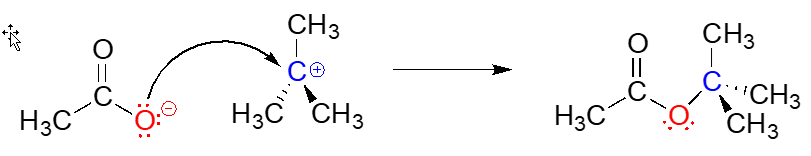
Paso 2: Ataque Nucleofílico (rápido)
Debido a que el carbono central (coloreado de azul en la figura anterior) ha perdido su parte de los dos electrones en lo que era el enlace carbono-cloro, ahora está cargado positivamente. Recordemos de la sección 2.1 que podemos imaginar un carbocatión como un centro de\(sp^2\) carbono hibridado plano con tres enlaces, un\(p\) orbital vacío y una carga positiva completa.
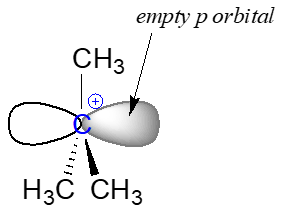
El carbocatión es altamente reactivo, y no existe por mucho tiempo antes de participar en un evento posterior de formación de enlaces. En el lenguaje de los mecanismos orgánicos, se le conoce como un intermedio de reacción.
Con su\(p\) orbital vacío, el carbocatión intermedio es claramente pobre en electrones, y por lo tanto es un potente electrófilo. El ion acetato cargado negativamente es denso en electrones y un nucleófilo, y como tal es fuertemente atraído por el electrófilo de carbocatión. El ataque por el nucleófilo da como resultado un nuevo enlace carbono-oxígeno y la formación del producto de sustitución.
Tendremos mucho más que decir sobre sustituciones nucleofílicas, nucleófilos, electrófilos y grupos salientes en el capítulo 8. El mensaje para llevar a casa en este punto, sin embargo, es simplemente que dos reacciones que parecen bastante similares en cuanto a los reactivos y productos pueden ocurrir por diferentes mecanismos.
Probablemente ya puedas apreciar lo esencial que es entender y poder trabajar con flechas curvas; es algo que usará constantemente durante el resto de tu estudio de la reactividad orgánica.
Por ejemplo, aunque todavía no está familiarizado con el mecanismo de reacción relevante (es la reacción a la proteasa del VIH, cubierta en el capítulo 11), dadas las estructuras reaccionantes e intermedias:

con la práctica deberías en este punto ser capaz de reconocer el movimiento electrónico formador de enlaces y romper el enlace que está teniendo lugar, y dibujar las flechas curvas apropiadas:
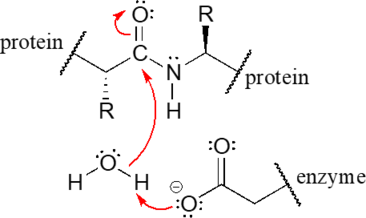
Una palabra adicional de precaución: muchos estudiantes orgánicos principiantes cometen el error de usar flechas curvas para representar el movimiento de los átomos. ¡Esto es incorrecto! Las flechas curvas en un mecanismo orgánico siempre se refieren al movimiento de los electrones.


