6.3: Una revisión rápida de la termodinámica y la cinética
- Page ID
- 72606
Puede recordar de la química general que a menudo es conveniente ilustrar la energética de una reacción química con un diagrama de coordenadas de reacción. En un diagrama de coordenadas de reacción, el eje vertical representa la energía potencial global de los reactivos, mientras que el eje horizontal es el 'coordinado de reacción', trazando de izquierda a derecha el progreso de la reacción desde los reactivos iniciales R hasta los productos finales P. (Muchos estudiantes encuentran útil imaginar el eje horizontal en un diagrama de coordenadas de reacción como análogo a la barra de progreso en la parte inferior de un video de youtube). El diagrama de una reacción típica de sustitución nucleofílica de un solo paso, como la que se encuentra entre el hidróxido y el cloruro de metilo, podría verse así:
A pesar de su aparente simplicidad, este diagrama transmite algunas ideas muy importantes sobre la termodinámica y cinética de la reacción. Recordemos que cuando hablamos de la termodinámica de una reacción, nos preocupa principalmente la diferencia de energía entre los reactivos (R) y los productos (P): si la reacción en su conjunto es cuesta arriba o cuesta abajo. Cuando hablamos de cinética, por otro lado, nos preocupa la velocidad de reacción: qué tan rápido pasa de los reactivos a los productos, independientemente de que esa transformación sea energéticamente cuesta arriba o cuesta abajo.
Termodinámica
Primero, una revisión rápida de algunos términos clave de termodinámica. Recordemos que el cambio estándar de energía libre de Gibbs de una reacción (\(\Delta G^o\)) es la diferencia de energía entre los reactivos y los productos en condiciones estándar. El cambio de energía libre de Gibbs es una combinación de cambio de entalpía (\(\Delta H^o\)) y cambio de entropía (\(\Delta S^o\)):
\[\Delta G = \Delta H^o - T\Delta S^o\]
donde
- \(T\)es la temperatura en Kelvin (recordemos que la temperatura Kelvin es simplemente la temperatura Celsius más 273.15).
- El cambio de entalpía (\(\Delta H^o\)) es el calor liberado o absorbido por la reacción.
- El cambio de entropía (\(\Delta S^o\)) es el cambio en el trastorno de los reactivos a los productos. En una reacción en la que una molécula se escinde en dos moléculas más pequeñas, por ejemplo, el trastorno aumenta, por lo que\(\Delta S^o\) es positivo.
La constante de equilibrio (\(K_{eq}\)) para una reacción es una expresión de las concentraciones relativas de reactivos y productos después de que la reacción haya alcanzado el equilibrio. La constante de equilibrio se define como:
Ahora, repasemos lo que nos dice el diagrama energético anterior sobre la termodinámica de la reacción. Tenga en cuenta que el nivel de energía de los productos es menor que el de los reactivos. Esto nos dice que el cambio de energía libre de Gibbs para la reacción es negativo, y el paso es exergónico, o liberación de energía. También podemos decir que la reacción es 'termodinámicamente favorable', o, de manera más informal, 'cuesta abajo'.
Recordemos de General Chemistry que el cambio estándar de energía libre de Gibbs para una reacción puede relacionarse con la constante de equilibrio de la reacción (Keq) por la ecuación:
\[\Delta G^o = -RT \ln K_{eq}\]
donde\(R\) está la constante del gas (8.314 J/mol×K) y\(T\) es la temperatura en Kelvin (K).
Si haces los cálculos, ves que un valor negativo para\(\ce{\Delta G_{rnx}^{\circ}}\) (una reacción exergónica) corresponde a\(\ce{K_{eq}}\) ser mayor que 1, una constante de equilibrio que favorece la formación del producto.
Por el contrario, una reacción endergónica es aquella en la que los productos son más altos en energía que los reactivos, y la energía es absorbida. Una reacción endergónica tiene un valor positivo de\(\ce{\Delta G _{rnx}^{\circ}}\), y a\(\ce{K_{eq}}\) entre 0 y 1.
Las reacciones ácido-base proporcionan ejemplos convenientes de reacciones termodinámicamente favorables y desfavorables. La reacción de un ácido fuerte como\(\ce{HCl}\) con una base fuerte como el ion hidróxido, por ejemplo, es altamente favorable, y tiene una constante de equilibrio mucho mayor que una. La reacción de un ácido débil como el ácido acético con una base débil como el agua, por otro lado, es desfavorable y tiene una constante de equilibrio que es un número positivo muy pequeño (mucho menor que 1): podemos visualizar esto en un diagrama de coordenadas de reacción como una reacción 'cuesta arriba', en la que\(\ce{\Delta G^{\circ}_{rnx}}\) se encuentra positivo.
Cuando se habla de reacciones exergónicas o “cuesta abajo”, los químicos a veces usan el término 'fuerza impulsora' para describir el factor o factores químicos que impulsan la reacción de un reactivo de mayor energía a un producto de menor energía. Usando nuevamente la analogía 'cuesta abajo', cuando el agua fluye cuesta abajo, la fuerza impulsora es la gravedad. En una reacción química exergónica, la fuerza motriz generalmente se basa en una combinación de dos factores: a) la estabilidad de las cargas positivas y negativas en el producto con respecto a las del reactivo, y b) la energía de enlace total en el producto respecto al reactivo. Eso puede que no tenga mucho sentido en este momento, pero manténgalo en el fondo de su mente y volveremos a la idea de fuerza motriz cuando estudiemos diferentes tipos de reacciones con mayor detalle.
Ahora, pasemos a la cinética. Vuelva a mirar el diagrama para una reacción exergónica: aunque es 'cuesta abajo' en general, no es una carrera cuesta abajo recta.
Primero, se debe superar una 'barrera energética' para llegar al lado del producto. La altura de esta barrera energética se llama la energía libre estándar de activación (\(\ce{\Delta G^{\circ}_+^+}\)). La energía de activación, en combinación con la temperatura a la que se está llevando a cabo la reacción, determina la velocidad de una reacción: cuanto mayor es la energía de activación, más lenta es la reacción. En la parte superior de la barrera energética, la reacción se encuentra en su estado de transición (TS), lo que debe recordar se define como la estructura de energía más alta en la transición del reactivo al producto.
Considere los diagramas hipotéticos de coordenadas de reacción de reacción a continuación.
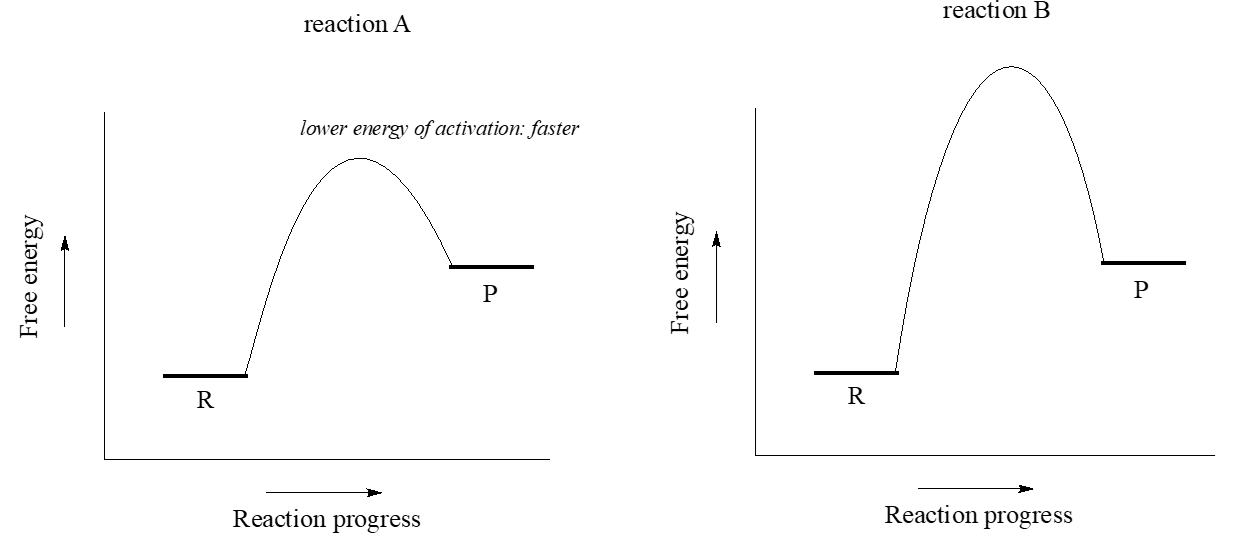
Tanto la reacción A como la reacción B son ligeramente endergónicas, o cuesta arriba:\(\ce{\Delta G^{\circ}_{rxn}}\) para ambas es positiva, lo que significa que\(\ce{K_{eq}}\) para ambas está entre 0 y 1. Sin embargo, la energía de activación es mayor para la reacción B. A partir de esta observación, sabemos que la reacción A procederá más rápido que la reacción B tanto en dirección directa como inversa (siendo iguales la temperatura y otras condiciones), por lo que la reacción A alcanzará el equilibrio en menos tiempo.
Considere los diagramas hipotéticos de coordenadas de reacción a continuación, y asuma que están en la misma escala.
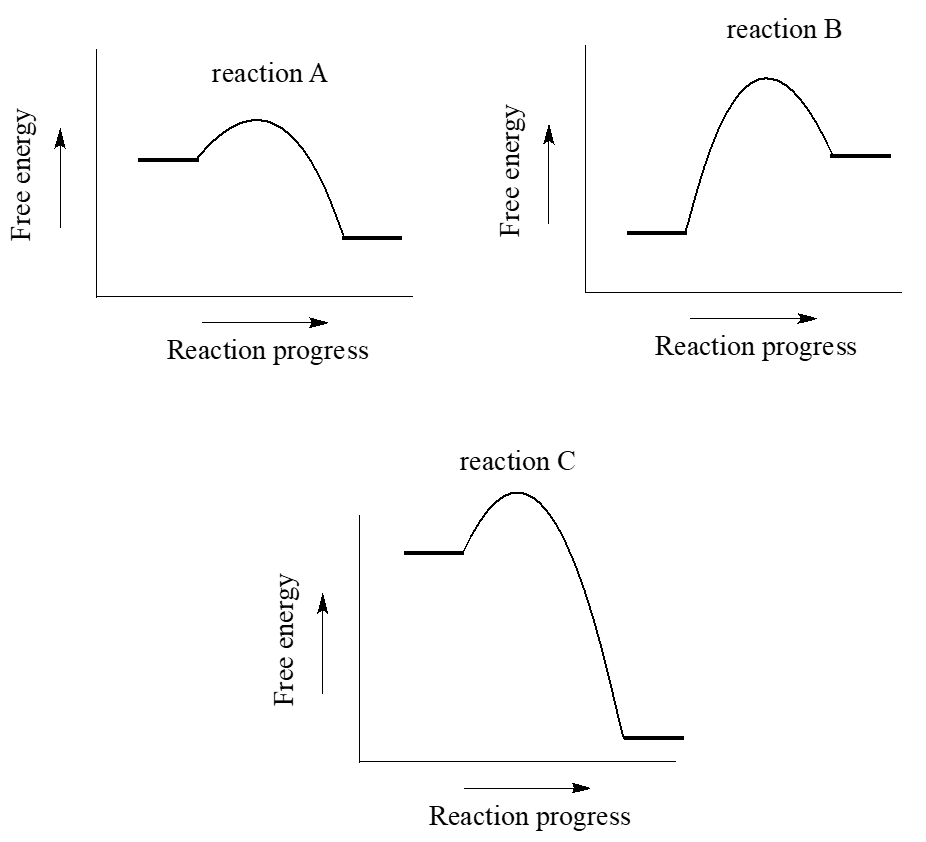
- ¿Cuál de los diagramas describe (n) una reacción con\(\ce{K_{eq} < 1}\)?
- ¿Cuál de los diagramas describe la reacción más rápida?
- ¿Cuál de los diagramas describe la reacción con el mayor valor de\(\ce{K_{eq}}\)?
- ¿Cuál de los diagramas describe la reacción con la mayor\(\ce{\Delta G _{rnx}^{\circ}_{+}^{+}}\) para la reacción inversa?
- Copia el diagrama de tu respuesta a la parte (d) y agrega una etiqueta que ilustre gráficamente el valor de\(\ce{\Delta G _{rnx}^{\circ}_{+}^{+}}\) para la reacción en la dirección inversa.
Pasamos nuestra atención a un mecanismo de reacción en dos etapas, como la reacción de sustitución nucleofílica entre acetato y cloruro de terc-butilo. El diagrama de coordenadas de reacción para esta reacción se ve algo diferente de lo que hemos visto hasta ahora:
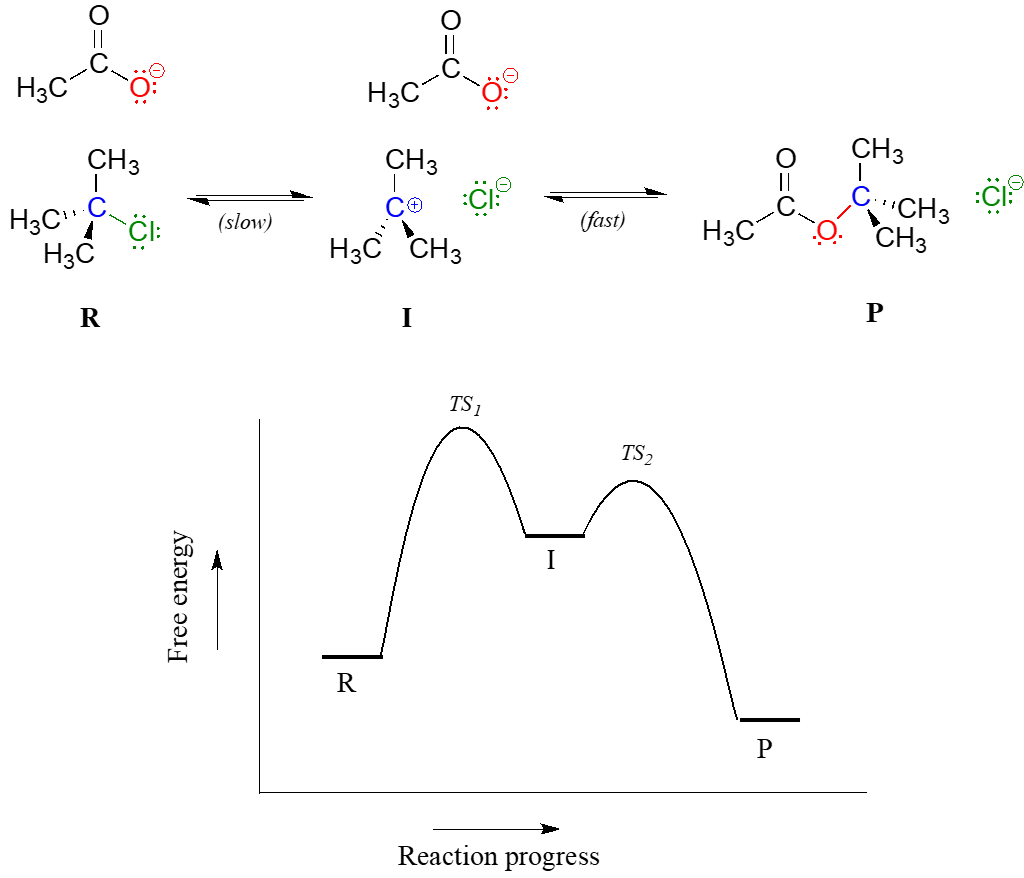
Debido a que hay dos pasos involucrados, también hay dos estados de transición y dos energías de activación a considerar, así como un intermedio de carbocatión (denotado por la letra I). El primer paso de ruptura de enlaces de R a I, pasando por el estado de transición\(TS_1\), se puede representar como una reacción altamente endergónica (cuesta arriba), ya que el par de iones carbocatión-cloruro es significativamente mayor en energía que los reactivos. El segundo paso, el ataque al electrófilo de carbocatión por el nucleófilo acetato y la formación del nuevo enlace carbono-oxígeno, es un paso altamente exergónico que pasa por un segundo estado de transición de energía inferior\(TS_2\). El intermedio (I) se representa así como un 'valle' de energía (un mínimo de energía local) situado entre los dos picos de energía\(TS_1\) y\(TS_2\).
Observe que la energía de activación para el primer paso es mayor que la energía de activación para el segundo, lo que significa que el primer paso es más lento. Esto debería tener sentido intuitivo, porque el primer paso consiste en romper la unión, separar la carga y formar un carbocatión, el cual es alto en energía debido a la falta de un octeto completo. Por el contrario, el segundo paso implica la formación de la unión y la neutralización de la carga. En una reacción de múltiples etapas, el paso más lento, el paso con la mayor energía de activación, se conoce como el paso determinante de la velocidad (rds). Los rds pueden considerarse como el 'cuello de botella' de la reacción: un factor que afecta a los rds afectará la velocidad general de la reacción. Por el contrario, un factor que afecta un paso mucho más rápido no afectará significativamente la velocidad de la reacción general.
Imagina que estás tratando de extinguir una fogata ardiente usando cubetas de agua llenas de un grifo a cierta distancia del fuego. Se necesitan 20 segundos para llenar una cubeta en el grifo, y dos segundos para llevar la cubeta al fuego y volcarla sobre las llamas. Tienes mucha gente para llevar los cubos, pero solo un grifo para que solo puedas llenar un balde a la vez.
- Si duplicas la velocidad a la que llevas los cubos corriendo en lugar de caminar, ¿qué efecto tendrá esto en la rapidez con la que llegues agua al fuego?
- Si, en cambio, te das cuenta de que puedes duplicar la velocidad a la que llenas los cubos usando un segundo grifo, ¿qué efecto tendrá esto en la rapidez con la que llegues agua al fuego?
- ¿Cuál es el paso determinante de la tasa para el proceso?
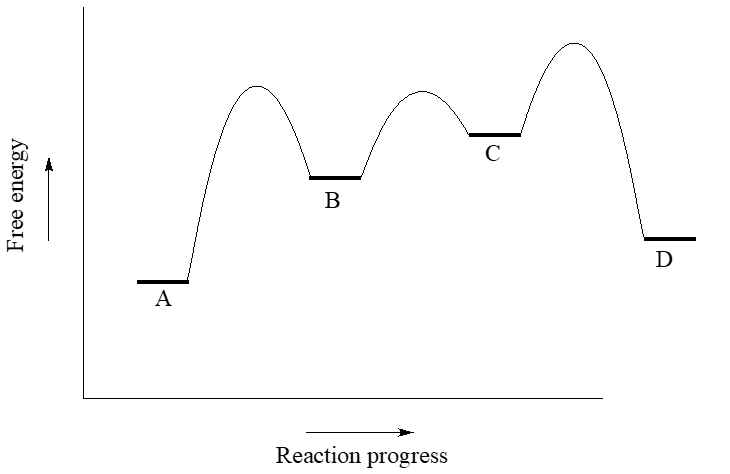
Utilice el diagrama de coordenadas de reacción a continuación para responder a las preguntas.
.docx_%255BCompatibility_Mode%255D_-_Word_(Product_Activation_Fai.png)
- ¿La reacción general es endergónica o exergónica en la dirección hacia adelante (A a D)?
- ¿Cuántos pasos tiene el mecanismo de reacción?
- ¿Cuántos intermedios tiene el mecanismo de reacción?
- Vuelva a dibujar el diagrama y agregue una etiqueta que muestre la energía de activación para el paso determinante de la velocidad de la reacción hacia adelante.
- Añadir una etiqueta que muestre\(\ce{\Delta G^{\circ}_{rxn}}\) la reacción inversa (D a A).
- ¿Cuál es el paso de reacción más rápido, considerando tanto las direcciones hacia adelante como hacia atrás?


