7.9: Efectos del microambiente enzimático sobre la acidez y basicidad
- Page ID
- 72266
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Prácticamente todas las reacciones bioquímicas tienen lugar dentro del bolsillo del sitio activo de una enzima, en lugar de estar libres en solución acuosa. El microambiente dentro del sitio activo de una enzima a menudo puede ser muy diferente del ambiente exterior en el disolvente acuoso. Considere, por ejemplo, el carboxilato de cadena lateral en un residuo de aspartato en una enzima. La literatura\(pK_a\) de este grupo ácido carboxílico se enumera como 3.9, pero esta estimación asume que el grupo se posiciona sobre la superficie de la proteína, expuesta al agua. En el tampón fisiológico de\(pH ~ 7\), un grupo ácido carboxílico con\(pK_a = 3.9\) estará completamente desprotonado y cargado negativamente. Sin embargo, si una cadena lateral de aspartato pasa a estar enterrada en lo profundo del interior del sitio activo de la proteína, y está rodeada principalmente por cadenas laterales no polares como alanina, fenilalanina, triptófano, etc., la situación es muy diferente.
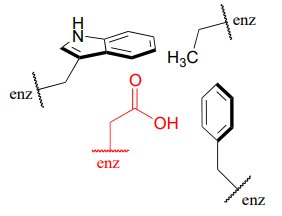
Separado del ambiente del disolvente a granel, el grupo carboxilato (rojo en la figura anterior) se encuentra ahora en un microambiente muy no polar, situación en la que el estado protonado y sin carga se estabiliza en relación con el estado desprotonado, cargado negativamente (esto es simplemente otra aplicación del 'like disuelve como' principio que aprendiste en Química General - un grupo cargado está altamente desestabilizado por un ambiente no polar). El efecto general es que el\(pK_a\) para este residuo de aspartato es en realidad superior a 3.9 — es menos ácido, y es más probable que esté en su forma protonada dentro de la proteína.
Un efecto similar se observaría en una situación en la que los grupos carboxilato de cadena lateral de dos residuos de aspartato se encuentran muy próximos entre sí en un sitio activo enzimático. Dos grupos cargados negativamente cercanos entre sí representan una situación de energía muy alta, repulsiva, y esto puede aliviarse si una de las dos cadenas laterales está protonada.

En este microambiente, la proximidad de un grupo de aminoácidos afecta directamente al pKa de su vecino.
Consideremos ahora una situación en la que un ion metálico como el magnesio (\(Mg^{+2}\)) o el zinc (\(Zn^{+2}\)) se une en el interior de la enzima, en estrecho contacto con una cadena lateral de aspartato. Con un catión con el que interactuar, se estabiliza el estado aniónico desprotonado del aminoácido, por lo que es probable que el\(pK_a\) de este residuo Asp sea sustancialmente inferior a 3.9.

El ion metálico en esta situación se considera que actúa como un ácido de Lewis, aceptando densidad electrónica del grupo carboxilato.
El efecto\(pK_a\) -reductor de un catión metálico puede ser dramático- se ha estimado que una molécula de agua coordinada a un\(Cu^{+2}\) o\(Zn^{+2}\) ion puede tener un valor\(pK_a\) tan bajo como 7 (¡compárelo con el agua 'normal'\(pK_a\) de 15.7!)
Un residuo de lisina localizado profundamente en el interior de una proteína está rodeado por residuos no polares. ¿En qué dirección alterará esto la 'normalidad'\(pK_a\) de la cadena lateral de lisina, y por qué?
En muchas reacciones bioquímicas que implican la formación de un intermedio enolato, el oxígeno carbonílico del sustrato se coordina a un ion metálico divalente (generalmente zinc o magnesio) en el sitio activo. Explique, con dibujos estructurales, cómo esta interacción ión-dipolo afecta la acidez de los\(\alpha \) -protones del fosfato de dihidroxiacetona (DHAP), un compuesto intermedio en la vía de la glucólisis.



