8.9: Sustitución nucleofílica en el Laboratorio
- Page ID
- 72746
La síntesis de éter de Williamson
Los químicos orgánicos sintéticos suelen hacer uso de una reacción conceptualmente muy similar a las reacciones de metilación dependientes de SAM que vimos anteriormente. La 'síntesis de éter de Williamson' lleva el nombre de Alexander William Williamson, quien desarrolló la reacción en 1850.
En la síntesis de éter de Williamson, un alcohol es desprotonado primero por una base fuerte, típicamente hidruro de sodio. Luego se añade un haluro de alquilo a la mezcla de reacción, y el ion alcóxido, un potente nucleófilo, desplaza el grupo de salida haluro en una\(S_N2\) reacción.
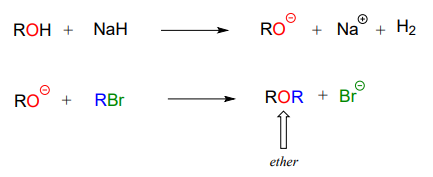
Por ejemplo, a continuación vemos bromuro de metilo desempeñando el papel de donante del grupo metilo, análogo al papel desempeñado por SAM en reacciones de metilación bioquímicas:
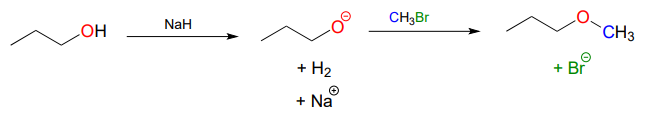
Observe la diferencia entre esta reacción de laboratorio no biológica y la reacción de metilación SAM biológica catalizada por enzimas que vimos anteriormente. La desprotonación del nucleófilo ocurre como un paso separado, antes de que el nucleófilo ataque. Contraste esta reacción en solución (con dos etapas bimoleculares) con la\(S_N2\) reacción catalizada por enzimas (metilación SAM) que vimos anteriormente, que implica un solo paso trimolecular concertado. También hay que notar que esta reacción no biológica involucra un reactivo altamente básico (hidruro de sodio) y un intermedio (anión propanoato), lo que no sería razonable proponer que una reacción tenga lugar en condiciones fisiológicas.
La síntesis de éter de Williamson solo funcionará con haluros de metilo o alquilo primario. Si se usa un haluro de alquilo secundario o terciario, el resultado será la formación de un alqueno en lo que se denomina reacción de 'eliminación':
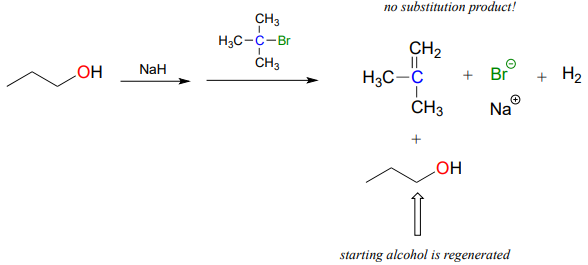
Estudiaremos las reacciones de eliminación en el capítulo 14.
Un químico orgánico novato ejecutó la reacción mostrada anteriormente, con la esperanza de sintetizar un éter. En cambio, obtuvo el alqueno mostrado. ¿Qué combinación de haluros de alquilo/alcohol debería haber usado en su lugar para obtener el producto éter que estaba buscando?
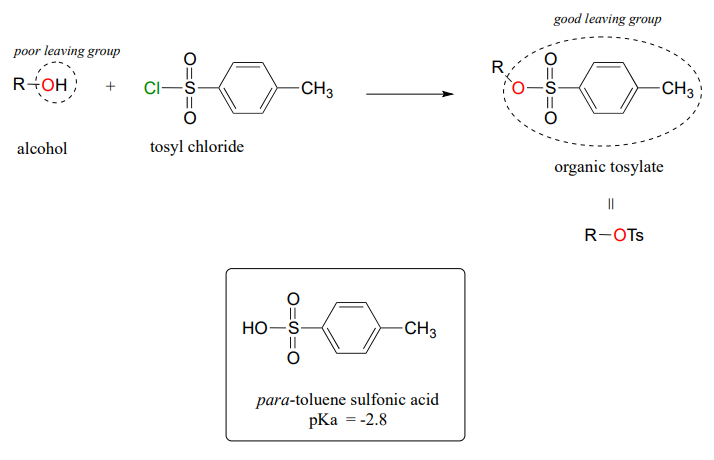
Convertir a un grupo pobre que se va en uno bueno - tosila
En la sección 8.4 se mencionó cómo, en vías metabólicas, el grupo de\(OH\) salida relativamente pobre de un alcohol puede convertirse en un fosfato o difosfato, que cuando se estabiliza por interacciones no covalentes dentro de un sitio activo enzimático puede ser un grupo saliente muy bueno.
En la síntesis de laboratorio, se puede lograr un objetivo similar convirtiendo un alcohol (un grupo pobre de salida) en un tosilato orgánico (un buen grupo de salida) usando cloruro de tosil (los términos 'tosilato' y 'OTs', son abreviaturas para para-tolueno sulfonato). La reacción de alcohol a tosilato no es algo que estemos equipados aún para entender, pero si consideramos que el pKa del ácido para-tolueno sulfónico es -2.8, nos damos cuenta de que el anión para-tolueno sulfonato es una base muy débil y por lo tanto un grupo eliminable muy bueno. La conversión de alcoholes a tosilatos orgánicos es un paso muy común en los esquemas de síntesis orgánica.