9.E: Reacciones de Transferencia de Fosfato (Ejercicio)
- Page ID
- 72514
En todos los problemas que siguen, no dude en utilizar las abreviaturas adecuadas al dibujar estructuras. Sin embargo, siempre asegúrese de no abreviar regiones de una estructura que están directamente involucradas en eventos de ruptura o formación de enlaces.
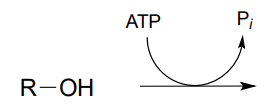
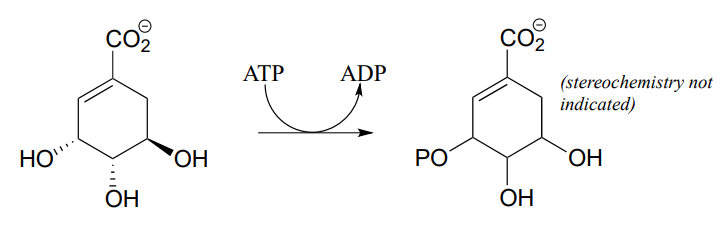
P9.1: Dibujar un mecanismo probable para la reacción catalizada por shikimato quinasa (EC 2.7.1.71) en la ruta de biosíntesis de aminoácidos aromáticos). La estereoquímica del producto no se indica en la siguiente figura - en su mecanismo, muestra la estereoquímica del producto y explica cómo eres capaz de predecirlo a partir de tu conocimiento de las reacciones de quinasa.
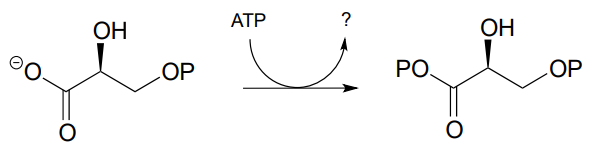
P9.2: Dibujar un mecanismo probable para la siguiente reacción (EC 2.7.2.3) en la vía de la gluconeogénesis, y predecir qué compuesto está indicado por el signo de interrogación.
P9.3:
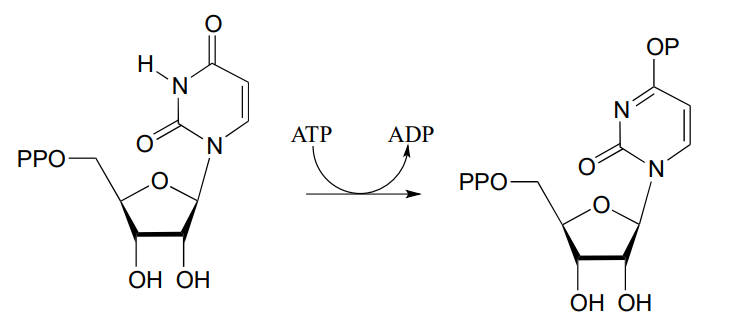
- Dibujar un mecanismo probable para la siguiente reacción (EC 6.3.4.2) a partir de la biosíntesis de ribonucleótidos. Pista: ¿qué es el grupo nucleofílico? ¿Cómo podría la enzima aumentar su nucleofilia?
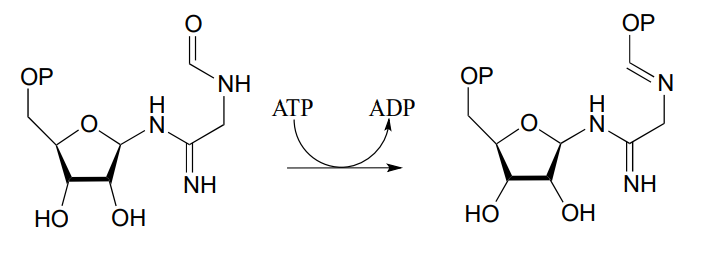
- Dibujar un mecanismo para la siguiente reacción, también a partir de la biosíntesis de ribonucleótidos (EC 6.3.3.1):
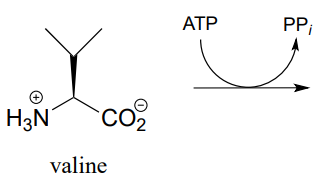
P9.4:
- El grupo carboxilato en el aminoácido valina se activa en una etapa temprana en la biosíntesis del antibiótico penicilina. Predecir el producto de esta reacción y extraer el intermedio probable de la reacción de transferencia del grupo fosfato.
P9.5: La siguiente reacción es un paso temprano en la síntesis de tyvelose, un azúcar que se encuentra en la superficie de algunas bacterias patógenas. Observe que el CTP juega el papel del donante del grupo fosfato en este caso, en lugar de ATP.
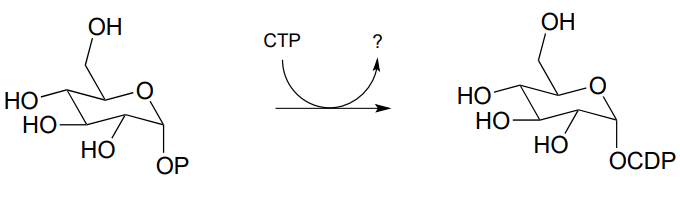
Dibujar un mecanismo para la reacción, e indicar el segundo producto que es liberado por la enzima. (J. Biol. Chem. 2005, 280, 10774)
P9.6: Dibujar el producto probable de las siguientes reacciones hipotéticas de transferencia de grupos fosfato. Especificar qué grupo fosfato de ATP es el electrófilo en cada caso.
P9.7: La siguiente figura ilustra un experimento en el que una reacción catalizada por una enzima de E. coli se realizó en agua marcada isotópicamente.
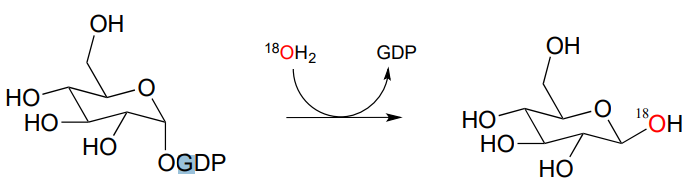
- Los investigadores concluyeron que la reacción no fue una transferencia de grupo fosfato. Explicar su razonamiento.
- Dibujar los productos que se esperarían si la reacción realmente procediera por un mecanismo de transferencia de fosfato (asegúrese de mostrar la estereoquímica y la ubicación del\(^{18}O\) átomo).
P9.8: La siguiente reacción procede con un ataque directo de una molécula de agua sobre el sustrato, pero se podría esperar que la hidrólisis procediera a través de dos posibles mecanismos. Dibujar dos posibles mecanismos para la ejecución de la reacción\(H_2^{18}O\). Rastrea el progreso de la\(^{18}O\) 'etiqueta' a lo largo de cada mecanismo para ver dónde termina: esto debería indicarte cómo podrían ser los dos mecanismos (¡y de hecho fueron!) distinguido experimentalmente.
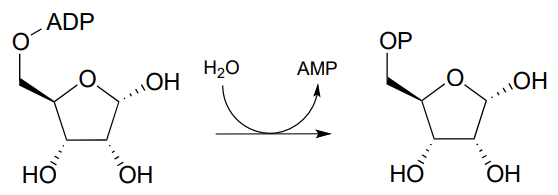
P9.9: La glucosa-6-fosfato se desfosforila a glucosa en el último paso de la vía de la gluconeogénesis (EC 5.3.1.9). La reacción no es una hidrólisis directa: como la reacción de fosfotirosina fosfatasa que vimos en este capítulo implica la formación de un intermedio fosfoenzimático, pero en este caso el residuo enzimático que actúa como aceptor de fosfato inicial es una histidina de sitio activo más que un asparato. Ante esta información, proponer un mecanismo probable para la reacción.
P9.10: (Esta pregunta asume un conocimiento básico de la estructura del ADN y la idea de superenrollamiento). Las enzimas de ADN topoisomerasa catalizan el 'mellado' temporal de una cadena de ADN bicatenario, lo que permite que el ADN superenrollado se 'desenrolle' antes de que la hebra mellada se vuelva a ligar. Durante el proceso de desenrollado, el extremo 5' de la cadena mellada se transfiere a una tirosina en el sitio activo de la enzima, sosteniéndola efectivamente en su lugar mientras el extremo 3' gira. En general, se conserva la configuración estereoquímica del fosfato puente. Proponer un mecanismo probable para este proceso de mellado y re-ligadura. (Bioquímica 2005, 44, 11476.)
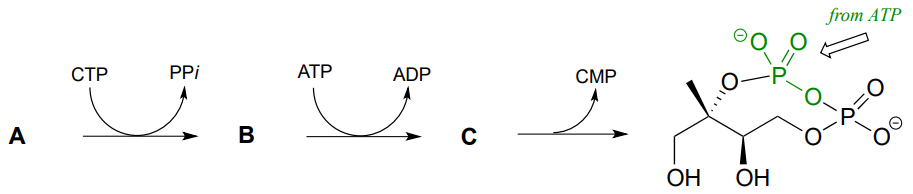
P9.11: A continuación se muestra una serie de etapas de transferencia de grupos fosfato en la primera parte de la biosíntesis de isoprenoides en bacterias. Con el conocimiento de que los átomos en verde se derivan del ATP, predecir las estructuras de los compuestos A, B y C. (EC 2.7.7.60, EC 2.7.1.148, EC 4.6.1.12)
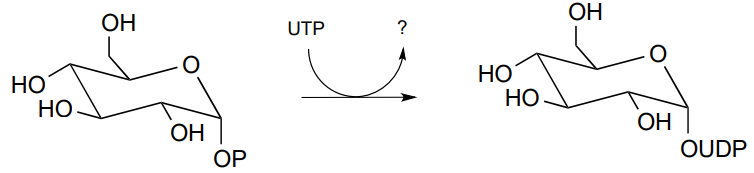
P9.12: La siguiente reacción muestra la síntesis de glucosa-UDP, un intermedio importante en la biosíntesis de carbohidratos. Observe que UTP (en lugar de ATP) es el donante de fosfato. Identificar el subproducto denotado a continuación mediante un signo de interrogación.
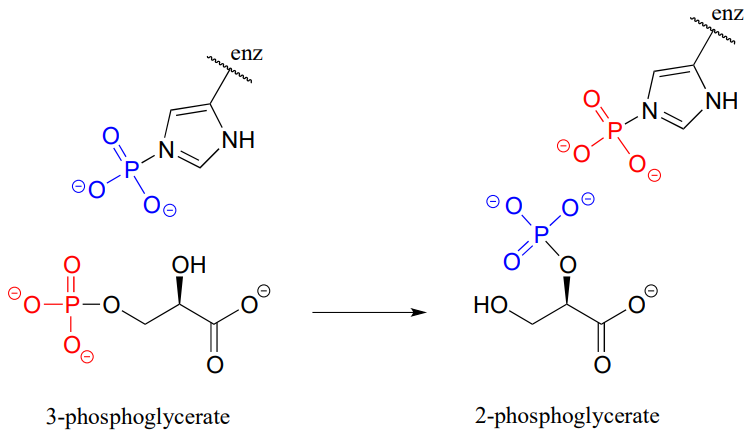
P9.13: Se ha demostrado que la isomerización de 3-fosfoglicerato a 2-fosfoglicerato (EC 5.4.2.1, una reacción en la glucólisis) ocurre con la participación de un residuo de fosfohistidina en el sitio activo de la enzima. Los dos grupos fosfato se distinguen en la figura siguiente por color. Con esta información, proponer un mecanismo para la reacción.
P9.14: La enzima gluconeogénesis (construcción de azúcar), glucosa-6-fosfatasa, cataliza una reacción indirecta de hidrólisis de fosfato con un intermedio de fosfohistidina ('hidrólisis indirecta' en este contexto significa que una molécula de agua no ataca directamente a la glucosa-6-fosfato).
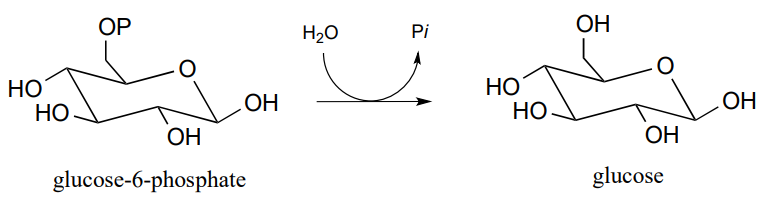
Los investigadores quisieron confirmar que la hidrólisis en esta reacción es indirecta, más que directa. Resulta que la misma enzima también es capaz de catalizar la transferencia del grupo fosfato de glucosa-6-fosfato al grupo hidroxilo sobre el carbono #6 de otra molécula de glucosa (en lugar de al agua, que es la reacción natural). La transferencia catalizada por enzimas de fosfato entre dos sustratos de glucosa es reversible.
Los investigadores incubaron la enzima con glucosa-6-fosfato marcado, en el que en el centro de fosfato fue quiral (con la configuración R) debido a la incorporación de\(^{18}O\) isótopos\(^{17}O\) y. También incluyeron una alta concentración de glucosa en la mezcla de reacción, lo que aseguró que predominara la reacción de transferencia de glucosa a glucosa y no se llevara a cabo la hidrólisis (la reacción 'natural'). Después de permitir que la reacción alcanzara el equilibrio, aislaron la glucosa-6-fosfato y observaron la configuración del grupo fosfato.
Dado lo que acabas de aprender sobre el mecanismo enzimático, predice lo que los investigadores encontraron en este experimento, explica tu predicción y dibuja la (s) estructura (s) apropiada (s), incluyendo la estereoquímica. Supongamos que el mecanismo glucosa-glucosa es idéntico al mecanismo de hidrólisis, aparte de la identidad del aceptor último de fosfato.