10.4: Acetales y Cetales
- Page ID
- 72343
Visión general
Los hemiacetales y hemicetales pueden reaccionar con un segundo nucleófilo alcohólico para formar un acetal o cetal. El segundo alcohol puede ser el mismo que el primero (es decir, si\(R_2 = R_3\) en el esquema siguiente), o diferente.
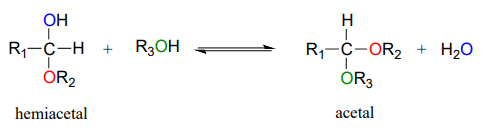
Aunque nos enfocamos aquí en las reacciones biológicas, es instructivo en este caso considerar reacciones formadoras de acetales no biológicas antes de analizar sus homólogos bioquímicos. En un contexto no enzimático, la formación de acetal/cetal, al igual que la formación hemiacetal/hemicetal, generalmente es catalizada por un ácido fuerte.
Formación de acetal catalizada por ácido (no biológica)
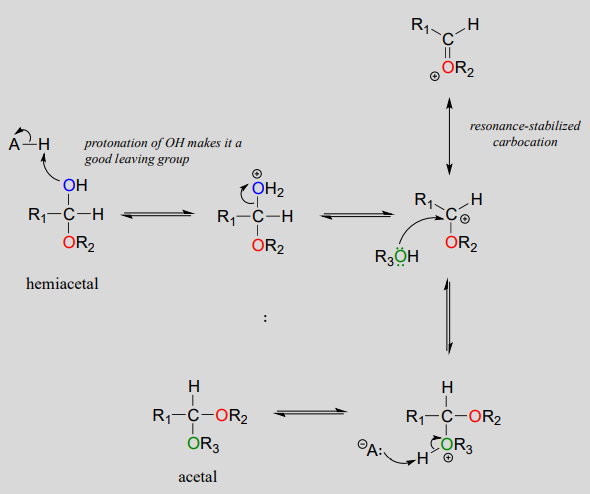
El papel del catalizador ácido es protonar el grupo OH del acetal, convirtiéndolo así en un buen grupo saliente (agua). Observe algo importante aquí: la conversión de un hemiacetal en un acetal es simplemente una\(S_N1\) reacción, con un grupo nucleófilo alcohólico y un grupo saliente de agua. El carbocatión intermedio en este\(S_N1\) mecanismo se estabiliza por resonancia debido al átomo de oxígeno ya unido al carbono electrófilo.
A continuación se presentan algunos ejemplos de acetales y cetales simples, no biológicos.
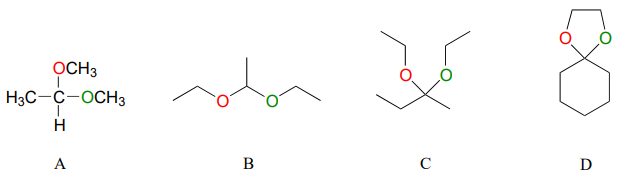
Para cada acetal/cetal A-D en la figura anterior, especifique los materiales de partida de aldehído/cetona y alcohol requeridos.
Categorizar cada una de las siguientes moléculas como hemiacetal, hemicetal, acetal, cetal, hidrato de un aldehído o hidrato de una cetona.
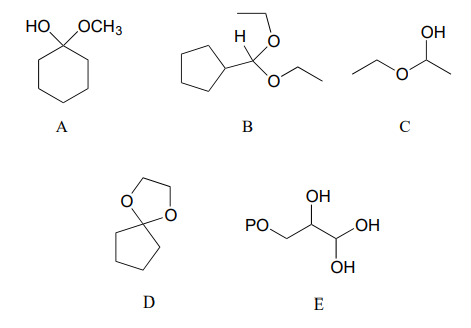
Especificar el acetal/cetal que se formaría a partir de una reacción entre los compuestos de partida dados.
a.

b.

Especificar la combinación aldehído/cetona y alcohol que se requeriría para formar los compuestos en el ejercicio 10.5.
Formación de enlaces glicosídicos
Ahora, consideremos la formación de acetal en un contexto bioquímico. Un ejemplo muy importante del grupo acetal/cetal en bioquímica son los enlaces glicosídicos que unen monómeros de azúcar individuales para formar polisacáridos (ver sección 1.3 para una revisión rápida). Observe el enlace glicosídico entre dos monómeros de glucosa en una cadena de celulasa:
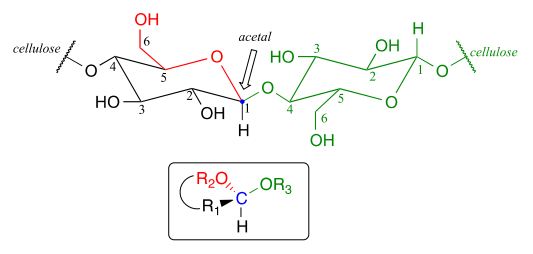
Si miras cuidadosamente, debes reconocer que el carbono #1, el carbono anomérico en el monómero de glucosa del lado izquierdo, es el carbono central de un grupo acetal. Los bioquímicos se refieren a esto como un enlace b-1,4, porque la estereoquímica en el carbono #1 es b en el sistema especializado de nomenclatura de carbohidratos, y está ligada al carbono #4 de la siguiente glucosa en la cadena. La vasta diversidad estructural de carbohidratos proviene en gran parte de los diferentes enlaces que son posibles, tanto en términos de los cuales se unen dos carbonos, como también de la estereoquímica del enlace. Verás muchas más variaciones de los patrones de enlace glicosídico si estudias la bioquímica de carbohidratos en mayor profundidad.
Las reacciones en las que se forman nuevos enlaces glicosídicos son catalizadas por enzimas llamadas glicosiltransferasas, y en términos de química orgánica estas reacciones representan la conversión de un hemiacetal en un acetal (recuerde que los monómeros de azúcar en su forma cíclica son hemiacetales y hemicetales). El mecanismo para la formación de enlaces glicosídicos en una célula viva es paralelo al mecanismo de formación de acetales catalizado por ácido (no biológico), con una diferencia importante: en lugar de ser protonado, el\(OH\) grupo del hemiacetal se convierte en un buen grupo saliente por fosforilación (este es un patrón que que conocemos de los capítulos 9 y 10). La identidad específica del grupo fosfato activador varía para diferentes reacciones, por lo que se generaliza en la siguiente figura.
Mecanismo para la formación (bioquímica) de acetal:
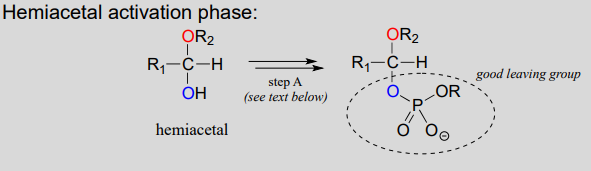
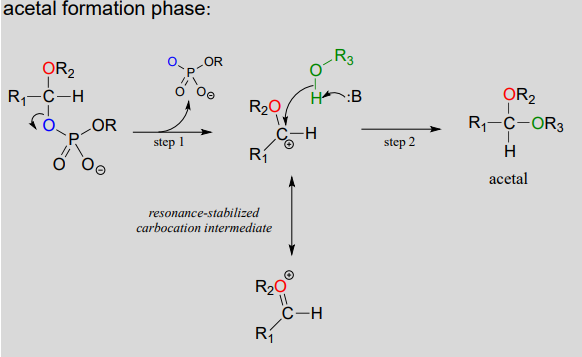
- Etapa A (Fase de activación): Esta fase de la reacción varía según el caso particular, pero siempre implica etapas de transferencia del grupo fosfato que son familiares del capítulo 9. Lo más importante para nuestra discusión actual, sin embargo, es simplemente que el grupo hidroxilo en el hemiacetal se ha activado -es decir, convertido en un buen grupo saliente- por fosforilación.
- Paso 1: Ahora que el grupo saliente ha sido activado, hace su trabajo y se va, resultando en un carbocatión estabilizado por resonancia.
- Paso 2: Un alcohol nucleofílico en la cadena de celulosa en crecimiento ataca el carbocatión altamente electrofílico para formar un acetal. Aquí es donde se determina la estereoquímica del nuevo enlace glicosídico: dependiendo de la reacción, el nucleófilo alcohólico podría acercarse desde cualquier lado del carbocatión plano.
Para reiterar: aquí es importante reconocer el patrón\(S_N1\) mecanicista familiar en juego: en el paso A, un grupo pobre de salida se convierte en un buen grupo saliente, en el paso 1 el grupo saliente se va y se deja atrás un carbocatión estabilizado, y en el paso 2 un nucleófilo ataca para formar un nuevo enlace y completar el proceso de sustitución. Mira hacia atrás las\(S_N1\) reacciones que vimos en el capítulo 8 si estás teniendo problemas para hacer esta conexión mecanicista.
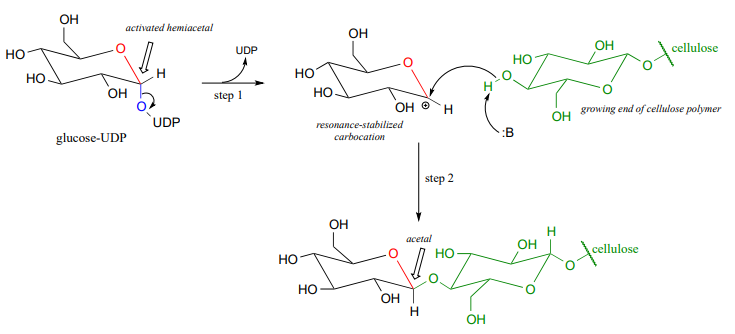
Ahora, veamos específicamente el mecanismo de reacción de la glicosil transferasa en el que se forma un nuevo enlace glicosídico en una cadena de celulosa en crecimiento. La glucosa (un hemiacetal) se activa primero a través de dos pasos enzimáticos de transferencia de fosfato: el paso A1, una reacción de isomerización de fosfato con un mecanismo similar a la reacción en el problema P9.13, seguido de un paso A2 dependiente de UTP, para lo cual se le invitó a proponer un mecanismo en el problema P9.12.
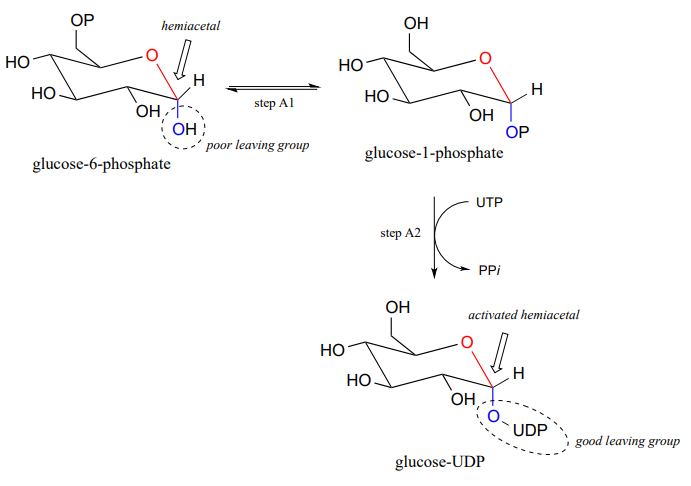
El grupo UDP en glucosa-UDP luego sale (paso 1 a continuación), formando un intermedio de carbocatión estabilizado por resonancia. El ataque del grupo alcohol en la cadena de celulosa en crecimiento en la etapa 2 forma el enlace glicosídico (acetal). Tenga en cuenta la inversión de la estereoquímica.
Hidrólisis de enlace glicosídico
Los acetales se pueden hidrolizar de nuevo a hemiacetales. Observe que una conversión de acetal a hemiacetal es una reacción\(S_N1\) tipo con un nucleófilo de agua y un grupo saliente de alcohol.
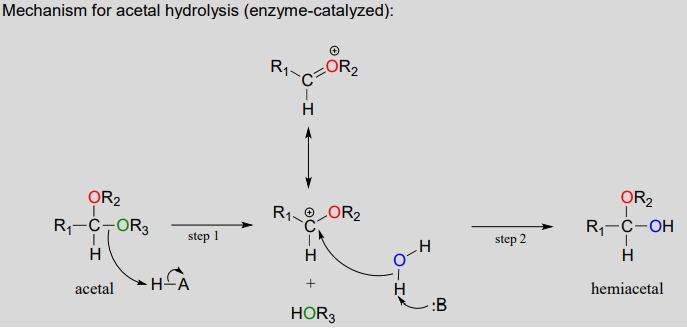
En la etapa 1, un alcohol es protonado por un grupo ácido cercano a medida que se rompe para formar un intermedio de carbocatión estabilizado por resonancia. El carbocatión es atacado por una molécula nucleofílica de agua en la etapa 2 para formar un hemiacetal.
El mecanismo general anterior se aplica a las reacciones catalizadas por enzimas glicosidasas, las cuales catalizan la escisión de los enlaces glicosídicos en carbohidratos. En la introducción a este capítulo, aprendimos sobre la investigación en curso en el campo del etanol celulósico. Recordemos que el principal cuello de botella en la producción de etanol a partir de fuentes como el pasto o la madera es la etapa catalizada por celulasa en la que se escinden los enlaces glicosídicos en la celulosa. Los microbios que digieren celulosa tienen varias formas diferentes pero estrechamente relacionadas de enzimas celulasa, todas trabajando en concierto para escindir la celulosa en trozos cada vez más pequeños hasta que las moléculas de glucosa individuales estén libres para convertirse en etanol por el proceso de fermentación. A continuación se muestra un mecanismo representativo para una reacción de celulasa.
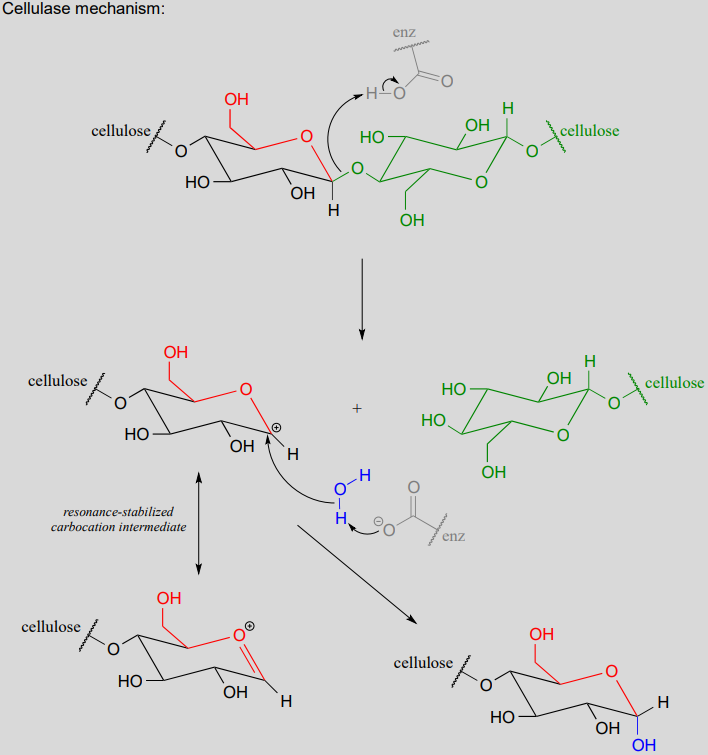
Las enzimas amilasas que digieren almidón utilizadas en el proceso de producción de etanol de maíz catalizan reacciones similares de hidrólisis de glucósidos, siendo la principal diferencia la estereoquímica opuesta en el carbono anomérico del sustrato.
Observe que la reacción formadora de enlaces de glucosósido de celulosa requiere que la célula 'gaste' una molécula de UTP de alta energía, pero la reacción de ruptura de enlaces de glucósido de celulasa no. Utilice sus conocimientos de termodinámica química para explicar esta observación.
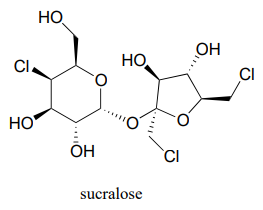
A continuación se muestra la estructura del edulcorante artificial sucralosa. Identificar los dos carbonos anoméricos en el disacárido.
Robinose es un disacárido que se encuentra en 'Chenille Plant', un arbusto floreciente originario de las islas del Pacífico.
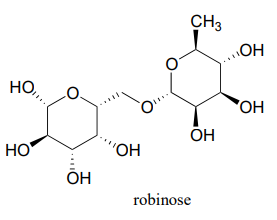
- Identificar los dos carbonos anoméricos y el enlace glicosídico en la robinosa.
- Usando el mismo sistema de numeración de carbono que para la glucosa en la figura anterior, complete los números de carbono (#1 a #6) para cada uno de los monosacáridos que componen la robinosa.
- Con base en lo que se sabe de las reacciones formadoras de enlaces glicosídicos en la naturaleza, proponer un mecanismo razonable para la unión de los dos monosacáridos, comenzando con la especie hemiacetal activada, asumiendo que se trata de una especie UDP como en la reacción formadora de enlaces gycosídicos de celulosa.
- Dibujar la forma de cadena abierta de cada uno de los monosacáridos
Vuelva a mirar las estructuras de los fragmentos de dos glucosa de celulosa y amilosa que se muestra la introducción a este capítulo. Una característica estructural del polímero de celulosa lo hace inherentemente más resistente a la hidrólisis enzimática en comparación con el almidón. Explique.
- Pista
-
T hink sobre las interacciones intermoleculares.


