10.3: Hemiacetales, Hemicetales e Hidratos
- Page ID
- 72365
Visión general
Uno de los ejemplos más importantes de una reacción de adición nucleofílica en bioquímica, y en la química de carbohidratos en particular, es la adición de un alcohol a una cetona o aldehído. Cuando un alcohol se suma a un aldehído, el resultado se llama hemiacetal; cuando un alcohol se agrega a una cetona el producto resultante es un hemicetal.
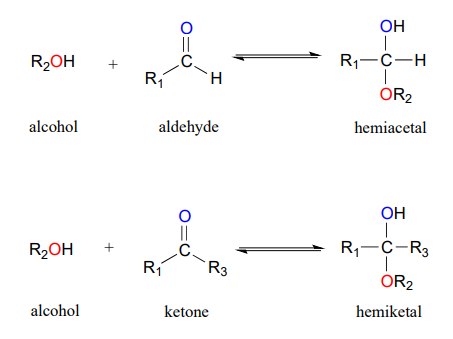
(El prefijo 'hemi' (mitad) se usa en cada término porque, como veremos pronto, puede ocurrir la adición de un segundo nucleófilo alcohólico, resultando en especies llamadas acetales y cetales.)
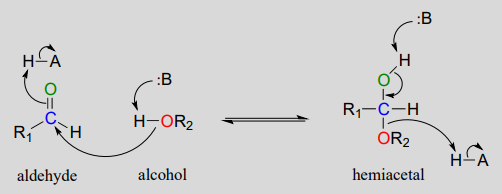
La conversión de un alcohol y aldehído (o cetona) en un hemiacetal (o hemicetal) es un proceso reversible. A continuación se muestra el mecanismo generalizado para el proceso a pH fisiológico.
Mecanismo bioquímico de formación de hemiacetales:
En general, los hemiacetales (y hemicetales) son más altos en energía que sus componentes aldehído-alcohol, por lo que el equilibrio para la reacción se encuentra a la izquierda. Como veremos pronto en el contexto de la glucosa y otros azúcares, sin embargo, los hemiacetales cíclicos de cinco y seis miembros son considerablemente menores en energía, y se ven favorecidos en el equilibrio: recordar del capítulo 3 la estabilidad inherente de los anillos de cinco y seis miembros.
Los aldehídos y cetonas, cuando están en solución acuosa, existen en equilibrio con su forma hidratada. Se forma un hidrato como resultado de una molécula de agua que se agrega al carbono carbonílico del aldehído o cetona.
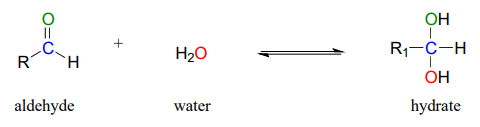
Aunque debes tener en cuenta que los grupos aldehído y cetona pueden existir en gran medida en sus formas hidratadas cuando están en solución acuosa (dependiendo de su estructura), generalmente se dibujan en su forma no hidratada en aras de la simplicidad.
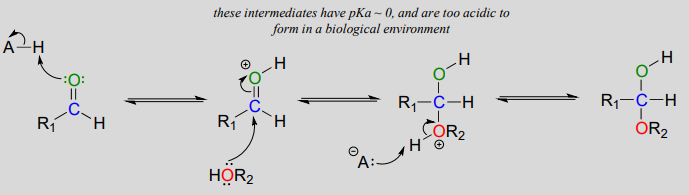
El mecanismo que acabamos de ver para la formación de hemiacetales se aplica a reacciones bioquímicas que ocurren en fisiológicas\(pH\). En el laboratorio orgánico, sin embargo, la formación de hemiacetales y hemicetales generalmente se produce en presencia de un ácido fuerte. El ácido cataliza la reacción protonando el oxígeno carbonílico, aumentando así la electrofilicidad del carbono carbonilo. Observe en el siguiente mecanismo que se dibujan intermedios altamente ácidos que no sería razonable proponer para los correspondientes mecanismos bioquímicos que ocurren en fisiológicos\(pH\).
Formación de hemiacetal catalizada por ácido (no biológica):
Azúcares como hemiacetales y hemicetales intramoleculares
Como se indicó anteriormente, las reacciones de los hemiacetales y hemicetales son centrales para la química de los carbohidratos. Recordemos que las moléculas de azúcar generalmente contienen un grupo funcional aldehído o cetona, además de múltiples grupos alcohol. Los azúcares aldehídos a menudo se denominan aldosis; los azúcares cetónicos como cetosas. Por ejemplo, la glucosa es una aldosa y la fructosa es una cetosa; sus estructuras se dibujan a continuación en la proyección de Fischer:
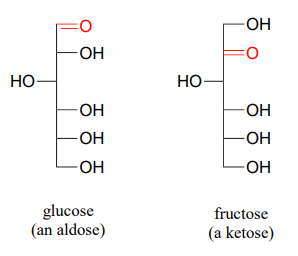
¿Qué término describe la relación entre glucosa y fructosa (en otras palabras, qué tipo de isómeros son)?
La glucosa y la fructosa se muestran arriba en su forma de cadena abierta. Sin embargo, recuerde de la sección 1.3 que en solución acuosa, la glucosa, la fructosa y otros azúcares de cinco o seis carbonos se interconvierten rápidamente entre las formas cíclicas y de cadena lineal. Esto ocurre a través de la formación de hemiacetales y hemicetales intramoleculares. Esto simplemente significa que el grupo 'R' del alcohol ya está unido covalentemente al grupo 'R' del aldehído (R1 en nuestro mecanismo general).
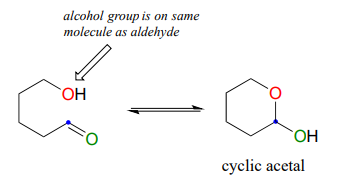
A diferencia de la mayoría de las reacciones bioquímicas que verás en este texto, las reacciones de ciclación del azúcar no son catalizadas por enzimas: ocurren de manera espontánea y reversible en solución acuosa. Para la mayoría de los azúcares de cinco y seis carbonos, las formas cíclicas predominan en equilibrio.
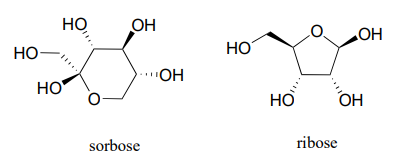
La forma cíclica de la glucosa es un anillo de seis miembros, con un hemiacetal intramolecular formado por el ataque del hidroxl sobre el carbono #5 al carbono aldehído (carbono #1, también llamado carbono anomérico en terminología de carbohidratos).
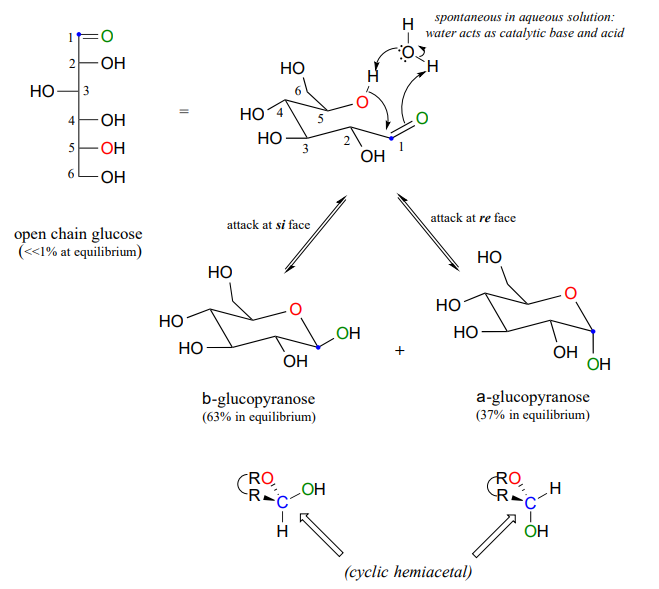
La forma cíclica de la glucosa se llama glucopiranosa. Como se discutió anteriormente, el ataque nucleofílico a un grupo carbonilo plano puede ocurrir en cualquier cara del plano, conduciendo a dos resultados estereoquímicos diferentes, en este caso, a dos diastereómeros diferentes. En la nomenclatura de carbohidratos, estos dos diastereómeros se denominan los anómeros a y b de la glucopiranosa.
Debido a que la formación de glucopiranosa ocurre espontáneamente sin catálisis enzimática, ¿no deberían formarse cantidades iguales de estos dos anómeros? De hecho, esto no sucede: hay casi el doble de un anómero que del otro en equilibrio. ¿Por qué es esto? Recuerde (sección 3.2) que los anillos de seis miembros existen predominantemente en la conformación de la silla, y que la conformación de la silla de menor energía es aquella en la que se minimizan las interacciones desfavorables entre los sustituyentes; en la mayoría de los casos, esta es la conformación en la que los sustituyentes más grandes están en el posición ecuatorial. En la conformación de silla de menor energía del anómero b mayor de la glucopiranosa, todos los grupos hidroxilo están en la posición ecuatorial, pero en el anómero menor un grupo hidroxilo es forzado a la posición axial. Como resultado, el anómero a es mayor en energía, y menos abundante en equilibrio.
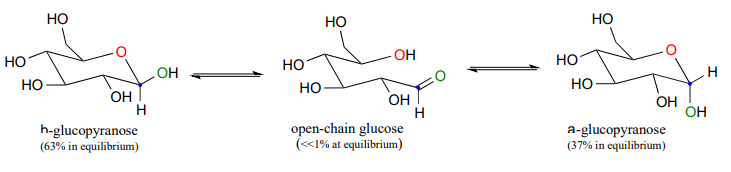
Dibujar un mecanismo para la conversión de a-glucopiranosa en glucosa de cadena abierta.
La fructosa en solución acuosa forma un hemicetal cíclico de seis miembros llamado fructopiranosa cuando el oxígeno hidroxilo en el carbono #6 ataca al carbono cetona (carbono #2, el carbono anomérico en fructosa).
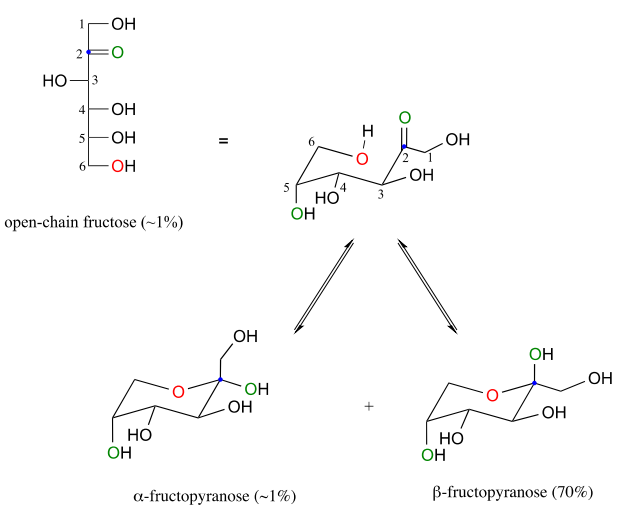
En este caso, el anómero b se ve fuertemente favorecido en equilibrio por una relación de 70:1, debido a que en el anómero menor el\(CH_2OH\) grupo más voluminoso ocupa una posición axial.
Observe en la figura anterior que los porcentajes de\(\alpha \) y\(\beta \) los anómeros presentes en equilibrio no suman el 100%. La fructosa también existe en solución como un hemicetal cíclico de cinco miembros, referido en la nomenclatura de carbohidratos como fructofuranosa. En la formación de fructofuranosa a partir de fructosa de cadena abierta, el grupo hidroxilo en el quinto carbono ataca a la cetona.
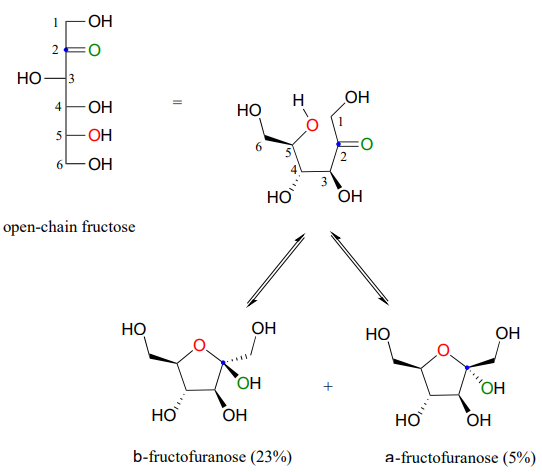
En solución acuosa, entonces, la fructosa existe como una mezcla de equilibrio de 70%\(\beta \) -fructopiranosa, 23%\(\beta \) -fructofuranosa y porcentajes menores de los\(\alpha \) anómeros de cadena abierta y cíclicos. La forma\(\beta \) -piranosa de fructosa es uno de los compuestos más dulces conocidos, y es el componente principal del jarabe de maíz alto en fructosa. La forma\(\beta \) -furanosa es mucho menos dulce.
Aunque hemos estado viendo ejemplos específicos de glucosa y fructosa, otros monosacáridos de cinco y seis carbonos también existen en solución como mezclas de equilibrio de chais abiertos y hemiacetales y hemicetales cíclicos. Sin embargo, es poco probable que los monosacáridos más cortos experimenten reacciones análogas de formación de anillos debido a la inestabilidad inherente de los anillos de tres y cuatro miembros.
- Identificar el carbono anomérico de cada uno de los azúcares que se muestran a continuación, y especificar si la estructura mostrada es un hemiacetal o hemicetal.
- Dibujar mecanismos para la ciclación de las formas de cadena abierta a las formas cíclicas mostradas.